





































所属成套资源:新人教版化学必修第一册PPT课件整册
人教版高中化学必修第一册第四章物质结构元素周期律导学案+课件
展开
这是一份人教版高中化学必修第一册第四章物质结构元素周期律导学案+课件,文件包含412pptx、43pptx、413pptx、411pptx、422pptx、421pptx、43docx、412docx、411docx、413docx、422docx、421docx等12份课件配套教学资源,其中PPT共295页, 欢迎下载使用。
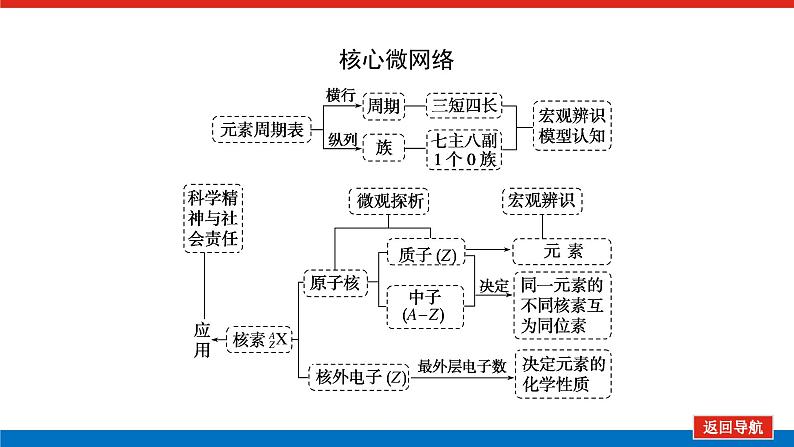
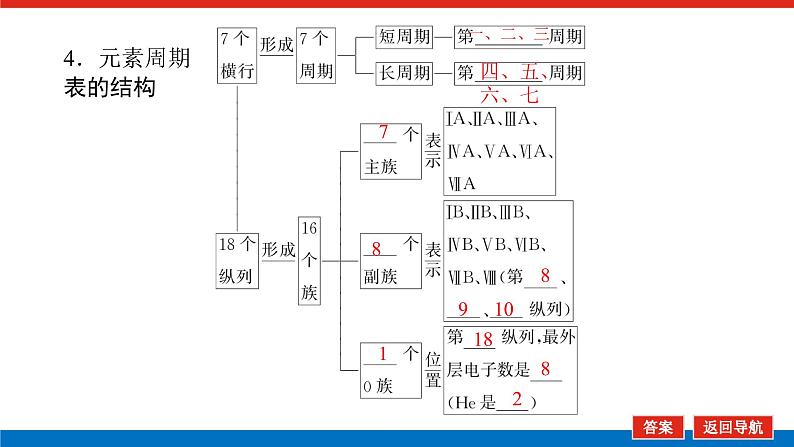
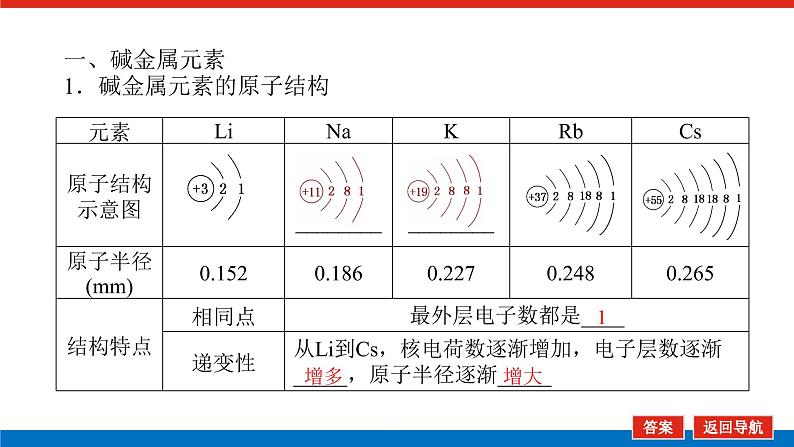
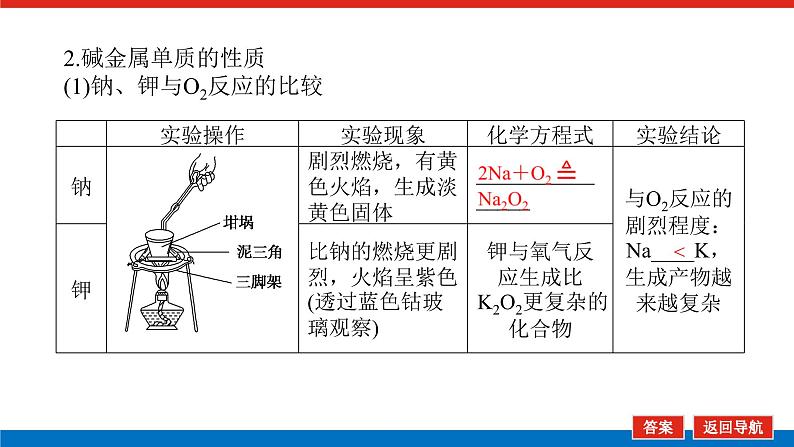
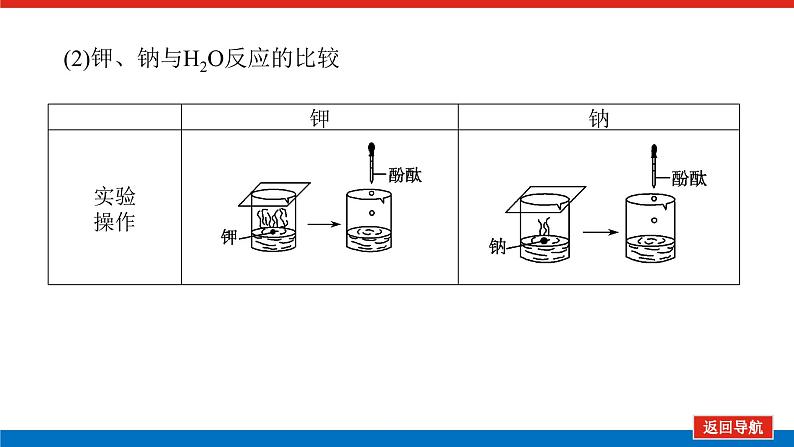
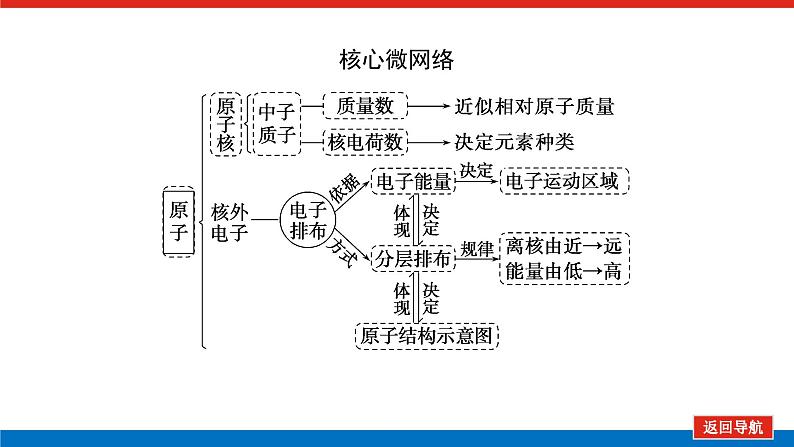
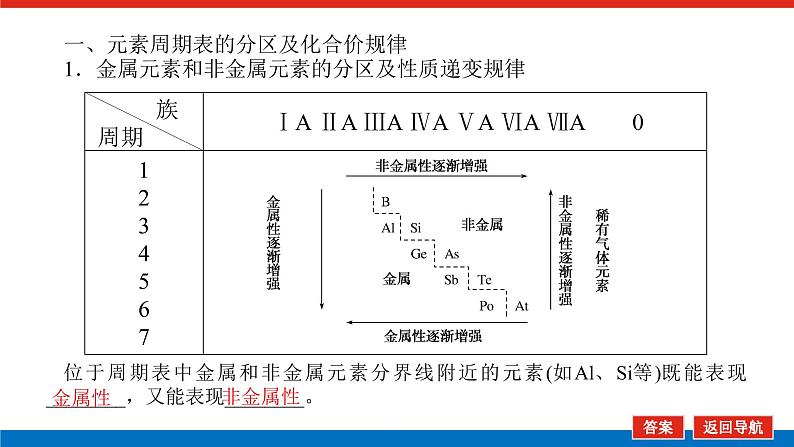
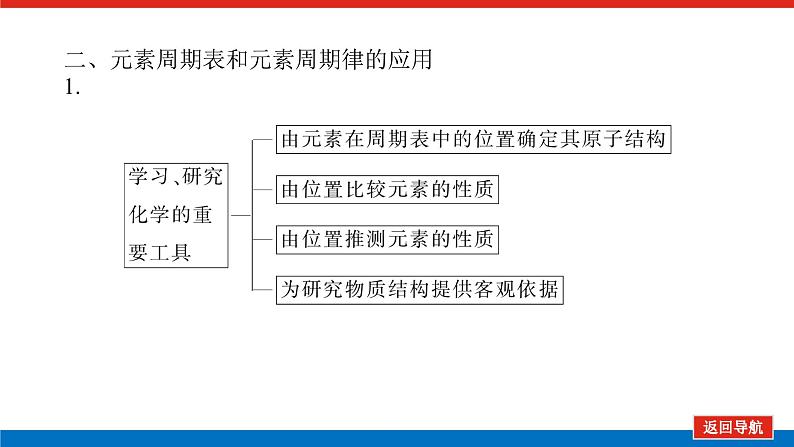
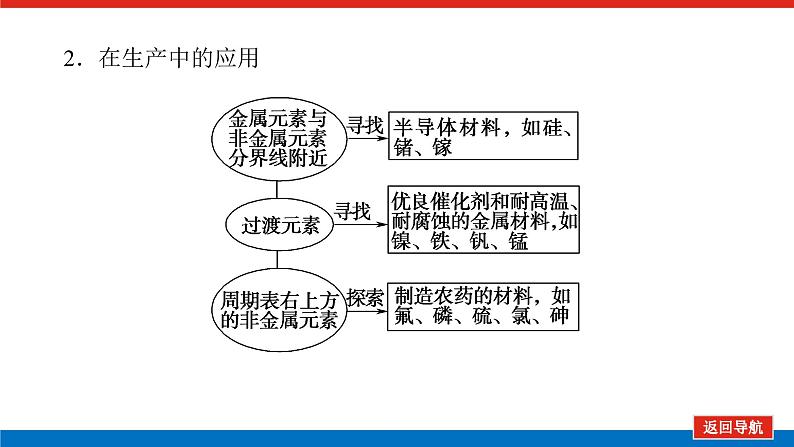
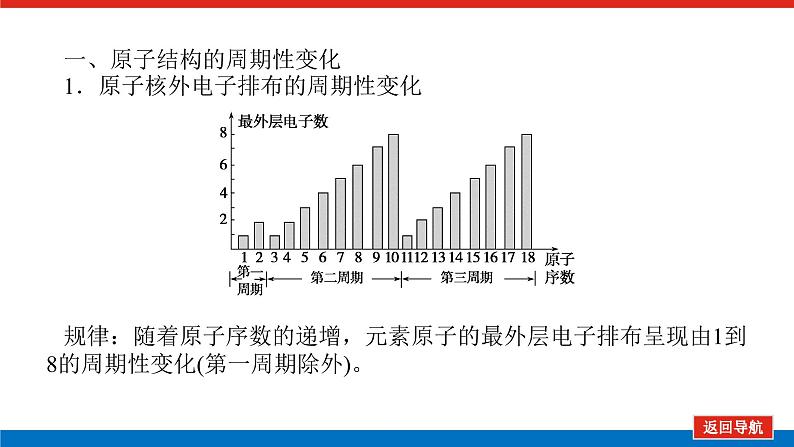
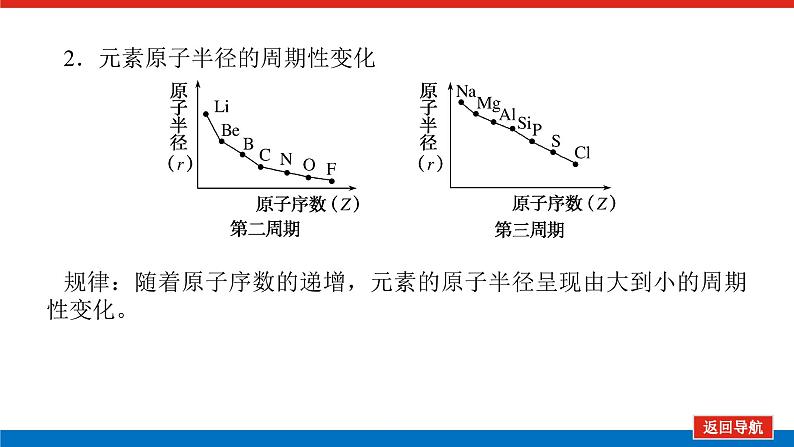
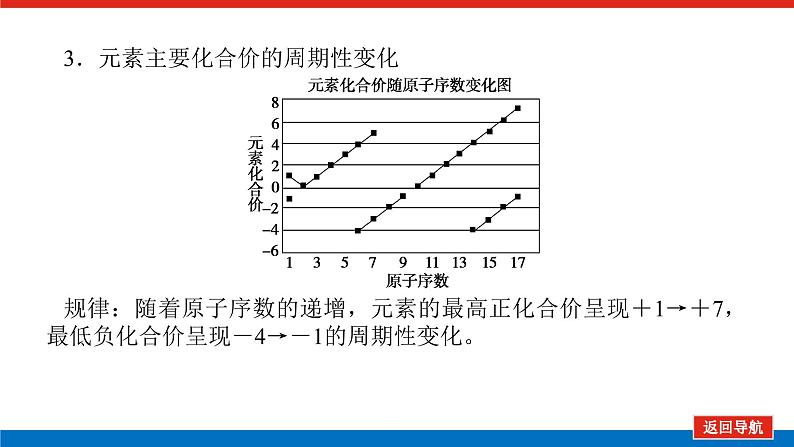
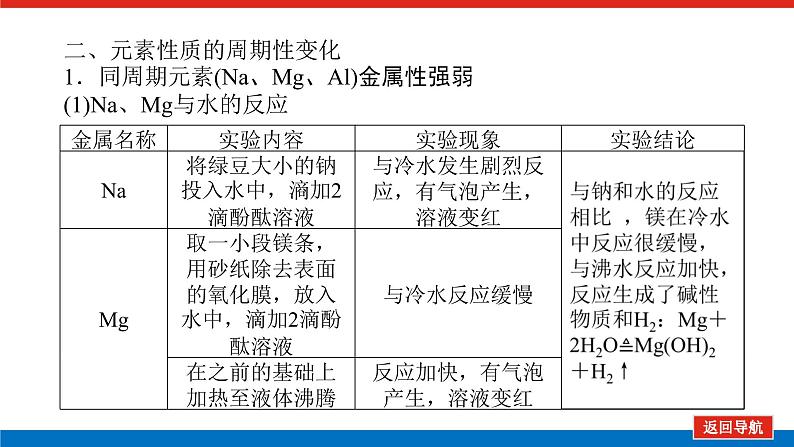
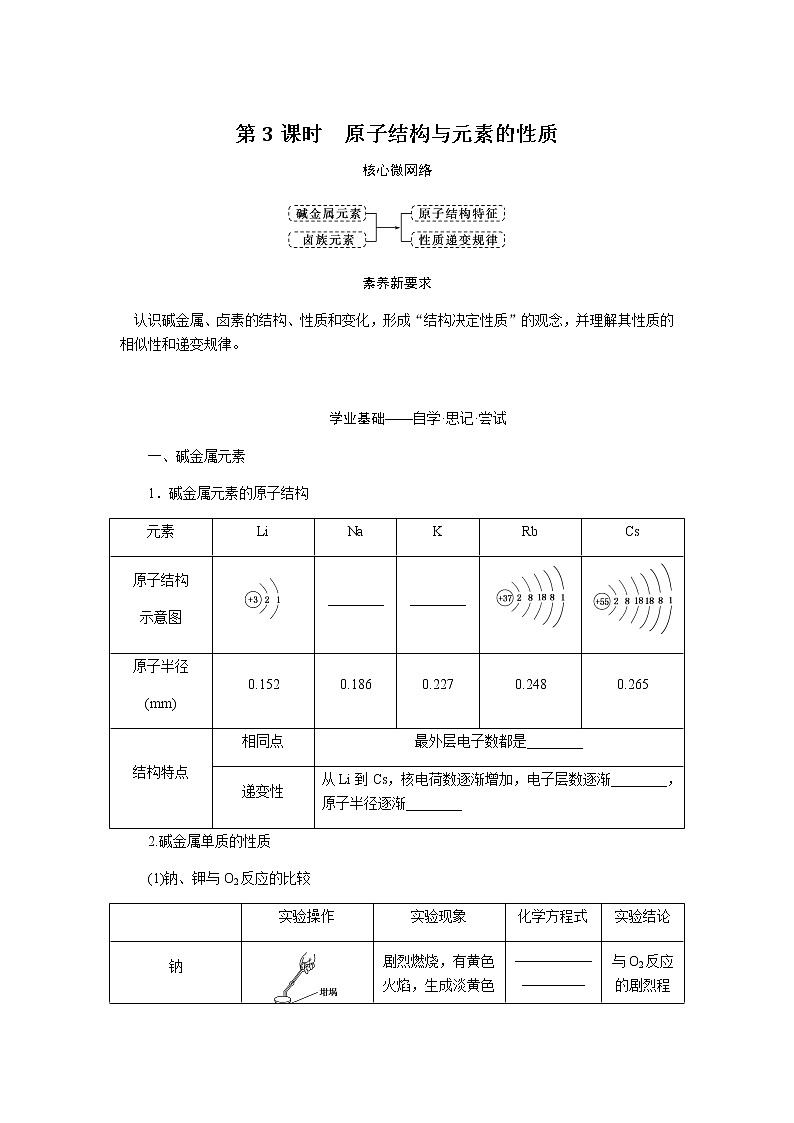
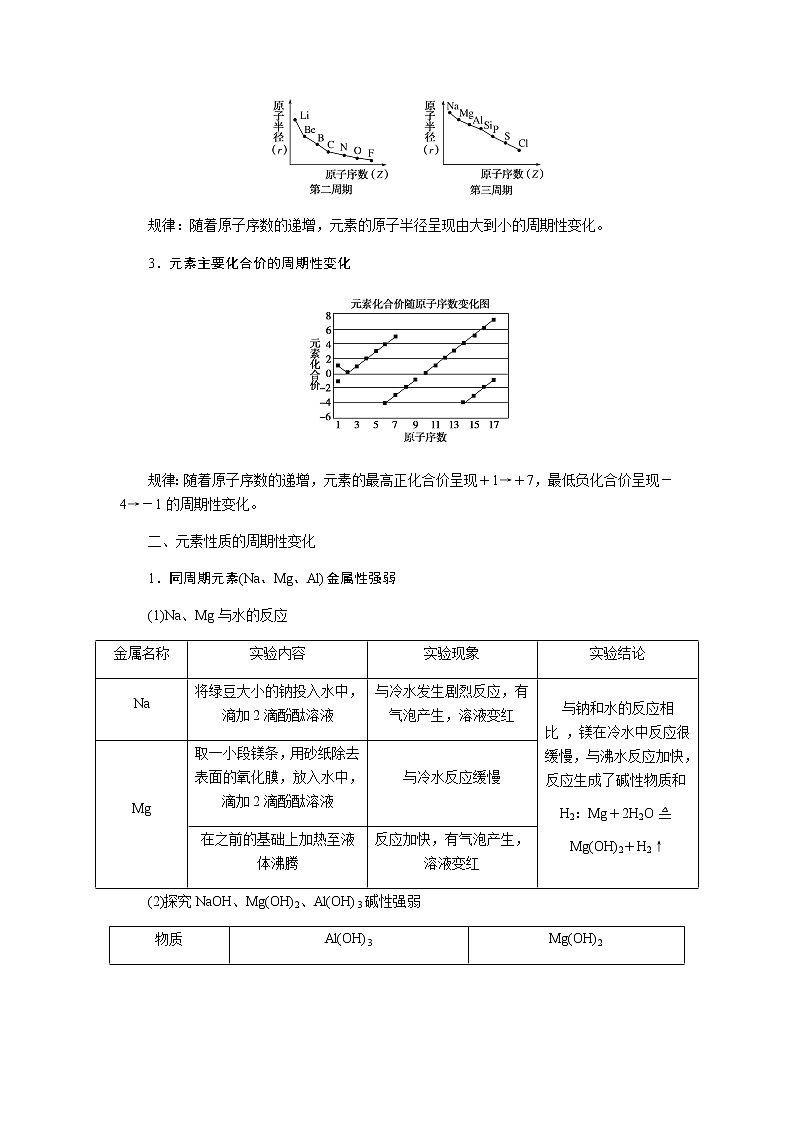
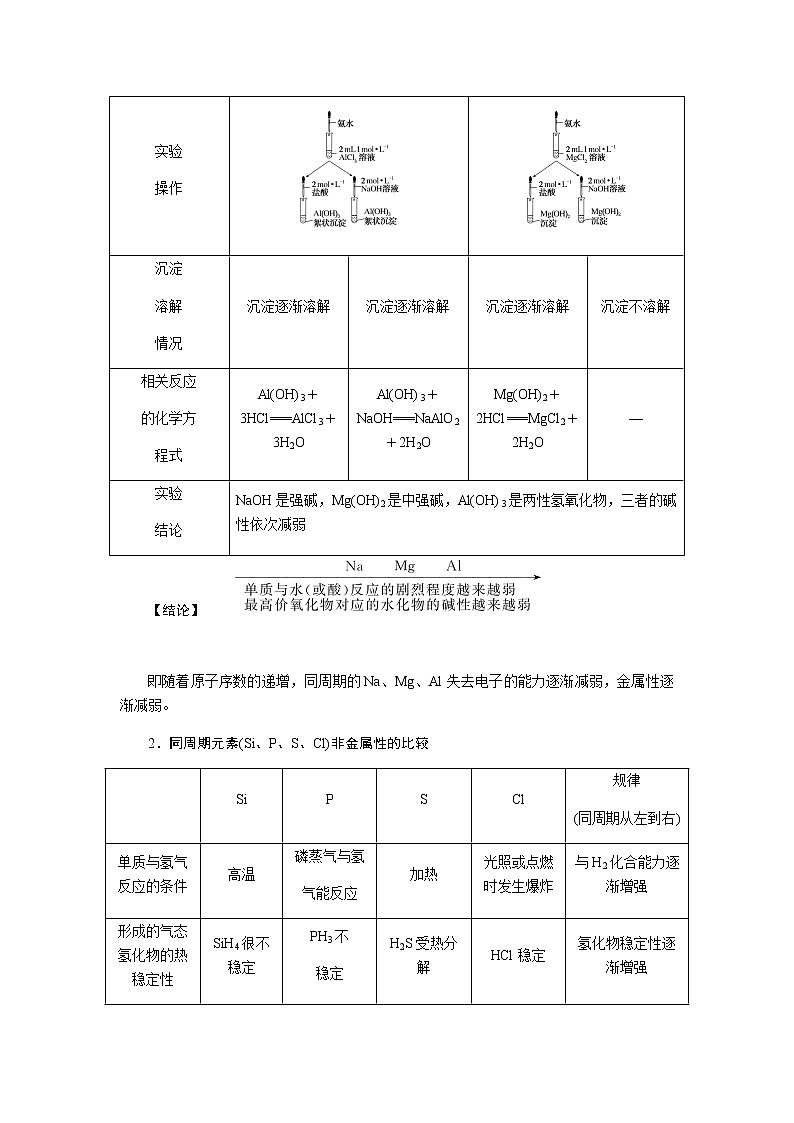
第2课时 元素周期表和元素周期律的应用核心微网络素养新要求1.能利用元素在元素周期表中的位置和原子结构,分析、预测、比较元素及其化合物的性质。2.体会元素周期律(表)在学习元素及其化合物知识及科学研究中的重要作用。 学业基础——自学·思记·尝试一、元素周期表的分区及化合价规律1.金属元素和非金属元素的分区及性质递变规律 族周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0 1234567 位于周期表中金属和非金属元素分界线附近的元素(如Al、Si等)既能表现________,又能表现________。2.元素化合价与其在周期表中的位置关系(1)价电子可在化学反应中发生变化、与元素的化合价有关的电子称为价电子。主族元素的价电子就是其最外层电子。(2)化合价规律二、元素周期表和元素周期律的应用1.2.在生产中的应用[即学即练]1.判断正误,正确的打“√”,错误的打“×”(1)氮元素的最高正价与最低负价绝对值之差为2。( )(2)第ⅥA族的所有元素的最高正价均为+6价。( )(3)元素的原子得电子越多,非金属性越强;失电子越多,金属性越强。( )(4)原子最外层电子数大于3(小于8)的元素一定是非金属元素。( )(5)元素周期表中位于金属与非金属元素分界线附近的元素属于过渡元素。( )2.[2022·青岛二中高一检测]砒霜主要成分为三氧化二砷。下列叙述正确的是( )A.砷元素的最高化合价为+6B.砷元素是第五周期的主族元素C.砷原子的第3个电子层含有18个电子D.与砷同主族的上一周期元素原子序数为253.下列说法错误的是 ( )A.作半导体材料的元素大多数位于周期表中金属元素和非金属元素的分界线附近B.农药中常含有的元素通常在元素周期表的右上方区域内C.构成催化剂的元素通常在元素周期表的左下方区域内D.在周期表过渡元素中寻找作耐高温和耐腐蚀的合金材料的元素4.某主族元素R的最高化合价与最低化合价的代数和为4,下列叙述不正确的是 ( )A.R的气态氢化物为RH2B.R的最高价氧化物对应的水化物为H2RO4C.R可能是第ⅥA族元素D.R的最高价氧化物为RO35.镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述中不正确的是( )A.在化合物中呈+2价B.单质能和水反应,放出氢气C.镭比钙的金属性弱D.碳酸镭难溶于水6.我国著名化学家张青莲精确地测定了锗(Ge)、锌等九种元素的相对原子质量,得到的新值被作为国际新标准。已知锗的原子序数为32。(1)它位于元素周期表中第________周期第________族。(2)锗类似于铝,能溶于氢氧化钠溶液,其主要原因是________(填序号)。①它与硅位于同一主族②它位于周期表中金属与非金属分界线附近③它位于边界线附近④它是两性物质(3)材料科学是目前全世界研究的热点,为了寻找半导体材料,科学家应在元素周期表中某区域寻找元素组成材料,该区域是________(填字母)。A.左上角B.右上角C.过渡元素D.金属与非金属分界线附近核心素养——合作·探究·分享 目标1 元素周期表和周期律的应用 例1 门捷列夫在研究周期表时预言了包括“类铝”“类硅”在内的11种元素。(1)门捷列夫预言的“类硅”,多年后被德国化学家文克勤发现,命名为锗(Ge)。①已知主族元素锗的最高化合价为+4价,其最高价氧化物对应的水化物为两性氢氧化物。试比较元素的非金属性Si________Ge(用“>”或“<”表示)。②若锗位于硅的下一周期,写出“锗”在周期表中的位置________。根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是__________________________。③硅和锗单质分别与H2反应时,反应较难进行的是________(填“硅”或“锗”)。(2)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。①由镓的性质推知,镓与铝同主族,且位于铝的下一周期。试从原子结构的角度解释镓与铝性质相似的原因________________________________________________________________________________________________________________________________________________。②为判断Ga(OH)3是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液,________和________。[提升1] [2022·潍坊高一检测]2022年是门捷列夫发现元素周期表153周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( ) W XYZ A. 原子半径:W<XB.常温常压下,Y单质为固态C.简单气态氢化物热稳定性:Z<WD.X的最高价氧化物对应的水化物是强碱关键能力目标2 元素“位、构、性”的综合判断例2 金属元素(前18号)甲~戊在元素周期表中的相对位置如图所示,下列判断中正确的是( )甲乙 丙丁戊A.原子半径:丙<丁<戊B.金属性:甲>丙C.氢氧化物碱性:丙>丁>戊D.最外层电子数:甲>乙 状元随笔 在比较元素的性质时,有时需要借助参照物,如比较Ca(OH)2和Al(OH)3的碱性大小,可借助镁,三种元素在周期表中的位置如图,故金属性是Ca>Mg>Al,故碱性是>Al(OH)3。镁铝钙 [提升2] X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示: XYZMRQ原子半径/nm 0.1860.0740.0990.143主要化合价 -4,+4 -2-1,+7+3其他阳离子核外无电子半导体材料焰色试验呈黄色 (1)R在元素周期表中的位置是________;R在自然界中有质量数为35和37的两种核素,它们之间的关系为________。(2)Z的单质与水反应的化学方程式为________________________________________________________________________。(3)Y与R相比,非金属性较强的是________(用元素符号表示),下列事实能证明这一结论的是________(填字母)。a.常温下Y的单质呈固态,R的单质呈气态b.稳定性:XR>YX4c.最高价氧化物对应的水化物的酸性:HRO4>H2YO3(4)根据表中数据推测Y的原子半径的范围:________nm<rY<________nm。(5)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙―→丙+水,则丙的化学式为________(写一种即可)。 状元随笔 金属性越强单质与水或酸反应放出氢气越容易最高价氧化物对应的水化物碱性越强非金属性越强单质与H2越易化合最高价氧化物对应的水化物酸性越强氢化物越稳定关键能力“位、构、性”三角关系1.原子结构元素在周期表中的位置。原子结构位置。2.原子结构元素的化学性质。原子结构性质。3.元素在周期表中的位置原子结构和元素性质。 “位、构、性”中的三个规律(1)“三角形”规律所谓“三角形”,即A、B处于同周期,A、C处于同主族(图中ABC位置),可推出三者原子结构、性质方面的规律。如原子序数:C>B>A;原子半径:r(C)>r(A)>r(B)。 A、B、C若为非金属元素,则非金属性:B>A>C;单质的氧化性:B>A>C;气态氢化物的稳定性:B>A>C;阴离子的还原性:C>A>B。若A、B、C为金属,则金属性:C>A>B;单质的还原性:C>A>B;最高价氧化物对应水化物的碱性:C>A>B;阳离子的氧化性:B>A>C。(2)“对角线”规律在第二、第三周期中,某些元素处于不同的主族。但其化学性质却很相似,如Li与Mg、Be与Al、B与Si等,这一规律称为“对角线”规律[注意:此对角线只能是左上右下的对角线,即第二周期第N主族元素与第三周期第(N+1)主族元素的性质相似](图中A、D位置)。应用此规律可根据已知元素及其化合物的性质,推导未知元素及其化合物的性质。(3)两性规律周期数等于其主族序数的元素一般具有两性,由此可推断元素及其化合物的性质。 学考评价——夯实·测控·演练1.元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是( )A.同一元素不可能既表现金属性又表现非金属性B.第三周期元素的最高正化合价等于它所处的主族族序数C.短周期元素形成离子后,最外层都达到8电子稳定结构D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同2.某元素最高价氧化物对应水化物的化学式为H2XO3。这种元素的气态氢化物的化学式是( )A.HX B.H2XC.XH3 D.XH43.XYZ 已知短周期主族元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )A.原子半径:Z>Y>XB.X元素位于第二周期C.气态氢化物的稳定性:X>Y>ZD.最高价氧化物对应的水化物的酸性:Y>Z>X4.短周期主族元素R、X、Y、Z的原子序数依次增大,R的最简单气态氢化物是天然气的主要成分,X的+1价阳离子的电子层结构与氖原子相同。元素X和Z形成化合物G,G中X和Z元素的质量之比为23∶16。可溶性化合物E和F分别含元素Y、X,在10 mL 1.0 mol·L-1E溶液中滴加1.0 mol·L-1F溶液,产生沉淀的物质的量与F溶液体积的关系如图所示。下列说法一定正确的是( )A.原子半径:X>Y>RB.最高价氧化物对应水化物的酸性:Z>Y>RC.X和Y的单质组成的混合物不能完全溶于水D.金属性:Y>X5.下表是周期表中的一部分,根据A~I在元素周期表中位置,用元素符号或化学式回答下列问题: 族周期ⅠAⅡAⅢAⅣAⅤAⅥAⅦA01A 2 DE GI3B C FH (1)表中元素,化学性质最不活泼的是________,只有负价而无正价的是__________,氧化性最强的单质是__________,还原性最强的单质是________。(2)元素的最高价氧化物对应的水化物中,碱性最强的是________,酸性最强的是________,呈两性的是________。(3)A分别与D、E、F、G、H形成的简单常见化合物的化学式分别为______________,最稳定的是________。(4)在B、C、D、E、F、G、H中,原子半径最大的是________。6.[2022·海南三亚一中高一检测]短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为16。Y的单质是空气中含量最多的气体,Z原子的最外层电子数是其内层电子数的3倍,W是短周期中金属性最强的元素。下列说法正确的是( )A.X位于元素周期表中第二周期第ⅤA族B.原子半径:r(X)>r(Y)>r(Z)>r(W)C.X、Y、Z的非金属性依次减弱D.由Z和W组成的化合物不止一种练后感悟元素“位、构、性”规律中的特例(1)绝大多数原子的原子核是由质子和中子构成的,只有氢无中子。(2)元素周期表中的周期一般都是从金属元素开始,但第一周期例外,是从氢元素开始的。(3)所有元素中,碳元素形成的化合物种类最多。(4)非金属氧化物一般是酸性氧化物,但NO、CO等不是酸性氧化物。(5)氟、氧无正价:在Na2O2中氧显-1价;在NaH中氢显-1价。 第2课时 元素周期表和元素周期律的应用学业基础一、1.金属性 非金属性2.(2)主族序数 8即学即练1.答案:(1)√ (2)× (3)× (4)× (5)×2.答案:C3.答案:C4.答案:A5.解析:镭是第七周期第ⅡA族元素,根据同主族元素性质的递变规律可知,镭在化合物中的化合价为+2价,A正确;Ca能与水反应放出H2,则比Ca活泼的镭也能与水反应放出H2,B正确;镭的金属性比钙强,C错误;BaCO3难溶于水,则碳酸镭也难溶于水,D正确。答案:C6.解析:根据元素周期表的结构可知,锗属于第四周期第ⅣA族元素。锗位于元素周期表中金属与非金属分界线附近,它具有某些金属元素的性质,又具有某些非金属元素的性质,它是金属元素。答案:(1)四 ⅣA (2)② (3)D核心素养例1 答案:(1)①> ②第四周期第ⅣA族 半导体材料 ③锗(2)①原子最外层电子数都是3个 ②稀硫酸(或盐酸) NaOH溶液提升1 答案:D例2 解析:丙、丁、戊同周期,原子半径:丙>丁>戊;甲、丙同主族,金属性:甲<丙;氢氧化物碱性:丙>丁>戊;甲、乙同周期,最外层电子数:甲<乙。答案:C提升2 解析:由题中所给信息可知,X为H,Y为Si,Z为Na,M为O,R为Cl,根据原子半径和Q的主要化合价为+3,可知Q为Al。(4)由同周期元素原子半径的递变规律,知rCl<rSi<rAl,所以0.099 nm<rSi<0.143 nm。(5)题中元素的最高价氧化物对应的水化物能相互反应生成水:NaOH+Al(OH)3===NaAlO2+2H2O,所以丙为NaAlO2(其它合理答案也可)答案:(1)第三周期第ⅦA族 互为同位素 (2)2Na+2H2O===2NaOH+H2↑ (3)Cl bc (4)0.099 0.143(5)NaAlO2学考评价1.解析:有些非金属元素,如Si既有非金属性也有金属性,故A错误;H+最外层无电子,Li+最外层2个电子,因此并非所有的短周期元素原子形成离子后,最外层都达到8电子稳定结构,故C错误;同主族元素的原子,化学性质有相似性,但并不完全相同,故D错误。答案:B2.解析:由H2XO3知X呈+4价,则最外层有4个电子,其最低负价为-4价,氢化物为XH4,故选D。答案:D3.解析:由X、Y、Z为短周期元素及三者位置可推测X元素位于第二周期,B正确;原子半径Z>X>Y,A错误;非金属性越强,对应的气态氢化物越稳定,最高价氧化物对应的水化物酸性越强,因非金属性Y>X>Z,则气态氢化物稳定性Y>X>Z,最高价氧化物对应水化物的酸性Y>X>Z(X、Y不是O、F),若X、Y为O、F则无最高价氧化物,C、D错误。答案:B4.解析:根据题意可推知,R、X、Y、Z分别为C、Na、Al、S。钠与铝位于第三周期,钠原子半径大于铝,碳位于第二周期,所以原子半径Na>Al>C,选项A正确;碳的最高价氧化物对应水化物为碳酸,为弱酸,硫的最高价氧化物对应水化物为硫酸,为强酸,铝的最高价氧化物对应水化物为氢氧化铝,为两性氢氧化物,酸性最弱,选项B错误;钠单质与铝单质投入水中,若钠过量,与水反应可生成的氢氧化钠可以将铝全部溶解,选项C错误;同周期主族元素从左到右非金属性逐渐减弱,故金属性Na>Al,选项D错误。答案:A5.解析:根据元素在元素周期表中位置,可推出A~I元素分别为H、Na、Al、C、N、P、F、S、Ne。联系相应递变规律,这些元素中,Ne是稀有气体,性质最稳定;氟元素原子得电子能力最强,只有负价没有正价,其单质氧化性最强,气态氢化物最稳定;钠元素原子失电子能力最强,其单质还原性最强;最高价氧化物对应水化物中碱性最强的是NaOH,H2SO4酸性最强,Al(OH)3呈两性。原子的电子层数越多,半径越大;电子层数相同的原子,核电荷数越大,半径越小,故原子半径最大的是Na。答案:(1)Ne F F2 Na(2)NaOH H2SO4 Al(OH)3(3)CH4、NH3、PH3、HF、H2S HF(4)Na6.解析:Y的单质是空气中含量最多的气体,则Y是氮(N)元素,Z原子的最外层电子数是其内层电子数的3倍,则Z是氧(O)元素,W是短周期中金属性最强的元素,即钠(Na)元素,原子序数依次增大,它们原子的最外层电子数之和为16,则X只能是碳(C)元素。碳位于元素周期表中第二周期第ⅣA族,A项错误;同周期从左到右原子半径依次减小,则r(Li)>r(C)>r(N)>r(O),同主族从上到下原子半径依次增大,则r(Na)>r(Li),故r(Na)>r(C)>r(N)>r(O),B项错误;同周期C、N、O的非金属性依次增强,C项错误;由O和Na可以组成Na2O和Na2O2,D项正确。答案:D






