




















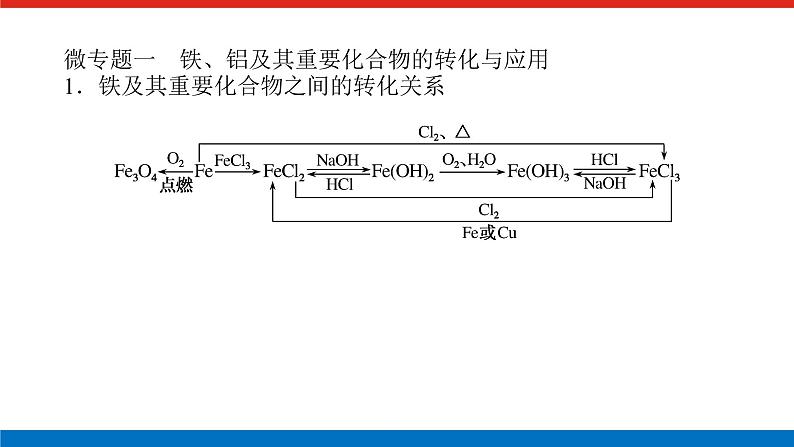
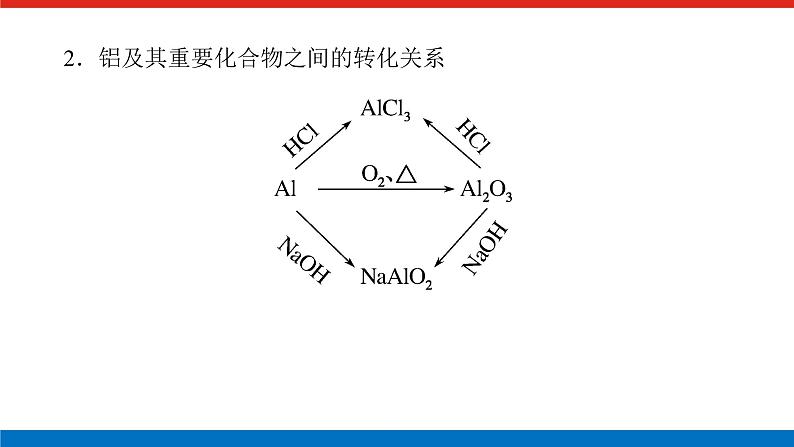

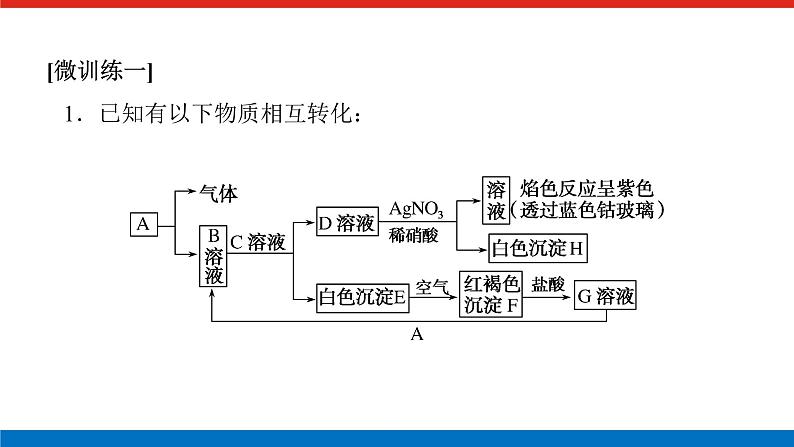

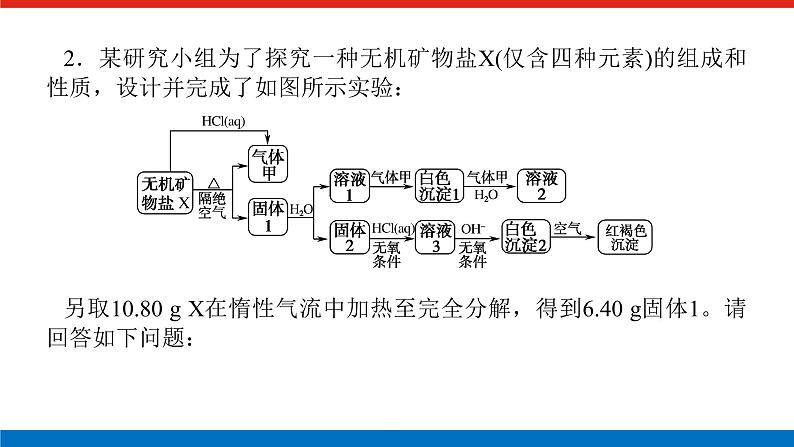


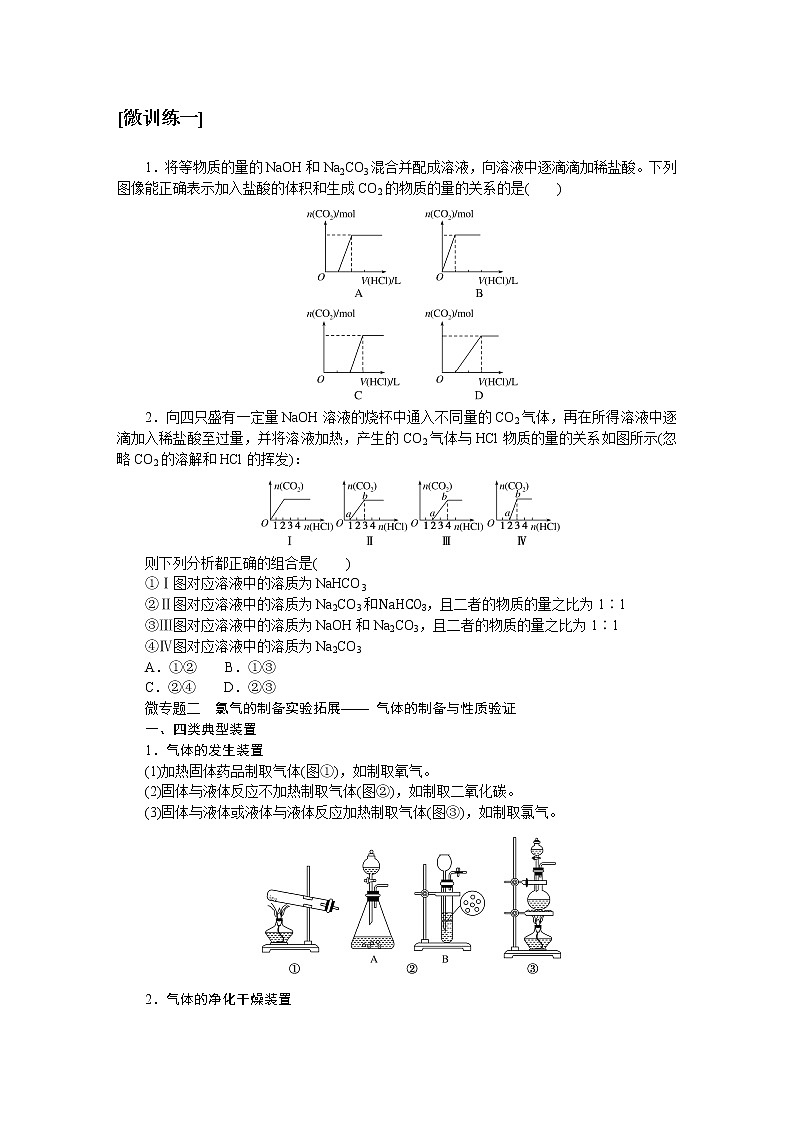
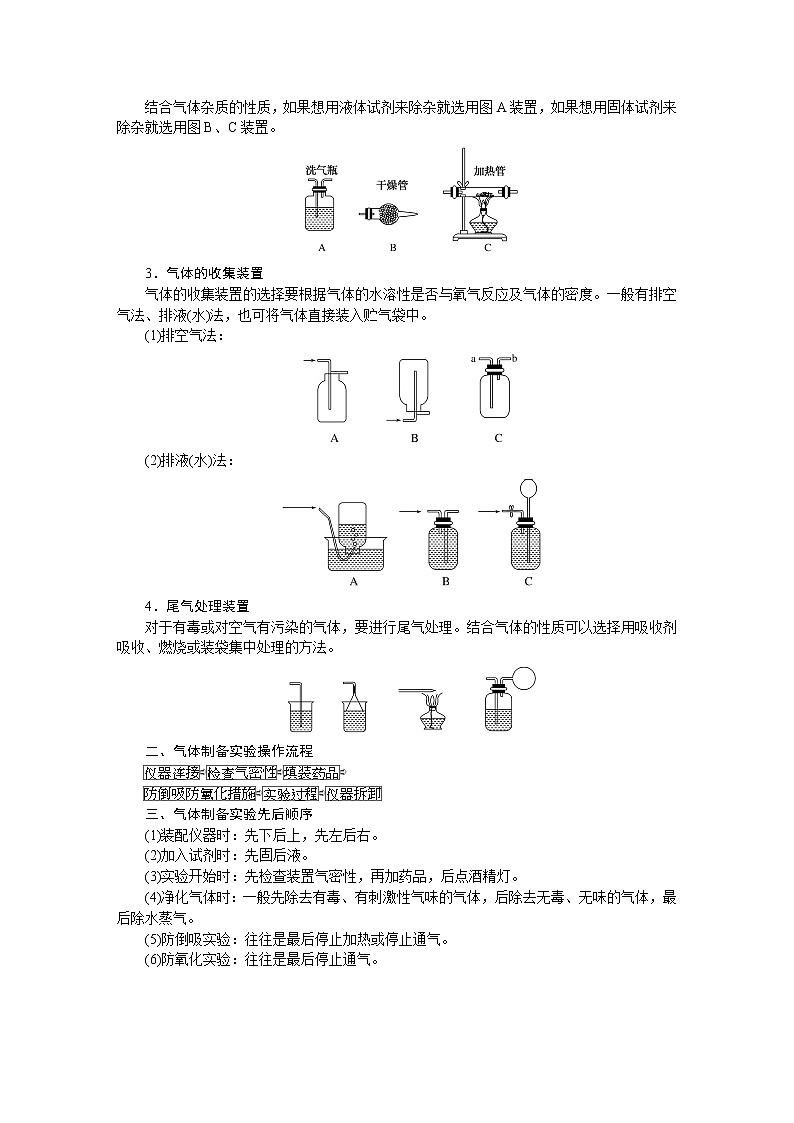


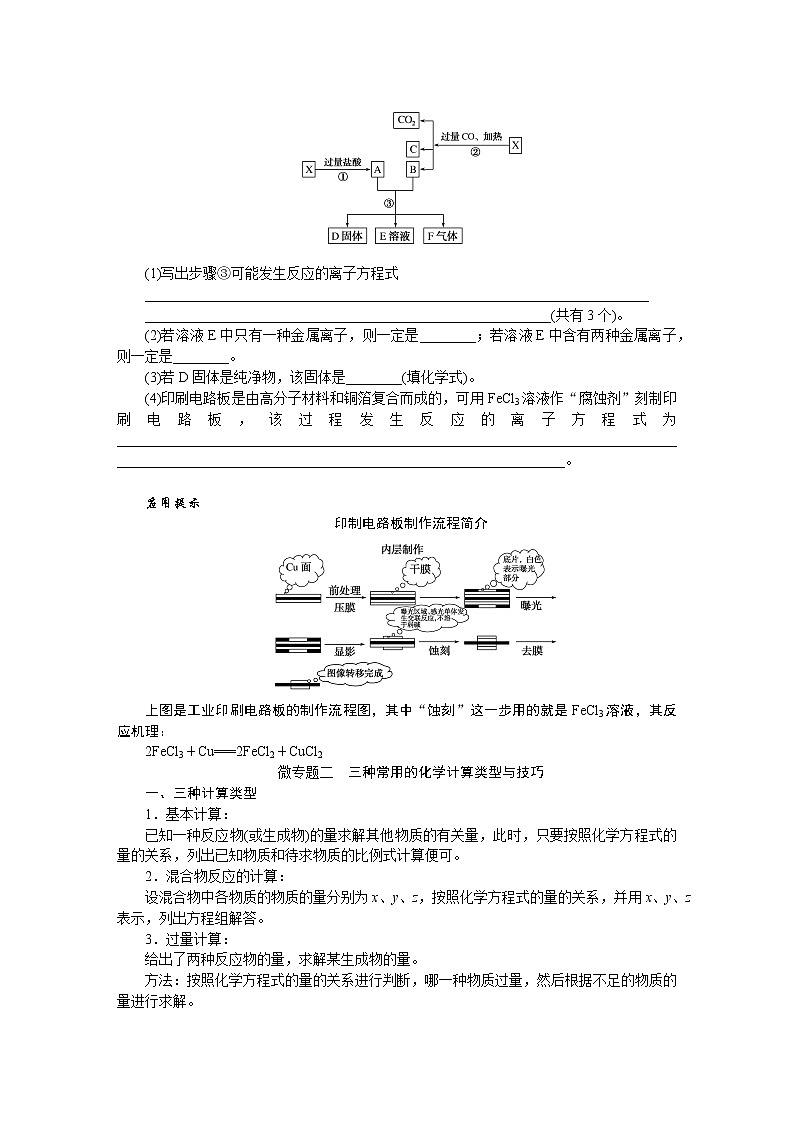


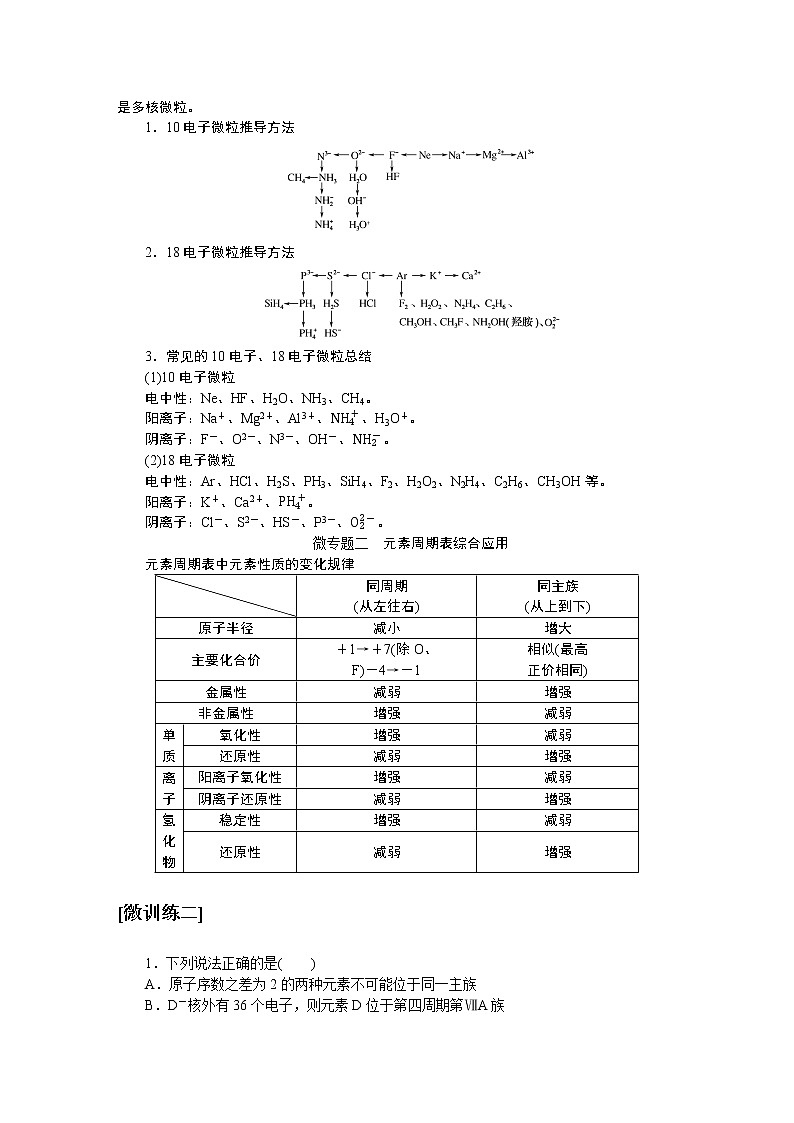


人教版高中化学必修第一册微专题大素养章末导学案+课件
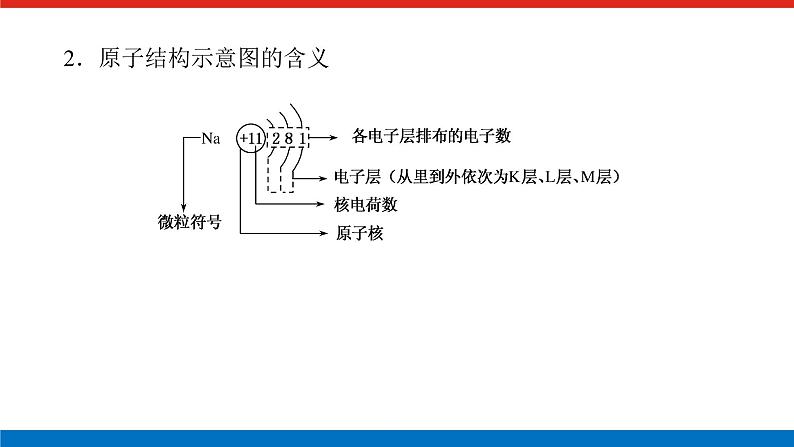
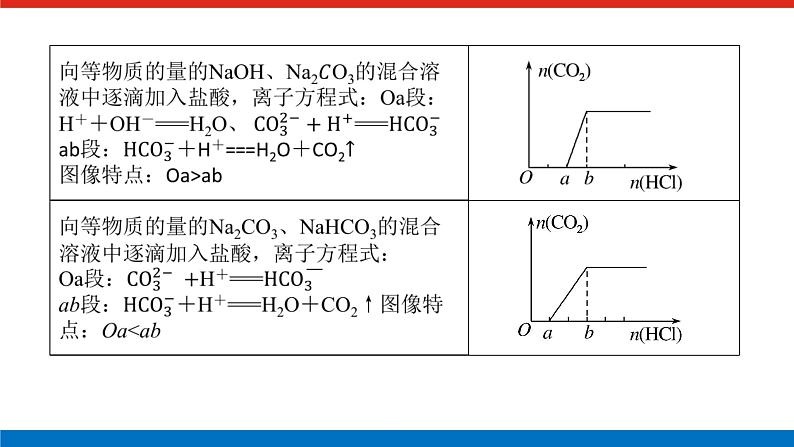
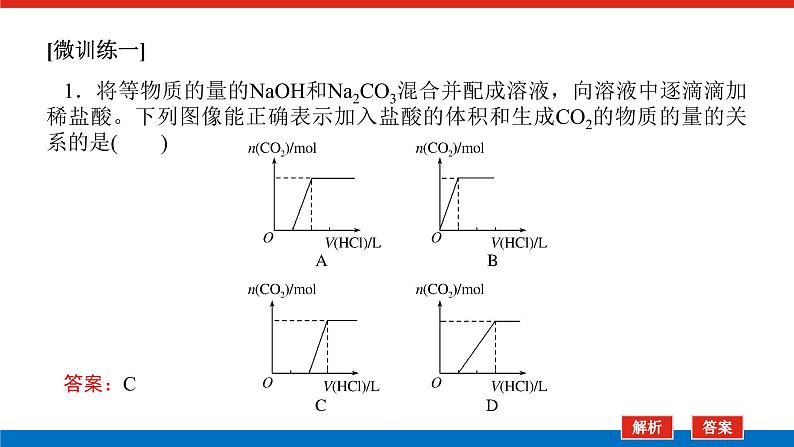
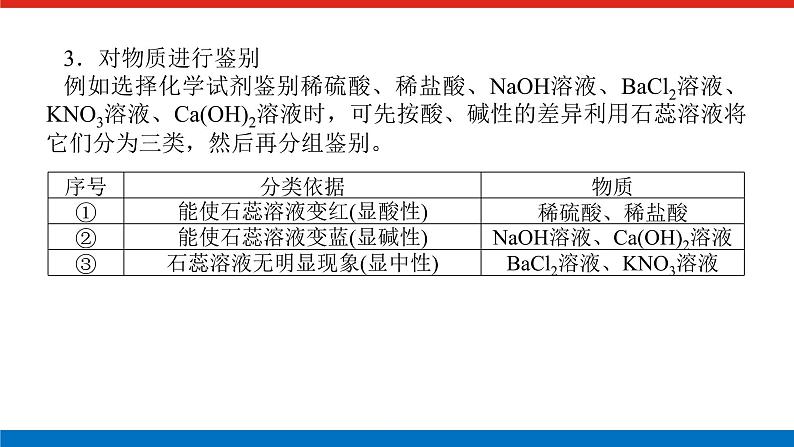
展开微专题•大素养④ 章末共享微专题一 原子结构与对应判断1.构成原子的粒子2.原子结构示意图的含义3.1~20号元素原子核外电子排布的特点(1)最外层电子数和次外层电子数相等的原子有Be、Ar。(2)最外层电子数是次外层电子数2倍的原子是C。(3)最外层电子数是次外层电子数3倍的原子是O。(4)最外层电子数是次外层电子数4倍的原子是Ne。(5)次外层电子数是最外层电子数2倍的原子是Li、Si。(6)内层电子总数是最外层电子数2倍的原子是Li、P。(7)电子层数和最外层电子数相等的原子是H、Be、Al。(8)电子层数是最外层电子数2倍的原子是Li、Ca。(9)最外层电子数是电子层数2倍的原子是He、C、S。(10)最外层电子数是电子层数3倍的原子是O。[微训练一]1.下列叙述正确的是( )A.13C和14C属于同一种元素,它们互为同位素B.2H和3H是不同的核素,它们的质子数不相等C.14C和14N的质量数相等,它们的中子数相等D.6Li和7Li的电子数相等,中子数相等答案:A解析:A项符合同位素的概念;B项,2H和3H的质子数都是1;C项,14C和14N的质量数相等,它们的中子数不相等,分别为8和7;D项,6Li和7Li的电子数相等,中子数不相等,中子数分别为3和4。 答案:B 3.A、B两种原子,A的M电子层比B的M电子层少3个电子,B的L电子层电子数恰为A的L电子层电子数的2倍。A和B分别是( )A.硅原子和钠原子 B.硼原子和氦原子C.氯原子和碳原子 D.碳原子和铝原子答案:D解析:设x、y分别为A的L层和M层的电子数。依题意有由于B的M层上有电子,故其L层肯定充满电子,2x=8,x=4。由于A的L层未充满电子,故其M层无电子,y=0。所以A、B的核外电子数分别为6、13,是碳原子和铝原子。 A-ZA-x-nA-x+n22 5.某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断。(1)该微粒是中性微粒,这种微粒的符号是____。(2)该微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒的符号是_______。(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种微粒的符号是____。(4)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种微粒的符号是____。ArS2-K+Cl-解析:核外电子排布为2、8、8构型的单核微粒主要有:Ar、S2-、Cl-、K+、Ca2+。(1)单核中性微粒为原子,原子的核电荷数=核外电子数,因此,此微粒是核电荷数为18的氩原子。(2)具有还原性能被溴水氧化的是硫离子。(3)氧化性很弱的+1价的是钾离子。(4)还原性很弱的-1价的是氯离子。6.已知A、B、C、三种元素的原子中,质子数为 A<B<C,且都小于18,A元素的原子最外层电子数是次外层电子数的2倍;B元素的原子核外M层电子数是L层电子数的一半;C元素的原子次外层电子数比最外层电子数多1个。试推断:(1)三种元素的名称和符号:A________,B________,C________。(2)画出三种元素的原子结构示意图。A____________,B____________,C____________。碳C硅Si氯Cl 解析:由A元素的原子最外层电子数是次外层电子数的2倍,可知A是碳元素;B元素的原子核外M层电子数是L层电子数的一半,可知B为硅元素;C元素的原子次外层电子数比最外层电子数多1个,可知C应为氯元素。7.a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都具有10个电子,其结构特点如下:其中b的离子半径大于e的离子半径;d是由四原子构成的分子;c和f在一定条件下可形成两个共价型g分子。试写出:(1)用化学符号表示下列四种微粒:①c______;②d______;③f________;④g________。(2)画出a微粒的结构示意图________。(3)b与e相应元素的最高价氧化物对应水化物的碱性强弱为________>________(用化学式表示)。(4)g与一种含有非极性键双核18电子分子反应的化学方程式为__________________,上述反应中,断裂的化学键类型是_______________,形成的化学键类型是__________________。OH-NH3H3O+H2ONaOHMg(OH)22H2O+2F2===4HF+O2极性键和非极性键极性键和非极性键解析:根据题给信息,确定七种10电子粒子分别是Ne、Na+、OH-、NH3、Mg2+、H3O+、H2O。方法总结电子总数相同的微粒的组成规律核外电子总数相等的微粒可以是分子、原子,也可以是离子;可以是单核微粒,也可以是多核微粒。1.10电子微粒推导方法2.18电子微粒推导方法 微专题二 元素周期表综合应用元素周期表中元素性质的变化规律[微训练二]1.下列说法正确的是( )A.原子序数之差为2的两种元素不可能位于同一主族B.D-核外有36个电子,则元素D位于第四周期第ⅦA族C.位于同一主族相邻的甲、乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4D.位于同一周期的甲、乙两种元素,甲位于第ⅠA族,原子序数为x,乙位于第ⅢA族,则乙原子序数可能为x+19答案:B解析:氢和锂两种元素的原子序数之差为2,却同位于第ⅠA族,A错误;D-核外有36个电子,即与第四周期的0族元素Kr处于同一周期,且D比Kr少一个电子,即在第ⅦA族,B正确;甲、乙同主族,根据元素周期表结构可知,乙的原子序数可能为x+2或x+8或x+18或x+32等,C错误;同一周期的第ⅠA族和第ⅢA族的元素的原子序数之差分为三种情况:①第二、三周期为2;②第四、五周期为2+10;③第六、七周期为2+24,D错误。2.元素A、B、C、D在元素周期表中的位置如下图所示。下列叙述不正确的是( ) A.C的原子序数比B的原子序数大1B.原子结构示意图为 的元素,与C位于同一周期C.B的原子与D的原子最外层电子数相等D.原子结构示意图为 的元素,与B位于同一主族答案:D解析:根据元素周期表的结构分析题图可知,它的更具体的内容如下所示: B是第一周期的最后一种元素,C是第二周期的第一种元素,则C的原子序数比B的原子序数大1,A项正确;原子结构示意图为的元素的原子序数是8,第二周期元素从左到右原子序数为3~10,则原子序数为8的元素与C位于同一周期,B项正确;B是2号元素,原子核外有1个电子层、2个电子,D是12号元素,原子结构示意图为C项正确;原子结构示意图为的元素是10号元素,也是第二周期的最后一种元素,与B同族,但该族是0族而不是主族,D项不正确。3.已知下列原子的半径:根据以上数据,P原子的半径可能是( )A.1.10×10-10 m B.0.80×10-10 mC.1.20×10-10 m D.0.70×10-10 m答案:A解析:根据元素周期律可知,磷原子的半径应在Si和S原子之间,故答案为选项A。4.短周期的两种元素A和B,它们的离子A-和B2+具有相同的电子层结构,下列说法中正确的是( )A.原子序数A>B B.电子总数A->B2+C.离子半径A->B2+ D.原子半径A>B答案:C5.已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是( )A.气态氢化物的稳定性:HX>H2Y>ZH3B.非金属活泼性:Y
高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为本章综合与测试教课内容课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为本章综合与测试教课内容课件ppt,共41页。PPT课件主要包含了Zn2+,答案BD,ABD,缓慢滴加硫酸,mL容量瓶,答案B,答案BC等内容,欢迎下载使用。
鲁科版 (2019)选择性必修1第2章 化学反应的方向、 限度与速率本章综合与测试评课ppt课件: 这是一份鲁科版 (2019)选择性必修1第2章 化学反应的方向、 限度与速率本章综合与测试评课ppt课件,共28页。PPT课件主要包含了双基夯实·课前排查,核心突破·要点讲解,夯实基础·一遍落实,答案A,答案AD等内容,欢迎下载使用。
化学选择性必修1第1章 化学反应与能量转化本章综合与测试课前预习ppt课件: 这是一份化学选择性必修1第1章 化学反应与能量转化本章综合与测试课前预习ppt课件,共25页。PPT课件主要包含了答案B,答案BC,答案D,原电池,CH3OH,答案A,答案C等内容,欢迎下载使用。













