






初中化学鲁教版九年级上册第三节 氧气授课免费课件ppt
展开无影无形摸不着,火焰见它跳的高。 呼吸作用它参加,动物植物离不了。
你所知道的制取氧气的方法有哪些?
它们适合在实验室制取氧气吗?
工业上 空气---(降温加压) ---液态空气– 蒸馏 ---- 出去的是 氮气(沸点低) 留下来的是 氧气 (沸点高)
实验室制取氧气—药品的选择
若在实验室中有下列药品可供选择:H2O2、NaCl、KMnO4、KClO3、HgO
猜想:哪些物质可能用于制取氧气? 为什么?
讨论 1、实验室用高锰酸钾制取氧气的反应在 什么装置中发生呢? 2、为什么试管口要稍向下一点? 3、产生的氧气应怎样收集呢?
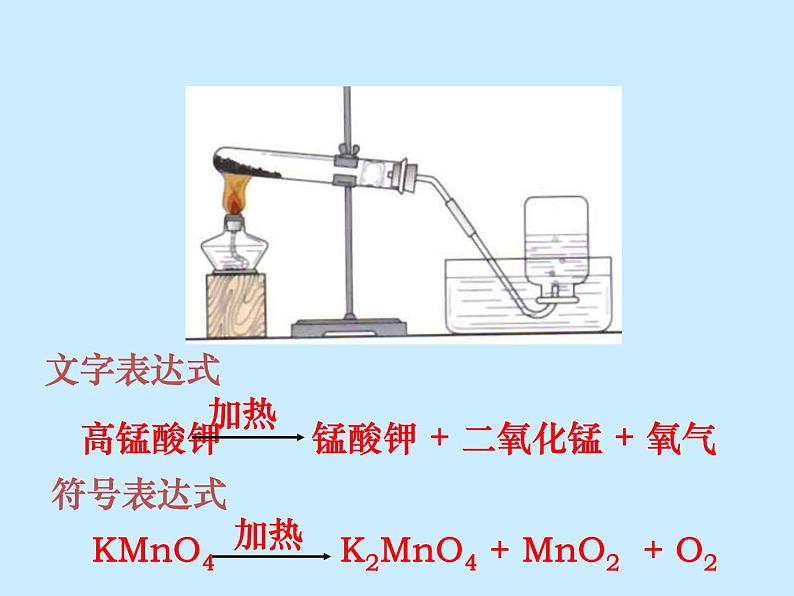
探究:用高锰酸钾制氧气
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
KMnO4 K2MnO4 + MnO2 + O2
(1)连接装置,检查装置气密性。
连接装置(从左到右,自下而上)
检查气密性的方法:先将导管一端伸入水中,然后用手紧握试管,观察导管口有没有气泡冒出或冷却后导管内能否形成一段水柱。
将高锰酸钾装入试管
点燃酒精灯,均匀加热后,固定在药品底部加热
收集完后,将导管撤离水槽
将盛有药品的装置固定在铁架台上
(1)实验室用高锰酸钾制取并用排水法收集氧气有如下操作步骤: (按要求装配仪器)
1、药品平铺在试管底部
3、导管伸入试管不能太长
2、铁夹夹在离试管口1/3处
原因:不利于气体的排出
实验室里加热高锰酸钾制取氧气注意事项
原因:防止冷凝水倒流至试管底部,炸裂试管
5、用酒精灯的外焰先均匀预热,再集中在有药品的部位集中加热
6、等有连续的气泡产生时再收集
原因:刚加热时产生的气泡中混有空气,这时的气体不纯
7、实验完毕,先撤导管,后移酒精灯
原因:防止试管冷却后,水槽内的水沿导管进入试管,使试管炸裂
8、收集满的氧气,应正放在桌面上,并用毛玻璃片盖上
原因:氧气密度比空气略大
依据:反应物都是固体,反应需要加热
依据:反应物是固体和液体的混合物,反应不需要加热
2.竖直式:固液常温型
1.横斜式:固固加热型
不易溶于水且不与水反应的气体
密度比空气大且不与空气中气体反应
密度比空气小且不与空气中气体反应
要考虑气体的溶解性及是否与水反应;气体密度及与空气成分是否反应
使用长颈漏斗时,长颈漏斗的末端必须插入液体中,防止生成的气体从长颈漏斗口逸出,所以必须液封。
过氧化氢溶液和二氧化锰制取氧气的装置
KCl O2
锰酸钾+二氧化锰+氧气
K2MnO4 MnO2 O2
H2O2 H2O + O2
上述反应都能生成氧气,根据提供的信息想一想,若在实验室里制取氧气,你最好选择 。为什么?
实验室制取氧气—反应原理
步骤一:在常温下,把带火星的木条伸入过氧化氢溶液的试管,观察木条是否复燃?现 象:木条不能复燃,结 论:说明常温下放出氧气少(速率慢)。
探究:过氧化氢(H2O2)溶液制取氧气
步骤二:向上述试管中,加入少量二氧化锰,把带火星的木条伸入试管。观察发生的现象。现 象:木条复燃了结 论:说明在常温下过氧化氢溶液遇到二氧化锰(MnO2)时迅速产生氧气(速率快)。
步骤三:反应停止后,重新加入过氧化氢溶液,把带火星的木条伸入试管。观察发生的现象。现 象:木条复燃了结 论:说明二氧化锰(MnO2)仍然能加快产生氧气反应速率。
催化剂:在化学反应里能改变其他物质的化学反应速率,而本身质量和化学性质在化学反应前后都没有发生变化的物质。催化剂的特点
能够改变其他物质的化学反应速率,本身的质量和化学性质在反应前后不变的物质叫做 。
1.催化剂参与化学反应了吗?
2.催化剂能否增加(或减少)生成物的质量?
3.催化剂是否只能加快化学反应的速率?
谈谈你对催化剂的理解。
4.一个化学反应的催化剂只有一种吗?
一 变:化学反应速率变二不变:质量不变、化学性质不变
过氧化氢 水 + 氧气
H2O2 H2O + O2
硫酸铜溶液对过氧化氢的分解具有催化作用。
【说明】此反应中,二氧化锰既不是反应物也不是生成物,只是一种催化剂,应算作一个反应条件,所以二氧化锰写在箭头的上方
过氧化氢制氧气和高锰酸钾制氧气的发生装置能否相同?
氧气的检验:
用带火星的木条插入集气瓶中,木条复燃,证明是氧气。
方一:关闭分液漏斗活塞,将导管末端放入水中,双手握住锥形瓶,如导管末端有气泡冒出说明装置气密性良好,
方二:用弹簧夹夹紧橡皮管,向分液漏斗中加水,如在分液漏斗末端留有一段水柱,说明装置气密性良好.
如何检验收集到的是氧气?
将一支带火星的木条伸进集气瓶内,若木条复燃,证明是氧气。
将一支带火星的木条伸到集气瓶口,若木条复燃,证明已集满。
用向上排空气法收集氧气,如何验满?
1.总结实验室制取气体的一般步骤。
1.长颈漏斗的下端为什么要伸入到液面以下?
4.收集好的氧气是瓶口向上还是瓶口向下放置?为什么?
3.若用向上排空气法收集氧气,怎样检验是否收集满了?
2.刚开始有气体放出时能否立刻收集氧气?为什么?
1. 在实验室里,用分解过氧化氢的方法制取氧气,加入二氧化锰的目的是( )使产生氧气的量增多 提高氧气的纯度C. 使其在常温下迅速分解放出氧气 D. 使生成的氧气更干燥
2.一定质量的过氧化氢溶液和二氧化锰的混合物制取氧气,能正确表示反应过程中二氧化锰的质量m 随反应时间t而变的图象是( )。
4.通常情况下,氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,形成的溶液是氨水。实验室用加热氯化铵和熟石灰的固体混合物制取氨气。
请从上图中选出制取氨气的发生装置 ,收集氨气应采用的装置是 。
实验室制取氧气 第二课时 加热高锰酸钾制取氧气
实验室制取氧气的反应原理
H2O2 H2O O2
KClO3 KCl O2
KMnO4 K2MnO4 MnO2 O2
随堂检测1.工业上制取大量氧气的方法是 ( )(A)加热氯酸钾 (B)加热高锰酸钾(C)分离液态空气 (D)加热二氧化锰2.催化剂在化学反应中所起的作用是( )(A)加快化学反应速率 (B)使生成物质量增加(C)改变化学反应速率 (D)减慢化学反应速率
3.实验室制取氧气时,装药品的大试管口应 ( )(A)朝下 (B)朝上 (C)略向下倾斜 (D)略向上倾斜4.实验室采用排水法收集氧气时,需将导气管伸入盛满水的集气瓶,这个操作应在( )(A)加热固体药品前 (B)与加热固体药品同时(C)开始有气泡放出时 (D)气泡连续并均匀放出时
5.某同学设计了4种制氧气的方案:①用氯酸钾和二氧化锰共热;②使高锰酸钾受热; ③用高锰酸钾和氯酸钾共热;④使二氧化锰受热.判断这四种方法( ) A.全正确 B. 全不正确 C. ①②③正确 D.只有①②正确
6.实验室用氯酸钾和二氧化锰混合加热制氧气,反应前后二氧化锰在固体混合物中质量分数是( ) A、由大到小 B、由小到大 C、不变 D、无法判断
7.在高锰酸钾分解制氧气的反应中,二氧化锰是________物。在氯酸钾与二氧化锰混合加热制氧气时,氯酸钾是________物,二氧化锰是_____,若不 加二氧化锰,则氯酸钾分解反应将_____,若将高锰酸钾加入氯酸钾,则反应______,这是因为________________________。8、三份质量相等的氯酸钾固体。第一份中加入少量二氧化锰,第二份中加入少量高锰酸钾,第三份不加任何物质。给它们分别加热完全分解,放出氧气的 量( ) A、第一份最多 B、第二份最多 C、第三份最多 D、一样多
9、下图是实验室用高锰酸钾制取和收集氧气的装置图,指出其中的五处错误
2021学年第三节 氧气示范课ppt课件: 这是一份2021学年第三节 氧气示范课ppt课件,共45页。PPT课件主要包含了选择反应物,如何控制反应条件,确定发生装置,确定收集装置,是否环保安全,速度可控,工业制氧气,通电分解水,分离液态空气法,光合作用等内容,欢迎下载使用。
2020-2021学年第三节 氧气授课课件ppt: 这是一份2020-2021学年第三节 氧气授课课件ppt,共27页。PPT课件主要包含了氧气的实验室制法,分解过氧化氢制取氧气,装置图,发生装置,收集装置,氯酸钾,氯化钾+氧气,高锰酸钾,发生装置选择的依据,加热高锰酸钾制取氧气等内容,欢迎下载使用。
2021学年第三节 氧气课堂教学课件ppt: 这是一份2021学年第三节 氧气课堂教学课件ppt,共40页。PPT课件主要包含了选择反应物,如何控制反应条件,确定发生装置,确定收集装置,是否环保安全,这些物质中含有氧元素,资料介绍,你的猜想,反应速率慢,提高过氧化氢的浓度等内容,欢迎下载使用。













