

高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH教学ppt课件
展开
这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH教学ppt课件,共16页。PPT课件主要包含了溶液中存在哪些微粒,问题情境,水的电离,v电离,等动定变,温度越高Kw越大,①中性溶液时,②酸性溶液时,③碱性溶液时,《金版》P76等内容,欢迎下载使用。
在醋酸溶液中存在醋酸的电离平衡:
如何证明水是弱电解质?
【任务一】宏观辨识 认识水的电离平衡
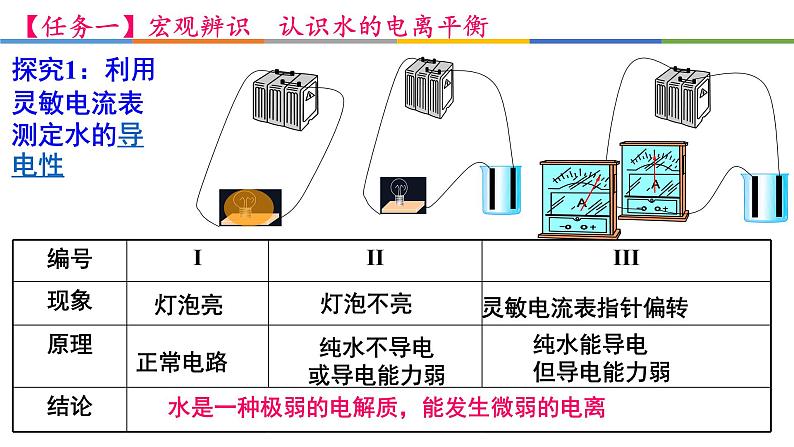
水是一种极弱的电解质,能发生微弱的电离
纯水不导电或导电能力弱
纯水能导电但导电能力弱
探究1:利用灵敏电流表测定水的导电性
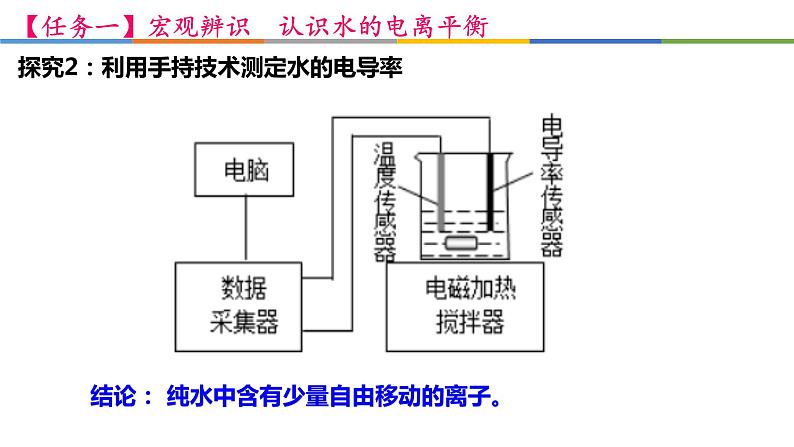
探究2:利用手持技术测定水的电导率
结论: 纯水中含有少量自由移动的离子。
【任务二】微观探析 了解水的电离平衡
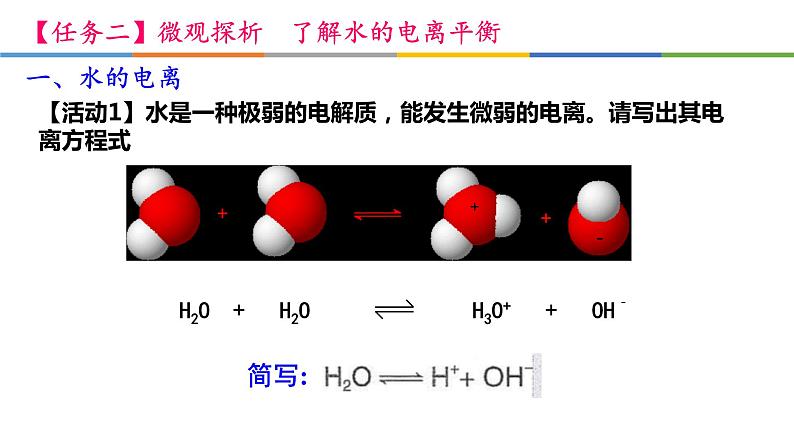
【活动1】水是一种极弱的电解质,能发生微弱的电离。请写出其电离方程式
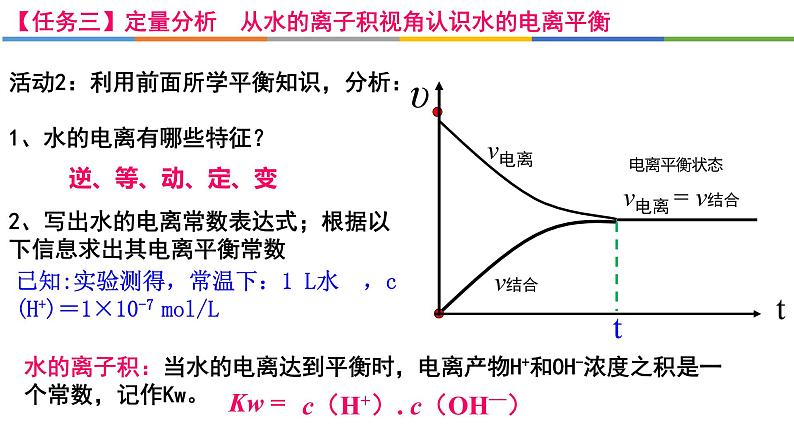
活动2:利用前面所学平衡知识,分析:1、水的电离有哪些特征? 2、写出水的电离常数表达式;根据以下信息求出其电离平衡常数
已知:实验测得,常温下:1 L水 ,c(H+)=1×10-7 ml/L
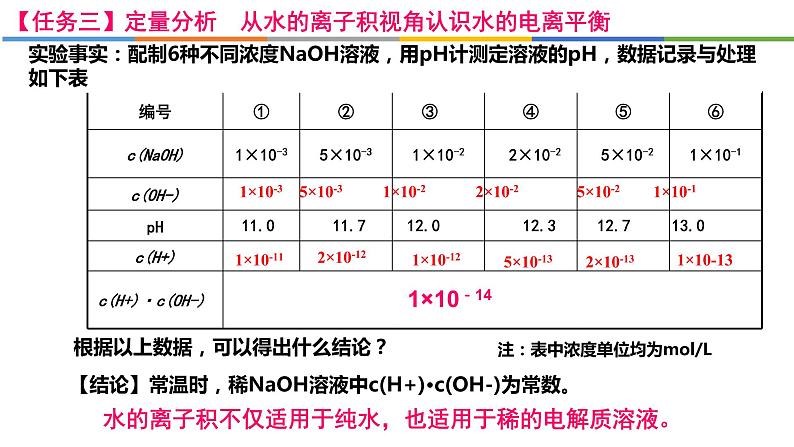
【任务三】定量分析 从水的离子积视角认识水的电离平衡
水的离子积:当水的电离达到平衡时,电离产物H+和OH-浓度之积是一个常数,记作Kw。
1×10-3 5×10-3 1×10-2 2×10-2 5×10-2 1×10-1
1×10-11 1×10-12 1×10-13
注:表中浓度单位均为ml/L
c(H+)·c(OH-)
1×10-14
【结论】常温时,稀NaOH溶液中c(H+)·c(OH-)为常数。
11.0 11.7 12.0 12.3 12.7 13.0
实验事实:配制6种不同浓度NaOH溶液,用pH计测定溶液的pH,数据记录与处理如下表
根据以上数据,可以得出什么结论?
水的离子积不仅适用于纯水,也适用于稀的电解质溶液。
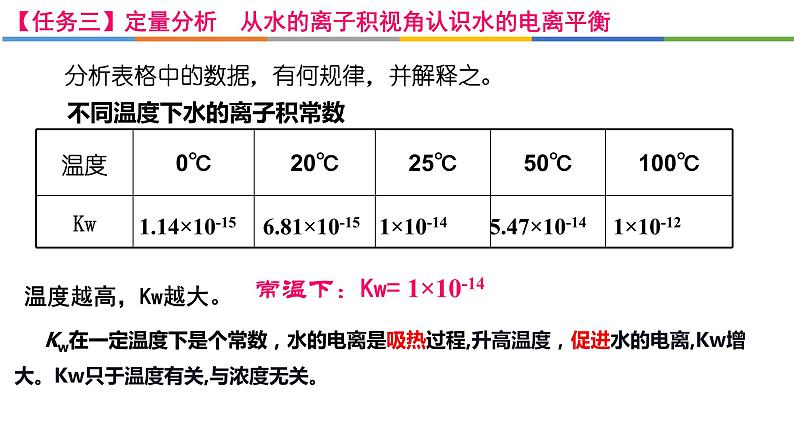
分析表格中的数据,有何规律,并解释之。
1.14×10-15 6.81×10-15 1×10-14 5.47×10-14 1×10-12
Kw在一定温度下是个常数,水的电离是吸热过程,升高温度,促进水的电离,Kw增大。Kw只于温度有关,与浓度无关。
不同温度下水的离子积常数
常温下:Kw= 1×10-14
【思考讨论】为什么升温,水的离子积会增大?还有哪些因素可以影响水的电离平衡?完成下列表格。
【任务四】定性分析影响水的电离平衡的因素
【小结】1.水的电离是吸热反应,Kw只跟温度有关,与溶液的酸碱性无关。水的离子积不仅适用于纯水,也适用于稀的电解质溶液。2.加入酸或碱可以抑制水的电离。3.升温或加入可以与H+(或OH-)反应的盐,可以促进水的电离4.无论是酸溶液、碱溶液还是盐溶液中,均含有H+和OH-,只是两者的浓度大小不同。常温下,溶液中c(H+)和c(OH- )有如下关系:
c(H+) =c(OH-)
c(H+)> c(OH-)
c(H+)< c(OH-)
【任务五】数据表征 认识溶液酸碱性与pH关系
常温下,当溶液的PH=7时,溶液呈中性。此时溶液中 c(H+)为多少?
常温下,c(H+)=c(OH-)=1.0×10-7ml/L ; pH=7,溶液呈中性。
120℃,纯水电离出的 c(H+)=10-6ml/L,溶液的PH为_______
【辨析】PH小于7的溶液一定呈酸性?
pH与溶液中c(H+)的关系为?
错误,溶液的酸碱性由c(H+)和c(OH-)的相对大小决定。
溶液的酸碱性由c(H+)和c(OH-)的相对大小决定。
溶液酸碱性的判断方法(1)在25 ℃的溶液中:pH7,溶液呈碱性,pH越大,c(OH-)越大,溶液的碱性越强。(2)在任意温度下的溶液中:c(H+)>c(OH-),溶液呈酸性;c(H+)=c(OH-),溶液呈中性;c(H+)
相关课件
这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优秀ppt课件,共23页。PPT课件主要包含了学习目标,第1课时水的电离,认识水的电离,了解水的离子积常数等内容,欢迎下载使用。
这是一份3.2.1 水的电离 溶液的酸碱性与pH(课件)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1),共31页。
这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH教学课件ppt,文件包含人教版化学选修一321《水的电离》课件pptx、人教版化学选修一321《水的电离》教学设计docx等2份课件配套教学资源,其中PPT共19页, 欢迎下载使用。










