




2023届高三化学一轮复习 第六章化学反应与热能第一节焓变与热化学方程式
展开这是一份2023届高三化学一轮复习 第六章化学反应与热能第一节焓变与热化学方程式,共33页。PPT课件主要包含了COOH+,能量变化的原因,石墨比金刚石稳定,kJ·mol-1,吸热反应,△H>0,放热反应,△H<0,活化能与焓变的关系,热化学方程式等内容,欢迎下载使用。
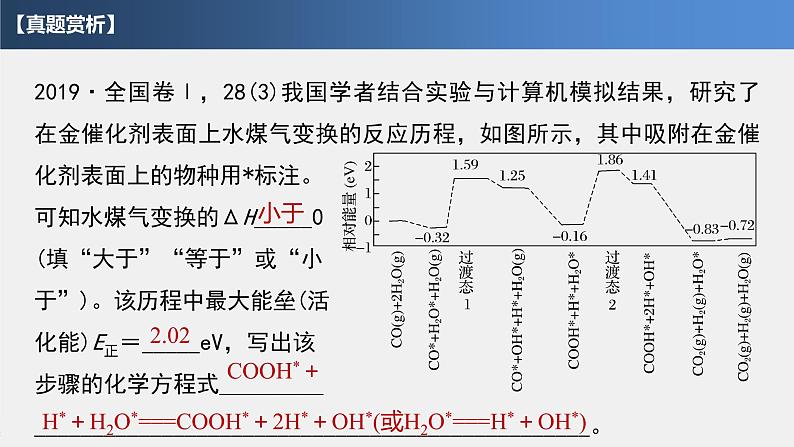
2019·全国卷Ⅰ,28(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。可知水煤气变换的ΔH_____0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=_____eV,写出该步骤的化学方程式_________________________________________________________。
H*+H2O*===COOH*+2H*+OH*(或H2O*===H*+OH*)
学习目标: 1. 通过课前自主学习及知识导图,发现自己知识结构中薄弱环节,并重点学习。 2.通过组内合作,学会用图像解释能量变化的原因,形成图形图像的工具意识。 3.通过与同学和老师讨论,记住常见的吸放热反应。 4.通过和老师一起演绎归纳以及与同学合作等活动,了解能量变化的表征方法,重点掌握图像表征。
【学习任务一】认识反应热和焓变
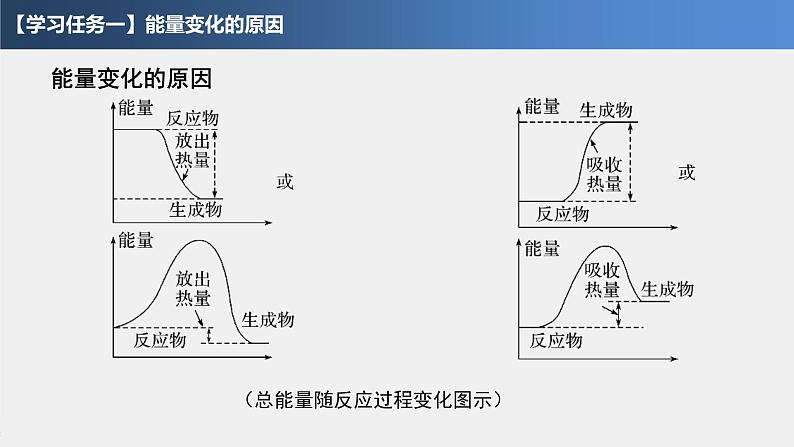
【学习任务一】能量变化的原因
(总能量随反应过程变化图示)
【思考与交流】已知:石墨(S) 金刚石(S); △H>0 判断谁稳定?
一般来说物质具有的能量越低,键能越大,该物质越稳定。
反应热和焓变(1)反应热:化学反应过程中吸收或放出的热量。(2)焓变:恒压条件下的反应热,称之为焓变,符号为ΔH,单位为_________。
【学习任务二】认识反应热和焓变
(3)焓变与反应热关系
——恒压条件下,焓变(△H)等于反应热
注:中学阶段不考虑非恒压条件,故焓变(△H)等价与反应热
(4)焓变(△H)的理解
—— 体系能量的变化值
故,△H数值之前必须带“+”、“-”
【学习任务三】常见吸放热反应
2.下列变化过程中会放出热量的是( ) ①硝酸铵溶于水 ②物质的燃烧 ③苛性钠溶于水 ④生石灰放入水中 ⑤醋酸的电离 A.仅①⑤ B.仅②③ C.仅②④ D.②③④
1.下列反应既是氧化还原反应又是吸热反应的是 ( ) A、铝片与稀硫酸反应 B、灼热的碳与CO2反应 C、Ba(OH)2·H2O与NH4Cl反应 D、甲烷在氧气中燃烧
【思考】吸热反应一定需要加热,放热反应一定无需加热?
——反应条件与△H的“+”、“-”无关
【思考】NaOH溶于水属于放热反应,NH4NO3溶于水属于吸热反应?
——他们不是化学反应,只能属于“过程”
——△H的“+”、“-”只取决于初末能量差
【思考】放出的能量一定都以热的形式体现吗?
——当然不是,比如发光、发声、发电
【学习任务四】能量变化的表征
某反应的反应过程中能量变化如图所示①该反应的△H 0② 线表示有催化剂的反应
③在无催化剂的情况下,___为正反应的活化能,____为逆反应的活化能,ΔH=_______。④催化剂能降低反应的活化能,但不影响焓变的大小。
a.催化剂能降低反应的活化能,但不影响焓变的大小及平衡转化率。
b.在无催化剂的情况,E1为正反应的活化能,E2为逆反应的活化能,ΔH=E1-E2,活化能大小影响反应速率。
1.(2020·天津,10)理论研究表明,在101 kPa和298 K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是A.HCN比HNC稳定B.该异构化反应的ΔH=+59.3 kJ·ml-1C.正反应的活化能大于逆反应的活化能D.使用催化剂,可以改变反应的反应热
例1.(2018·北京,7)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。下列说法不正确的是( )A.生成CH3COOH总反应的 原子利用率为100%B.CH4→CH3COOH过程中, 有C—H键发生断裂C.①→②放出能量并形成了C—C键D.该催化剂可有效提高反应物的平衡转化率
例2.[2019·全国卷Ⅰ,28(3)]我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。可知水煤气变换的ΔH_____0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=_____eV,写出该步骤的化学方程式_________________________________________________________。
2.(2020·四川攀枝花统考)我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率,反应过程示意图如下:下列说法正确的是( )A.图中显示:起始 时的2个H2O都参与了反应过程B.过程Ⅰ、过程Ⅱ均为放热过程C.过程Ⅲ只生成了极性共价键D.使用催化剂降低了水煤气变换反应的ΔH
如“2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/ml”
【学习任务五】能量变化的表征
表示参加反应的物质的物质的量和反应热的关系的化学方程式。
1、已知H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/ml, 则①2H2(g)+O2(g)=2H2O(l)的 ΔH=_________________, ②H2O(l)=H2(g)+1/2O2(g)的 ΔH=__________________。
-571.6 kJ/ml
+285.8 kJ/ml
【特别注意】“可逆反应”的△H
——表示完全反应对应的反应热
思考:写出下列反应的热化学方程式
(2)已知 A2(g)和B2(g)反应生成AB(g)的能量变 化如图所示,请写出该反应的热化学方程式。
(1)2.00g C2H2完全燃烧生成液态水和CO2放出的热量为99.6KJ,写出C2H2燃烧的热化学方程式。
(1)写出配平的化学方程式;标明各物质的聚集状态
(2)注明反应的温度和压强 (在101 kPa和25℃时的数据,可不特别注明)
(4)写出△H的值并标明“+”与“—”; 无论化学计量数怎么变,△H的单位都规定为KJ/ml。
(3)检查化学计量数和△H值是否对应。 化学计量数只表示分子的物质的量,它可以是整数,也可以是分数。 反应热(△H)的值与化学计量数成正比。
总结:书写热化学方程式的方法及注意事项
1、已知:H2(g)+F2(g)=2HF(g)ΔH=-270kJ/ml,下列说法正确的是( )A.氟化氢气体分解生成氢气和氟气的反应是放热反应B.1 ml H2与1 ml F2反应生成2 ml液态HF放出的热量 小于270 kJC.在相同条件下,1 ml H2与1 ml F2的能量总和大于2 ml HF气体的能量D.该反应中的能量变化可用右图来表示
2、(2020·湖北重点中学联考)热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。(1)图甲表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:______________________________________________________。
NO2(g)+CO(g)===
NO(g)+CO2(g) ΔH=-234 kJ·ml-1
(2)图乙表示氧族元素中的氧、硫、硒、碲在生成1 ml气态氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准态下,发生分解反应的热化学方程式:_________________________________________。
Se(s)+H2(g) ΔH=-81 kJ·ml-1
3.根据如图所示的示意图,下列说法不正确的是( )A.反应的热化学方程式可表示为C(s)+H2O(g)===CO(g)+H2(g) ΔH= +(b-a) kJ·ml-1B.该反应过程中反应物断键吸收的 能量大于生成物成键放出的能量C.n ml C和n ml H2O反应生成n ml CO和n ml H2吸收的热量一定为131.3n kJD.1 ml C(g)、2 ml H(g)、1 ml O(g)转变成1 ml CO(g)和1 ml H2(g)放 出的热量为a kJ
【对点练】 4、(2018·海南,炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化二氧化硫。下列说法正确的是( )A.每活化一个氧分子吸收0.29 eV的能量B.水可使氧分子活化反应的活化能降低0.42 eVC.氧分子的活化是O—O键的断裂与C—O 键的生成过程D.炭黑颗粒不是大气中二氧化硫转化为 三氧化硫的催化剂
5.(2020·威海市高三模拟)我国科学家实现了在铜催化剂条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示,下列说法正确的是( )A.该历程中最小能垒的化学方程式为 (CH3)2NCH2OH*===(CH3)2NCH2+OH*B.该历程中最大能垒(活 化能)为2.16 eVC.该反应的热化学方程 式为(CH3)2NCHO(g) +2H2(g)===N(CH3)3(g)+H2O(g) ΔH=-1.02 eV·ml-1D.增大压强或升高温度均能加快反应速率,并增大DMF平衡转化率
相关课件
这是一份专题五 热化学 化学反应速率与平衡 主观题突破 1.热化学方程式的书写与焓变的计算 课件-2024年高考化学二轮复习,共41页。PPT课件主要包含了核心精讲,焓变的计算,盖斯定律,1ΔH与盖斯定律,真题演练,-45,+908,+118,考向预测,-350等内容,欢迎下载使用。
这是一份2023届高三化学二轮专题复习 原理综合大题突破1 热化学方程式的书写与焓变的计算课件,共17页。PPT课件主要包含了MnO2s+,-183,+663,-128等内容,欢迎下载使用。
这是一份(通用版)高考化学一轮复习课件第六章化学反应与能量第1节考点1焓变与反应热 (含解析),共25页。PPT课件主要包含了考纲解读,考点1焓变与反应热,栏目导航,夯实考点,知识梳理,思维深化,考点突破等内容,欢迎下载使用。












