









- 2022—2023学年新教材高中化学鲁科版选择性必修1第1章化学反应与能量转化第3节电能转化为化学能__电解第1课时电解的原理(课件+课后习题) 课件 4 次下载
- 2022—2023学年新教材高中化学鲁科版选择性必修1第1章化学反应与能量转化第3节电能转化为化学能__电解第2课时电解原理的应用(课件+课后习题) 课件 4 次下载
- 2022—2023学年新教材高中化学鲁科版选择性必修1第2章化学反应的方向限度与速率第1节化学反应的方向(课件+课后习题) 课件 3 次下载
- 2022—2023学年新教材高中化学鲁科版选择性必修1第2章化学反应的方向限度与速率第2节化学反应的限度第1课时化学平衡常数平衡转化率(课件+课后习题) 课件 4 次下载
- 2022—2023学年新教材高中化学鲁科版选择性必修1第2章化学反应的方向限度与速率第2节化学反应的限度第2课时反应条件对化学平衡的影响(课件+课后习题) 课件 3 次下载
高中化学鲁科版 (2019)选择性必修1第4节 金属的腐蚀与防护习题课件ppt
展开基础落实•必备知识全过关
重难探究•能力素养全提升
学以致用•随堂检测全达标
1.了解电化学腐蚀的本质,探究金属腐蚀的实质,从而形成宏观辨识与微观探析的学科核心素养。2.能利用电化学原理解释金属腐蚀的现象并能设计防腐保护措施,体验科学探究与创新意识的学科核心素养。
铁制品是如何锈蚀的?提示铁制品锈蚀的过程,实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程。
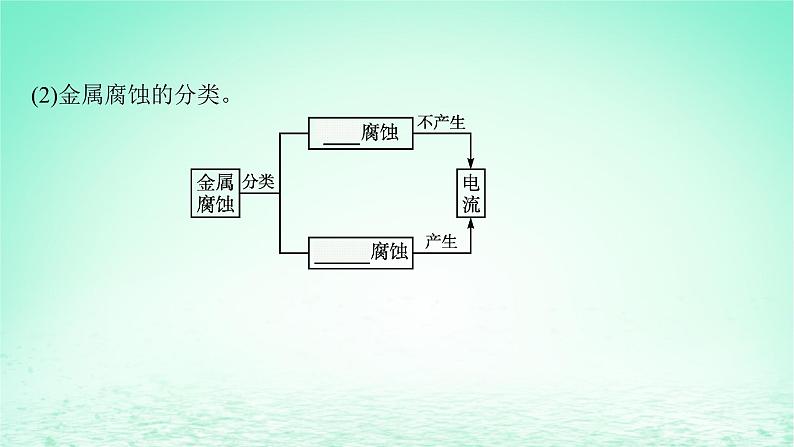
一、金属电化学腐蚀的原理1.金属腐蚀(1)金属腐蚀的定义及本质。①定义:金属表面因与周围的物质发生氧化还原反应而遭到破坏的现象。②本质:金属本身失去电子变成阳离子的过程(发生氧化反应):M-ne-==Mn+。
(2)金属腐蚀的分类。
2.金属腐蚀的电化学原理(1)实质。不纯的金属或合金与电解质溶液接触时发生原电池反应,较活泼的金属失去电子被氧化的过程。(2)分类。金属的电化学腐蚀分为析氢腐蚀和吸氧腐蚀。
二、金属腐蚀的防护1.原理阻止金属发生氧化反应。2.方法(1)改变金属内部结构,如制成合金等。(2)加防护层,如在金属表面喷油漆、涂油脂、电镀等。(3)电化学防护,分为牺牲阳极保护法和外加电流阴极保护法。
3.金属的防护措施图示
三、电化学腐蚀原理的应用1.铁腐蚀能消耗空气中的氧气,利用这一原理可快速测定空气中氧气的含量。2.铁腐蚀的反应消耗氧气和水,以铁粉为主要成分制成双吸剂放入食品包装袋,可以延长食物的保质期。3.铁腐蚀的过程放热,利用这一特点可以制成一次性保暖贴。4.根据金属电化学腐蚀的原理,利用微电解技术处理工业废水。5.金属电化学腐蚀原理在航空航天、精密仪器和生物医学等领域也具有广阔的应用前景。
判断下列说法是否正确,正确的打“√”,错误的打“×”。(1)钢铁发生析氢腐蚀或吸氧腐蚀时,负极反应均是Fe-3e-==Fe3+。( )(2)钢铁在潮湿的空气中发生电化学腐蚀时,正极发生的主要反应是O2+2H2O+4e-==4OH-。( )(3)发生吸氧腐蚀时正极放出O2,发生析氢腐蚀时正极放出H2。( )(4)纯铁在稀硫酸中发生析氢腐蚀。( )(5)现实生活中电化学腐蚀比化学腐蚀更普遍。( )(6)金属作为原电池的负极或电解池的阴极时均被保护。( )
据估计,每年全世界被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一。那么,金属的腐蚀都有哪些类型?不同类型的金属腐蚀有何区别?
提示金属的腐蚀可分为化学腐蚀和电化学腐蚀;化学腐蚀过程中没有电流产生,电化学腐蚀过程中有电流产生。
1.化学腐蚀与电化学腐蚀的比较
2.钢铁的吸氧腐蚀与析氢腐蚀的比较
钢铁发生电化学腐蚀时,负极Fe失去电子生成Fe2+,而非Fe3+
Fe(OH)2转变为Fe(OH)3的实验现象:白色沉淀迅速转变为灰绿色,最终变为红褐色
【微点拨】在通常情况下,潮湿的空气中水膜酸性较弱,金属在潮湿的空气中主要发生的是吸氧腐蚀。
【典例1】如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞的NaCl溶液,一段时间后观察发生的变化。下列叙述正确的是( )
A.a中铁钉附近溶液呈现红色B.b中铁钉上发生还原反应C.a中铜丝上发生氧化反应D.b中铝条附近有气泡产生
解析依据原电池原理分析可知:
a中铁钉附近不变红色,铜丝上发生还原反应;b中铁钉上发生还原反应,铝条附近没有气泡产生。
变式训练1如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间。下列有关描述错误的是( )A.生铁块中的碳是原电池的正极B.红墨水水柱两边的液面变为左低右高C.两试管中相同的电极反应是Fe-2e-==Fe2+D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
答案B解析a为中性环境,发生吸氧腐蚀,氧气被消耗,试管中气体压强减小;b中溶液呈酸性,发生析氢腐蚀,有氢气放出,试管中气体压强增大,所以红墨水水柱两边的液面变化为左高右低,故B项错。
根据金属腐蚀的原理分析金属腐蚀的防护措施都有哪些?提示常见金属腐蚀的防护措施有改变金属内部结构(不锈钢)、覆盖防护层(电镀、油漆等)、电化学防护、电化学使金属表面“钝化”等。
1.金属腐蚀的快慢规律(1)在同种电解质溶液中,金属腐蚀由快到慢的顺序为:电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极。(2)同一种金属在不同介质(浓度相等)中腐蚀由快到慢的顺序为:强电解质溶液>弱电解质溶液>非电解质溶液。(3)在同一种电解质溶液中,电解质溶液浓度越大,金属腐蚀越快(钝化除外)。(4)纯度越高的金属,腐蚀越慢。(5)不纯的金属或合金,在潮湿的空气中,氧气浓度越大,腐蚀越快。
2.金属的电化学防护
【典例2】为了保护舰艇(主要是钢合金材料),在舰体表面镶嵌金属块(R)。下列有关说法不正确的是( )A.这种保护舰体的方法叫做牺牲阳极保护法B.金属块R可能是镁或锌C.海水呈弱碱性,舰艇在海水中易发生析氢腐蚀D.正极的电极反应为O2+2H2O+4e-==4OH-
答案 C 解析 在舰体表面镶嵌金属块(R),这种保护方法利用原电池原理,需要金属块R比铁活泼,R为负极,钢铁为正极,这种方法叫作牺牲阳极保护法,A正确;金属块R比铁活泼,可能是镁或锌,B正确;钢铁材料在弱碱性海水中主要发生吸氧腐蚀,在酸性较强的溶液中才发生析氢腐蚀,C错误;吸氧腐蚀过程中,正极上发生还原反应,电极反应为O2+2H2O+4e-==4OH-,D正确。
【变式设问】(1)舰艇在海水和河水中航行,在哪种情况下腐蚀更快?(2)舰艇在海水中航行时,腐蚀最快的是与海水表面接触的位置,而不是一直浸泡在海水中的舰艇的底部,为什么?
提示 (1)在海水航行腐蚀更快。(2)舰艇在海水中发生吸氧腐蚀,海水表面O2浓度大,因此舰艇与海水表面接触的位置腐蚀最快,一直浸泡在海水中的舰艇的底部O2浓度小,腐蚀相对较慢。
变式训练2下面各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
A.④>②>①>③B.②>①>③>④C.④>②>③>①D.③>②>④>①
答案A解析铁在海水中的腐蚀属于电化学腐蚀,当铁与比它活泼性差的Sn相连时,Fe被腐蚀的速率比①大,与活泼性比其强的锌相连时,锌作为负极被腐蚀,铁被保护,其腐蚀的速率要比①小;④为电解装置,Fe为阳极,发生氧化反应,铁腐蚀的速率最快。
1.研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )A.若d为石墨,铁片腐蚀加快B.若d为石墨,石墨上电极反应:O2+2H2O+4e-==4OH-C.若d为锌块,铁片不易被腐蚀D.若d为锌块,铁片上电极反应:2H++2e-==H2↑
答案D解析铁、石墨及海水构成原电池时,Fe为负极,失去电子被氧化为Fe2+进入溶液,溶解在海水中的氧气在正极石墨上得到电子被还原,比没有形成原电池时腐蚀快,A正确。d为石墨,铁片在海水中发生的是吸氧腐蚀,石墨上氧气得到电子发生还原反应,电极反应为O2+2H2O+4e-==4OH-,B正确。若d为锌块,由于金属活动性Zn>Fe,Zn为原电池的负极,Fe为正极,首先被腐蚀的是Zn,铁得到保护,铁片不易被腐蚀,C正确。若d为锌块,铁片在海水中发生的是吸氧腐蚀,在铁片上的电极反应为O2+2H2O+4e-==4OH-,D错误。
2.为了防止钢铁锈蚀,下列防护方法中正确的是( )A.在精密机床的铁床上安装铜螺钉B.在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中C.在轮船的舷上用铁丝系住锌板浸在海水里D.在地下输油的铸铁管上接直流电源的正极答案C解析A、B中形成的原电池都是铁为负极,加速铁的腐蚀;D中铸铁管是阳极,会加速铁的腐蚀;C中锌比铁活泼,铁是正极,铁受到保护。
3.(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因 。 (2)铜制品在经常下酸雨的地区发生电化学腐蚀严重。写出此电化学腐蚀的电极反应:正极: ,负极: 。
答案(1)二者连接在一起时,接头处在潮湿的空气中形成原电池而造成铝被腐蚀(2)O2+2H2O+4e-==4OH- 2Cu-4e-==2Cu2+
解析(1)当铜导线和铝导线连接时,接触到潮湿的空气就易形成原电池而使铝被腐蚀。(2)要注意铜的电化学腐蚀与铁的区别,铜不能还原H+,故不可能发生析氢腐蚀,只能发生吸氧腐蚀;酸雨是一个干扰因素,只是使电解质溶液中的离子浓度增大,腐蚀加快。
4.如图所示,水槽中的试管内有一枚铁钉,放置数天后观察:(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 (填“化学”或“电化学”)腐蚀。 (2)若试管内液面上升,则原溶液呈 性,发生 腐蚀,负极电极反应为 ,正极电极反应为 。 (3)若试管内液面下降,则原溶液呈 性,发生 腐蚀。负极电极反应为 ,正极电极反应为 。
化学选择性必修1第4节 金属的腐蚀与防护教案配套课件ppt: 这是一份化学选择性必修1第4节 金属的腐蚀与防护教案配套课件ppt,共32页。PPT课件主要包含了目录索引,必备知识,自我检测,探究一金属的腐蚀等内容,欢迎下载使用。
化学第4节 金属的腐蚀与防护作业课件ppt: 这是一份化学第4节 金属的腐蚀与防护作业课件ppt,共29页。PPT课件主要包含了电化学腐蚀,球形干燥管,干燥O2,与O2和水接触,氧气的浓度等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第4节 金属的腐蚀与防护备课课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第4节 金属的腐蚀与防护备课课件ppt,共37页。PPT课件主要包含了内容索引,知识铺垫,必备知识,自我检测,问题探究,归纳拓展,应用体验,答案B等内容,欢迎下载使用。













