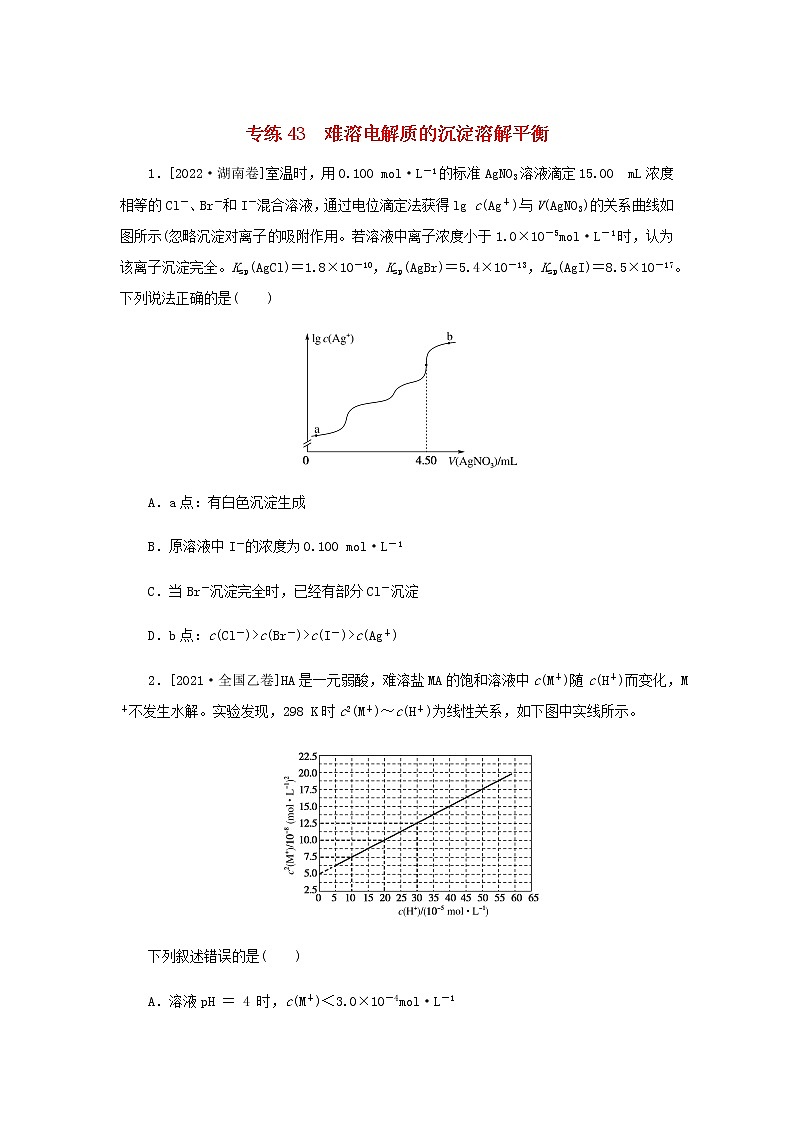
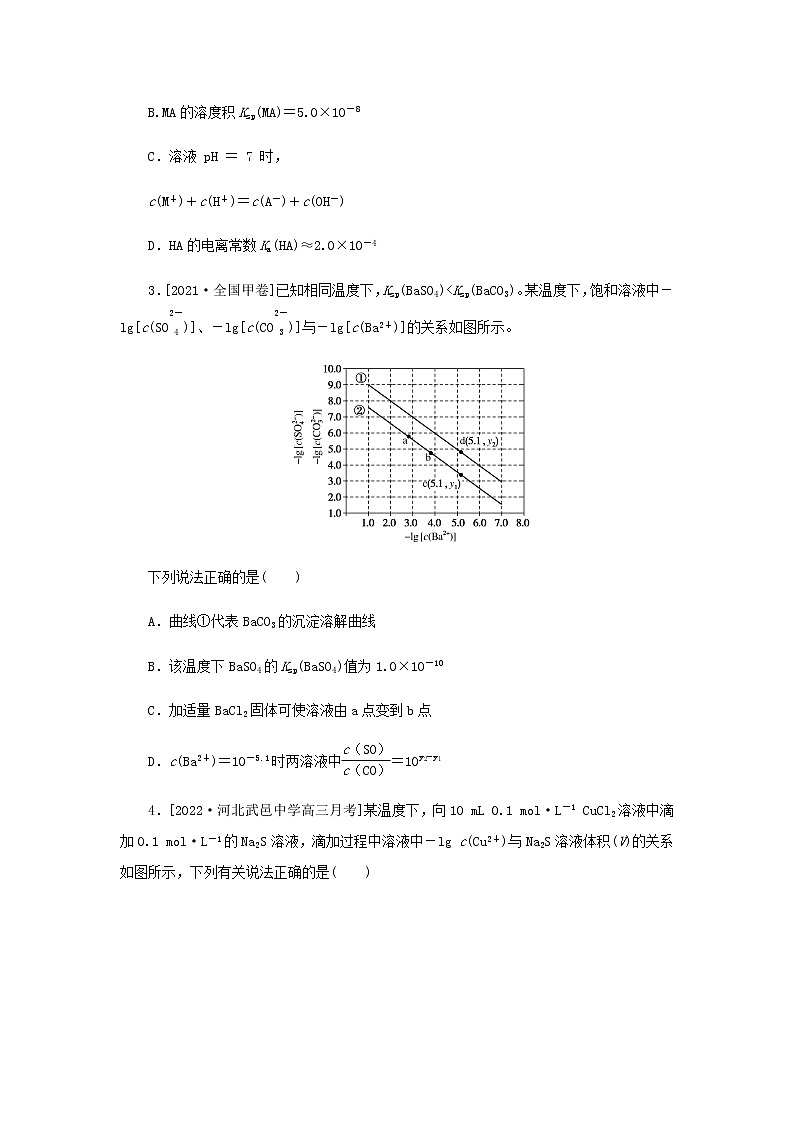

高考化学微专题小练习专练43难溶电解质的沉淀溶解平衡含答案
展开A.a点:有白色沉淀生成
B.原溶液中I-的浓度为0.100 ml·L-1
C.当Br-沉淀完全时,已经有部分Cl-沉淀
D.b点:c(Cl-)>c(Br-)>c(I-)>c(Ag+)
2.[2021·全国乙卷]HA是一元弱酸,难溶盐MA的饱和溶液中c(M+)随c(H+)而变化,M+不发生水解。实验发现,298 K时c2(M+)~c(H+)为线性关系,如下图中实线所示。
下列叙述错误的是( )
A.溶液pH = 4 时,c(M+)<3.0×10-4ml·L-1
B.MA的溶度积Ksp(MA)=5.0×10-8
C.溶液 pH = 7 时,
c(M+)+c(H+)=c(A-)+c(OH-)
D.HA的电离常数Ka(HA)≈2.0×10-4
3.[2021·全国甲卷]已知相同温度下,Ksp(BaSO4)
A.曲线①代表BaCO3的沉淀溶解曲线
B.该温度下BaSO4的Ksp(BaSO4)值为1.0×10-10
C.加适量BaCl2固体可使溶液由a点变到b点
D.c(Ba2+)=10-5.1时两溶液中 eq \f(c(SO eq \\al(\s\up1(2-),\s\d1(4)) ),c(CO eq \\al(\s\up1(2-),\s\d1(3)) )) =10y2−y1
4.[2022·河北武邑中学高三月考]某温度下,向10 mL 0.1 ml·L-1 CuCl2溶液中滴加0.1 ml·L-1的Na2S溶液,滴加过程中溶液中-lg c(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是( )
已知:lg 2=0.3,Ksp(ZnS)=3×10-25 ml2·L-2。
A.a、b、c三点中,水的电离程度最大的为b点
B.Na2S溶液中:
c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C.该温度下Ksp(CuS)=4×10-36 ml2·L-2
D.向100 mL Zn2+、Cu2+浓度均为10-5 ml·L-1的混合溶液中逐滴加入10-4 ml·L-1的Na2S溶液,Zn2+先沉淀
5.[2022·荆门调研]25 ℃时,5种盐的溶度积常数(Ksp)如表所示:
结合相关数据分析,下列说法不正确的是( )
A.除去溶液中的Ag+用硫化钠溶液比硫酸钠效果好
B.向AgCl(s)⇌Ag+(aq)+Cl-(aq)平衡体系中加入少量氯化钠固体,溶液中c(Ag+)不变
C.向少量溴化银悬浊液中加入足量饱和食盐水,沉淀颜色会由浅黄色变为白色
D.向生成的黄色AgI沉淀中滴加少量Na2S溶液,沉淀会变为黑色
6.[2022·冀州月考]以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,下列分析正确的是( )
A.相同条件下,MnS的溶解度小于CuS、PbS、CdS等硫化物的溶解度
B.除杂试剂MnS也可用Na2S替代
C.MnS与Cu2+反应的离子方程式是Cu2++S2-===CuS↓
D.整个过程中涉及的反应类型有氧化还原反应和复分解反应
7.[2022·昆明市高三摸底调研]在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。已知该温度下AgCl的Ksp=1.8×10-10。下列说法正确的是( )
A.t℃时,Ag2CrO4的Ksp为1.0×10-8
B.t℃时,Y点和Z点时Ag2CrO4的Ksp不相等
C.往Ag2CrO4饱和溶液中加入K2CrO4,可使Y点最终变为X点
D.t℃时,将0.01 ml·L-1 AgNO3溶液滴入20 mL 0.01 ml·L-1 KCl和0.01 ml·L-1 K2CrO4的混合溶液中,Cl-先沉淀
8.绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
9.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO eq \\al(\s\up11(2-),\s\d4(4)) )=-lgc(SO eq \\al(\s\up11(2-),\s\d4(4)) )。下列说法正确的是( )
A.该温度下,Ksp(BaSO4)=1.0×10-24
B.a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
C.d点表示的是该温度下BaSO4的不饱和溶液
D.加入BaCl2可以使溶液由c点变到a点
10.[2022·陕西部分学校联考]常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子的浓度变化如图所示[注:第一次平衡时c(I-)=2×10-3 ml·L-1,c(Pb2+)=1×10-3 ml·L-1],下列有关说法正确的是( )
A.常温下,PbI2的Ksp=2×10-6
B.温度不变,向PbI2饱和溶液中加入少量KI浓溶液,PbI2的溶度积变大,I-浓度不变
C.常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)⇌PbS(s)+2I-(aq)的化学平衡常数为5×1018
D.t时刻改变的条件是升高温度,PbI2的Ksp增大
专练43 难溶电解质的沉淀溶解平衡
1.C 三种卤化银组成形式相同,Ksp小的物质先形成沉淀,故a点时形成的是黄色的AgI沉淀,A项错误;由图知,当消耗4.5 mL AgNO3溶液时,溶液中I-、Br-、Cl-均沉淀完全,由于三种卤素离子浓度相同,故每种离子完全沉淀时均消耗1.5 mL AgNO3溶液,则0.100 ml·L-1×1.5 mL=c(I-)×15 mL,解得c(I-)=0.01 ml·L-1,B项错误;当Br-恰好沉淀完全时,溶液体积为18 mL,溶液中c(Ag+)= eq \f(Ksp(AgBr),1×10-5 ml·L-1) =5.4×10-8ml·L-1,此时Qc(AgCl)=c(Ag+)·c(Cl-)=5.4×10-8× eq \f(15×0.01,18) =4.5×10-10>Ksp(AgCl),故此时有部分Cl-形成了沉淀,C项正确;b点时溶液中I-、Br-、Cl-均沉淀完全,AgNO3过量,c(Ag+)最大,D项错误。
2.C 溶液pH=4时c(H+)=1×10-4 ml·L-1,由图知,此时c2(M+)=7.5×10-8(ml·L-1)2,c(M+)<3.0×10-4 ml·L-1,A项正确;由图知,当c(H+)=0,即不向溶液中加酸时,c2(M+)=5.0×10-8(ml·L-1)2,c(M+)= eq \r(5) ×10-4 ml·L-1,由MA(s)⇌M+(aq)+A-(aq)知,MA的饱和溶液中c(M+)=c(A-),则Ksp(MA)=c(M+)×c(A-)=5.0×10-8,B项正确;MA的饱和溶液因A-水解而显碱性,只有加入一定量的酸才能使溶液显中性,若加入的酸不是HA,则溶液中除含有M+、H+、OH-、A-四种离子外还含有其他阴离子,由电荷守恒原理知,C项错误;溶液中c(M+)= eq \f(Ksp,c(A-)) = eq \f(Ksp,\f(Ka(HA)·c(HA),c(H+))) = eq \f(Ksp·c(H+),Ka(HA)·c(HA)) ,根据MA⇌M++A-,A-+H+⇌HA知,溶液中c(HA)=c(M+)-c(A-)=c(M+)- eq \f(Ksp,c(M+)) ,两式联立可得c(M+)·Ka(HA)·[c(M+)- eq \f(Ksp,c(M+)) ]=Ksp·c(H+),化简可得c2(M+)=Ksp[ eq \f(c(H+),Ka(HA)) +1],将Ksp=5×10-8代入,由图知,c(H+)=20×10-5 ml·L-1时,c2(M+)=10.0×10-8 (ml·L-1)2,将数据代入计算得Ka(HA)=2.0×10-4,D项正确。
3.B 根据相同温度下,Ksp(BaSO4)<Ksp(BaCO3),可进行如下分析:当横坐标均为5.1时,即c(Ba2+)=10-5.1 ml·L-1时,阴离子浓度:d点<c点;c、d两点均在沉淀溶解平衡曲线上,即溶度积常数:d点<c点,故曲线①代表BaSO4的沉淀溶解曲线。结合上述分析,可知曲线①代表BaSO4的沉淀溶解曲线,曲线②代表BaCO3的沉淀溶解曲线,A项错误;根据曲线①过横、纵坐标均为5.0的点可知,溶解平衡体系中c(Ba2+)=c(SO eq \\al(\s\up11(2-),\s\d4(4)) )=1×10-5.0ml·L-1,则该温度下Ksp(BaSO4)=c(Ba2+)·c(SO eq \\al(\s\up11(2-),\s\d4(4)) )=1×10-(5.0+5.0)=1×10-10,B项正确;加适量BaCl2固体,溶液中c(Ba2+)增大,由于温度保持不变,即溶液中c(CO eq \\al(\s\up11(2-),\s\d4(3)) )减小,可使溶液由b点向a点移动,C项错误;当c(Ba2+)=10-5.1 ml·L-1时,d点平衡时c(SO eq \\al(\s\up11(2-),\s\d4(4)) )=10-y2ml·L-1,c点平衡时c(CO eq \\al(\s\up11(2-),\s\d4(3)) )=10−y1ml·L-1,即两溶液中 eq \f(c(SO eq \\al(\s\up1(2-),\s\d1(4)) ),c(CO eq \\al(\s\up1(2-),\s\d1(3)) )) =10−y210−y1=10y2−y1,D项错误。
4.C CuCl2、Na2S水解促进水电离, b点是CuCl2与Na2S溶液恰好完全反应的点,溶质是氯化钠,对水的电离没有作用,水的电离程度最小, A错误;根据物料守恒,Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),故B错误;b点是CuCl2与Na2S溶液恰好完全反应的点,c(Cu2+)=c(S2-),根据b点数据,c(Cu2+)=2×10-18 ml·L-1,该温度下Ksp(CuS)=4×10-36 ml2·L-2,故C正确;Ksp(ZnS)=3×10-25 ml2·L-2大于Ksp(CuS),所以向100 mL Zn2+、Cu2+浓度均为10-5 ml·L-1的混合溶液中逐滴加入10-4 ml·L-1的Na2S溶液,Cu2+先沉淀, D错误。
5.B Ag2S的溶度积比Ag2SO4的小,更易生成Ag2S沉淀,Ag+除去得更完全,A项正确;由于温度一定时氯化银的溶度积一定,加入少量氯化钠会增加氯离子浓度,平衡逆向移动,所以溶液中银离子浓度会减小,B项错误;由于饱和NaCl溶液中Cl-的浓度较大,溴化银沉淀会转化为氯化银沉淀,C项正确;因为硫化银更难溶,所以碘化银会转化为黑色的硫化银,D项正确。
6.D 相同条件下,MnS的溶解度应大于CuS、PbS、CdS,A项错误;用Na2S替代MnS,会引入S2-和Na+杂质,同时也能生成MnS沉淀,B项错误;沉淀转化的离子方程式为Cu2+(aq)+MnS(s)===CuS(s)+Mn2+(aq),C项错误;整个反应过程中,由MnO2制得MnCl2的反应是氧化还原反应,沉淀转化是复分解反应,D项正确。
7.D Ag2CrO4的沉淀溶解平衡为: Ag2CrO4(s)⇌2Ag++CrO eq \\al(\s\up11(2-),\s\d4(4)) ;Ksp=c2(Ag+)·c(CrO eq \\al(\s\up11(2-),\s\d4(4)) )=(1×10-3)2×(1×10-5)=1×10-11,A错误;一定温度下溶度积是常数,随温度变化,不随浓度变化,所以t℃时,Y点和Z点时的Ksp相等,B错误;在饱和Ag2CrO4溶液中加入K2CrO4,仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故C错误;t℃时,将0.01 ml·L-1 AgNO3溶液滴入20 mL 0.01 ml·L-1 KCl和0.01 ml·L-1 K2CrO4、Ag2CrO4的混合溶液中,Cl-开始沉淀时c(Ag+)= eq \f(Ksp(AgCl),c(Cl-)) = eq \f(1.8×10-10,0.01) ml·L-1=1.8×10-8 ml·L-1,CrO eq \\al(\s\up11(2-),\s\d4(4)) 开始沉淀时,c(Ag+)= eq \r(\f(Ksp(Ag2CrO4),c(CrO eq \\al(\s\up1(2-),\s\d1(4)) ))) = eq \r(\f(1.0×10-11,0.01)) ml·L-1=10-4.5 ml·L-1,故Cl-先沉淀,D正确。
8.B CdS在水中达到溶解平衡时Cd2+、S2-浓度相等,可求出一定温度下CdS在水中的溶解度,A项正确;m、p、n为同一温度下的CdS的溶解平衡状态,三点的Ksp相等,B项错误;向m点溶液中加入Na2S,S2-浓度增大,但Ksp不变,则溶液组成由m沿T1时的平衡曲线向p方向移动,C项正确;温度降低,Ksp减小,q沿qp线向p方向移动,D项正确。
9.D 由图像可知,p(Ba2+)=4,p(SO eq \\al(\s\up11(2-),\s\d4(4)) )=6则Ksp=c(Ba2+)·c(SO eq \\al(\s\up11(2-),\s\d4(4)) )=10-10,A项错误;处于同一温度下,Ksp相等,B项错误;d点时p(Ba2+)偏小,则c(Ba2+)偏大,溶液过饱和,C项错误;加入BaCl2,c(Ba2+)增大,有沉淀析出,c(SO eq \\al(\s\up11(2-),\s\d4(4)) )减小,平衡正向移动,则可使溶液由c点变到a点,D项正确。
10.C 由PbI2(s)⇌Pb2+(aq)+2I-(aq)得Ksp=c(Pb2+)·c2(I-)=1×10-3×(2×10-3)2=4×10-9,A项错误;由于KI是强电解质,完全电离产生I-,温度不变,PbI2的溶度积不变,I-浓度增大,B项错误;PbI2(s)+S2-(aq)⇌PbS(s)+2I-(aq)的平衡常数K= eq \f(c2(I-),c2(S2-)) = eq \f(Ksp(PbI2),Ksp(PbS)) =5×1018,C项正确;若t时刻改变的条件是升高温度,则c(Pb2+)、c(I-)均呈增大趋势,D项错误。Ag2SO4
Ag2S
AgCl
AgBr
AgI
1.4×10-5
6.3×10-50
1.8×10-10
7.7×10-13
8.51×10-16
高考化学《微专题 小练习》统考版 专练 43: 这是一份高考化学《微专题 小练习》统考版 专练 43,共5页。试卷主要包含了[全国甲卷]下图为Fe等内容,欢迎下载使用。
新高考2024版高考化学一轮复习微专题小练习专练43难溶电解质的沉淀溶解平衡: 这是一份新高考2024版高考化学一轮复习微专题小练习专练43难溶电解质的沉淀溶解平衡,共6页。试卷主要包含了100 ml·L-1,75等内容,欢迎下载使用。
统考版2024版高考化学一轮复习微专题小练习专练43难溶电解质的沉淀溶解平衡: 这是一份统考版2024版高考化学一轮复习微专题小练习专练43难溶电解质的沉淀溶解平衡,共6页。












