





高中鲁科版 (2019)第3节 元素周期表的应用课堂教学ppt课件
展开
这是一份高中鲁科版 (2019)第3节 元素周期表的应用课堂教学ppt课件,共42页。PPT课件主要包含了内容索引,素养目标,电子层数,核电荷数,得电子,失电子,最外层电子数,MgAl,SiH4,PH3等内容,欢迎下载使用。
基础落实•必备知识全过关
重难探究•能力素养全提升
学以致用•随堂检测全达标
1.以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系,学会运用证据推理与模型认知的思维解决实际问题。2.能设计实验探究同周期元素的非金属性及金属性强弱,培养科学探究与创新意识。
[知识铺垫]1.同周期元素自左向右元素原子的 相同, 逐渐增大,原子核对外层电子的吸引力逐渐 ,原子 能力逐渐增强, 能力逐渐减弱。2.可以通过单质与水(或酸)反应的剧烈程度判断元素原子 的能力。3.元素原子得失电子的能力与原子的 、 和 都有关系。
[必备知识]一、比较钠、镁、铝三种金属元素失电子的能力1.钠、镁与水反应的实验探究见第1节第3课时,必备知识一、(1)。
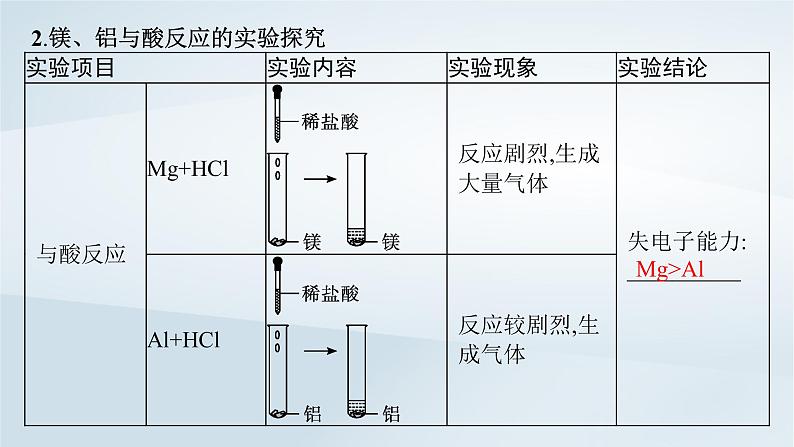
2.镁、铝与酸反应的实验探究
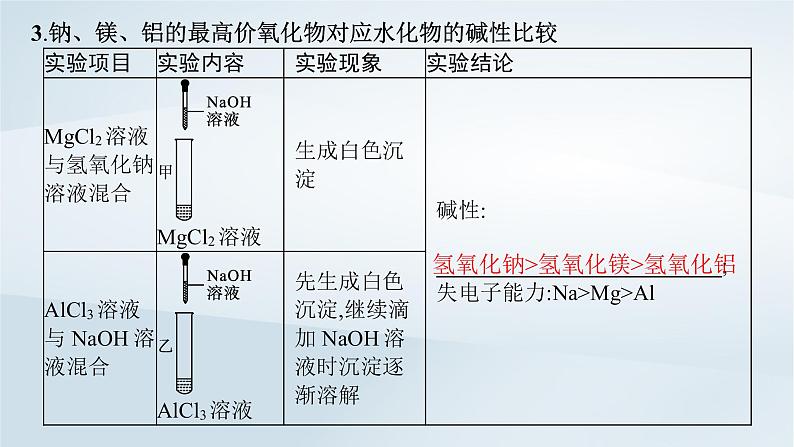
3.钠、镁、铝的最高价氧化物对应水化物的碱性比较
氢氧化钠>氢氧化镁>氢氧化铝
二、硅、磷、硫、氯四种非金属元素原子得电子能力的比较
三、同周期元素原子得失电子能力的变化规律(稀有气体除外)1.规律同周期从左到右,主族元素的原子得电子能力 ,失电子能力 。2.理论解释同周期主族元素原子从左到右,电子层数 ,核电荷数 ,原子半径 ,原子核对最外层电子的吸引力依次 ,元素原子失电子能力依次 ,得电子能力依次 。
【微思考1】工业上在850 ℃时用钠还原熔融态氯化钾的方法制备金属钾:Na(l)+KCl(l) K(g)+NaCl(l)。该过程能否说明金属钠比金属钾的失电子能力强? 【微思考2】同一周期中,非金属元素对应的所有含氧酸的酸性都随原子序数的增大而增强吗?
提示 不能。用金属钠与氯化钾反应制取钾,是利用钾的沸点比钠低,易变成气体从反应体系中脱离出来,从而促使反应进行。
提示 不一定。同一周期随着原子序数的递增,非金属元素最高价氧化物对应水化物(即最高价含氧酸)的酸性逐渐增强,但低价含氧酸不符合此规律,如酸性:HClOMg>Al。( )2.与盐酸反应的剧烈程度:Na>Mg>Al。( )3.碱性:Mg(OH)2>NaOH>Al(OH)3。( )4.金属离子得电子数目越少,氧化性越强。( )5.与氢气化合的剧烈程度:C>N2>O2>F2。( )6.HClO是氧化性很强的酸,因酸性HClOCl。( )7.稳定性SiH4Mg2+>Al3+。
提示 Na、Mg、Al的主要化合价分别为+1价、+2价、+3价。同一周期从左往右元素的最高化合价逐渐增大。
[深化拓展] 同周期主族元素从左到右性质的变化规律
[应用体验]【例1】X、Y为同一周期的主族元素,如果X的原子半径大于Y的原子半径,则下列说法不正确的是( )A.若X、Y均为金属元素,则X的失电子能力强于YB.若X、Y均为金属元素,则X的阳离子的氧化性比Y的阳离子的氧化性弱C.若X、Y均为非金属元素,则Y的气态氢化物比X的气态氢化物稳定D.若X、Y均为非金属元素,则Y的最高价含氧酸的酸性弱于X的
答案 D解析 X、Y为同周期的主族元素,原子半径X>Y,则原子序数XY,阳离子氧化性X
相关课件
这是一份高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用优质ppt课件,共34页。PPT课件主要包含了较剧烈,金属元素的性质,非金属元素的性质,半导体等内容,欢迎下载使用。
这是一份化学必修 第二册第3节 元素周期表的应用图片课件ppt,共56页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
这是一份高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用说课课件ppt,共51页。PPT课件主要包含了内容索引,素养目标,HXO4,实验内容等内容,欢迎下载使用。










