






鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构示范课课件ppt
展开基础落实•必备知识全过关
重难探究•能力素养全提升
学以致用•随堂检测全达标
1.通过知道手性分子的定义,会判断不对称碳原子,形成证据推理与模型认知的化学核心素养。2.通过理解共价键的极性、分子的空间结构与分子极性的关系,学会判断简单分子极性的方法,培养证据推理与模型认知的化学核心素养。
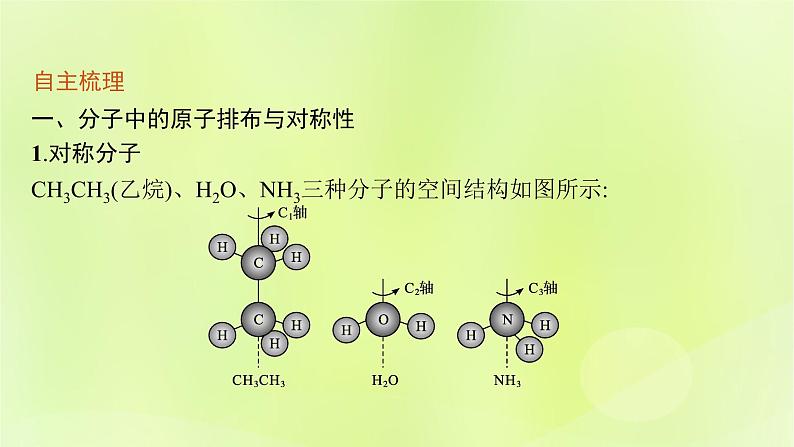
一、分子中的原子排布与对称性1.对称分子CH3CH3(乙烷)、H2O、NH3三种分子的空间结构如图所示:
(1)若将三种分子分别绕C1轴、C2轴、C3轴旋转一定角度后可与原分子重合,C1、C2、C3分别为相应分子的对称轴。(2)甲烷分子中碳原子和其中两个氢原子所构成的平面为甲烷分子的对称面。(3)依据对称轴的旋转或借助对称面的反映能够复原的分子称为对称分子,分子所具有的这种性质称为对称性。(4)分子的许多性质如极性、旋光性等都与分子的对称性有关。
【微思考1】什么是对称轴?提示 以甲烷分子为例,以通过碳原子和氢原子的连线为轴旋转120°或240°时,分子完全恢复原状,我们称这条连线为对称轴。【微思考2】什么是对称面?提示 以甲烷分子为例,通过碳原子和其中两个氢原子所构成的平面,分子被分割成相同的两部分,我们称这个平面为对称面。
【微思考3】如何判断一个分子为手性分子?提示 由于大多数的手性分子都含有不对称碳原子,因此有机化学中常用有无不对称碳原子推测分子是否为手性分子,进而判断分子有无旋光性,这是一个简单实用但并不全面的判断标准。
二、分子中的电荷分布与极性1.极性分子与非极性分子分子内存在正、负两极的分子,通常称为极性分子,分子内不存在正、负两极的分子,称为非极性分子。2.对于一个分子来说,可以设想它的全部正电荷集中于一点,这一点叫作正电荷重心;同样,可以设想它的全部负电荷集中于一点,这一点叫作负电荷重心。正、负电荷重心所带电荷相同但电性相反。在极性分子中,正、负电荷重心不重合,因此分子内存在正、负两极,在非极性分子中,正、负电荷重心重合,因此分子内不存在正、负两极。
【微思考4】NH3、CH4、H2O、CO2四种分子中正、负电荷重心重合的是哪些?正、负电荷重心不重合的是哪些?提示 NH3、CH4、H2O、CO2四种分子中正负电荷重心重合的是CH4和CO2,正负电荷重心不重合的是NH3、H2O。
3.双原子分子的极性对双原子分子来说,键的极性与分子的极性是一致的:化学键有极性,分子就有极性;反之,化学键无极性,分子也无极性。
4.多原子分子的极性多原子分子的极性除了与键的极性有关外,还与分子的空间结构有关:
分子的极性会影响分子的性质。在相对分子质量相同的情况下,极性分子比非极性分子有更高的沸点。极性分子易溶于极性溶剂,如氨、乙醇等极性分子易溶于水;非极性分子易溶于非极性溶剂,这就是我们常说的“相似相溶”原理中的一种类型。如油脂、石油的成分难溶于水,而溶于非极性或极性较小的溶剂。
5.“相似相溶”原理
是经验规律。有例外,如CO、NO等为极性分子但难溶于水
1.正误判断:(1)CH4分子是面对称。( )(2)NH3和H2O分子是面对称。( )(3)由极性键构成的分子都是极性分子。( )(4)双原子单质分子都是非极性分子。( )
2.下列叙述正确的是( )A.含有非极性键的分子一定是非极性分子B.非极性分子中一定含有非极性键C.由极性键形成的双原子分子一定是极性分子D.分子的极性只与键的极性有关答案 C解析 含有非极性键的分子不一定是非极性分子,如H2O2;非极性分子中不一定含有非极性键,如CH4、CO2均是只含有极性键的非极性分子;分子的极性除与键的极性有关外,还与分子的空间结构有关。
观察比较下图所示两种分子的结构:
分析这两种分子在结构上是怎样的关系?
提示 它们的相同点是分子组成相同,分子式都是CHFClBr;不同点是在空间上完全不同,它们构成实物与其镜像的关系。
手性分子(1)手性同分异构体(又称对映异构体)的两个分子互为镜像关系。(2)一般情况下,含不对称碳原子的分子称手性分子。(3)构成生命体的有机化合物绝大多数为手性分子。
【典例1】如下图中两分子的关系是( )
A.互为同分异构体B.是同一种物质C.是手性分子 D.互为同系物
答案 B解析 本题很容易看成为镜面对称结构而选择手性分子,但根据手性分子的判断方法,根本找不到不对称碳原子,所以不是手性分子;分子组成相同,空间结构相同,是同一种物质。
规律方法分子是否表现手性的判断分子表现手性,是因为其含有不对称碳原子。如果一个碳原子所连接的四个原子或基团各不相同,那么该碳原子称为不对称碳原子,用*C来表示。例如 ,其中R1、R2、R3、R4是互不相同的原子或基团。所以,判断一种有机化合物分子是否具有手性,就看其含有的碳原子是否连有四个不同的原子或基团。
变式训练1-1下列化合物中含有不对称碳原子的是( )A.CCl2F2 B.CH3CH2OH
变式训练1-2下列分子属于手性分子的是( )
答案 B解析 B项分子中的一个碳原子连—CH3、—Cl、—OH、—CH2CH3四种不同的原子和原子团,该碳原子属于不对称碳原子,该分子属于手性分子。
1.在一酸式滴定管中加入四氯化碳,打开活塞,将用毛皮摩擦过的橡胶棒靠近四氯化碳液流,在另一酸式滴定管中加入蒸馏水,打开活塞,并将用毛皮摩擦过的橡胶棒靠近水液流。(1)你会观察到什么现象?提示 四氯化碳液流方向不变,水流方向发生改变。(2)你会得到什么结论?原因是什么?提示 四氯化碳液流与橡胶棒无电性作用,水流与橡胶棒之间有电性作用。因为四氯化碳是非极性分子,分子中无正极和负极之分;水分子是极性分子,水分子中存在带正电荷的正极和带负电荷的负极。
2.极性分子中一定含有极性键,一定不含非极性键吗?提示 极性分子中一定含有极性键,可能含有非极性键。3.非极性分子中一定含有非极性键吗?提示 不一定。分子结构对称时,可能含有极性键,而不含有非极性键。
1.分子极性的判断方法
2.常见的极性分子和非极性分子
【典例2】HF、H2O、NH3、CS2、CH4、N2、BF3分子中:(1)以非极性键结合的非极性分子是 ; (2)以极性键结合的具有直线形结构的非极性分子是 ; (3)以极性键结合的具有正四面体形结构的非极性分子是 ; (4)以极性键结合的具有三角锥形结构的极性分子是 ; (5)以极性键结合的具有sp3杂化轨道结构的分子是 ; (6)以极性键结合的具有sp2杂化轨道结构的分子是 。
答案 (1)N2 (2)CS2 (3)CH4 (4)NH3(5)NH3、H2O、CH4 (6)BF3
解析 HF是含有极性键的双原子分子,为极性分子;H2O中氧原子采取sp3杂化,氧原子与氢原子形成极性键,为极性分子;NH3中氮原子采取sp3杂化,与氢原子形成极性键,为三角锥形的极性分子;CS2与CO2相似,是由极性键形成的直线形非极性分子;CH4中碳原子采取sp3杂化,与氢原子形成极性键,为正四面体形的非极性分子;N2是由非极性键结合的非极性分子;BF3中硼原子采取sp2杂化,与F形成极性键,为非极性分子。
规律方法判断ABn型分子极性的经验规律(1)若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,若不等则为极性分子。(2)若中心原子有孤电子对,则为极性分子;若无孤电子对,则为非极性分子。如CS2、BF3、SO3、CH4为非极性分子;H2S、SO2、NH3为极性分子。
变式训练2-1下列各组分子属于含有非极性键的非极性分子的是( )A.CO2、H2SB.C2H4、CH4C.Cl2、C2H2D.NH3、HCl
变式训练2-2(1)写出H2O、NH3、CH4、CS2的电子式。(2)通过上述分子的电子式分析分子的极性与中心原子的成键情况有何规律?
(2)中心原子最外层电子全部参与成键且结合同一种原子时,形成的分子为非极性分子,中心原子含有孤电子对时,形成的分子为极性分子。
1.(2020福建厦门外国语学校高二检测)下列物质中不存在对映异构体的是( )A.BrCH2CHOHCH2OH
答案 D解析 若同一个碳原子上连接四个不同的原子或基团,则该碳原子称为不对称碳原子,含有不对称碳原子的物质存在对映异构体,D项分子中不存在不对称碳原子,因此该分子不存在对映异构体。
2.丙氨酸(C3H7NO2)分子为手性分子,存在手性异构体,其结构如图所示:
下列关于丙氨酸的两种手性异构体(Ⅰ和Ⅱ)的说法正确的是( )A.Ⅰ和Ⅱ分子中均存在2个不对称碳原子B.Ⅰ和Ⅱ呈镜面对称,都是非极性分子C.Ⅰ和Ⅱ分子都是极性分子,只含有极性键,不含非极性键D.Ⅰ和Ⅱ所含的化学键相同
答案 D解析 Ⅰ和Ⅱ分子中都只含有1个不对称碳原子,A错误;Ⅰ和Ⅱ分子结构不对称,都是极性分子,B错误;Ⅰ和Ⅱ分子中既含有极性键又含有非极性键,C错误;Ⅰ和Ⅱ互为手性异构体,所含化学键相同,D正确。
3.下列分子中,属于非极性分子的是( )A.SO2B.NH3C.BBr3D.COCl2
4.下列分子是极性分子的是( )A.PCl3B.SO3C.BF3D.CS2答案 A解析 PCl3中P的最外层有5个电子,其化合价为+3,中心原子的化合价的绝对值不等于原子的最外层电子数,属于极性分子,A项符合题意;SO3中S的最外层有6个电子,其化合价为+6,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,B项不符合题意;BF3中B的最外层有3个电子,其化合价为+3,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,C项不符合题意;CS2中C的最外层有4个电子,其化合价为+4,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,D项不符合题意。
5.指出下列各组分子的极性和空间结构:(1)OF2 ;BeF2 。 (2)PF3 ;BF3 。 (3)CF4 ;SiF4 。
鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构课前预习课件ppt: 这是一份鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构课前预习课件ppt,共17页。
2020-2021学年第2节 共价键与分子的空间结构授课ppt课件: 这是一份2020-2021学年第2节 共价键与分子的空间结构授课ppt课件,共51页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
2020-2021学年第2节 共价键与分子的空间结构教学ppt课件: 这是一份2020-2021学年第2节 共价键与分子的空间结构教学ppt课件,共41页。PPT课件主要包含了课前自主学习,对称轴,对称面,蛋白质,不对称,发生改变,负两极,非极性,课堂合作探究,课堂素养达标等内容,欢迎下载使用。













