


2022天津市耀华中学高三下学期一模化学试题含答案
展开天津市耀华中学2022届高三年级第一次模拟考试
化学试卷
以下数据可供解题时参考:相对原子质量:H-1 C-12 N-14 O-16
第I卷(共36分)
注意事项:
1.每题选出答案后,用铅笔将答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
2.本卷共12题,每题3分,共36分。在每题给出的四个选项中,只有一项是最符合题目要求的。
1. 化学助推我国科技的发展,下列有关叙述不正确的是
A. 神舟十三号飞船返回舱外面是一层耐高温的陶瓷材料,属于无机非金属材料
B. 冬奥会国家速滑馆“冰丝带”首次使用二氧化碳直冷制冰,比氟利昂制冰更环保
C 利用新型材料和技术,将二氧化碳填埋有利于实现“碳中和”
D. 冬奥会火炬使用氢气为燃料实现了零排放,加入钠盐等因发生化学变化产生美丽的焰色
【答案】D
【解析】
【详解】A.耐高温的陶瓷材料是一种新型的无机非金属材料,A正确;
B.国家速滑馆首次采用二氧化碳直冷制冰,能减少氟利昂的排放,降低了对臭氧层的破坏,比氟利昂制冰更环保,B正确;
C.利用新型材料和技术将二氧化碳填埋可以减少空气中二氧化碳含量,有助于实现碳中和,C正确;
D.焰色反应是物理变化,故冬奥会火炬使用氢气为燃料实现了零排放,加入钠盐等因发生物理变化(焰色反应)产生美丽的焰色,D错误;
故答案为:D。
2. 对于下列实验,能正确描述其反应的离子方程式是
A. 向氢氧化钡溶液中滴加硫酸氢钠溶液:
B. 向覆铜板上滴加溶液:
C. 向纯碱溶液中滴加少量盐酸:
D. 向次氯酸钙溶液中通入少量气体:
【答案】B
【解析】
【详解】A.氢氧化钡溶液中滴加硫酸氢钠溶液,还会生成硫酸钡沉淀,A错误;
B.铜和氯化铁反应生成氯化铜和氯化亚铁:,B正确;
C.纯碱溶液中滴加少量盐酸生成碳酸氢钠和氯化钠,+H+= ,C错误;
D.次氯酸根离子具有氧化性,会和二氧化硫生成硫酸根离子,+3 ClO-+ H2O =+Cl-+2HClO,D错误;
故选B。
3. 下列有关化学用语表示正确的是
A. 水分子的球棍模型: B. 钾原子的结构示意图:
C. Na2O2的电子式: D. 中子数为20的氯原子:
【答案】A
【解析】
【详解】A.水分子的电子式为 ,由于受孤电子对的排斥作用,成键电子对发生偏移,所以球棍模型为 ,A正确;
B.钾为19号元素,其核外有19个电子,原子结构示意图为 ,B不正确;
C.Na2O2为离子化合物,两个O原子间只形成1对共用电子,其电子式为 ,C不正确;
D.中子数为20的氯原子,质量数为37,其原子符号为,D不正确;
故选A。
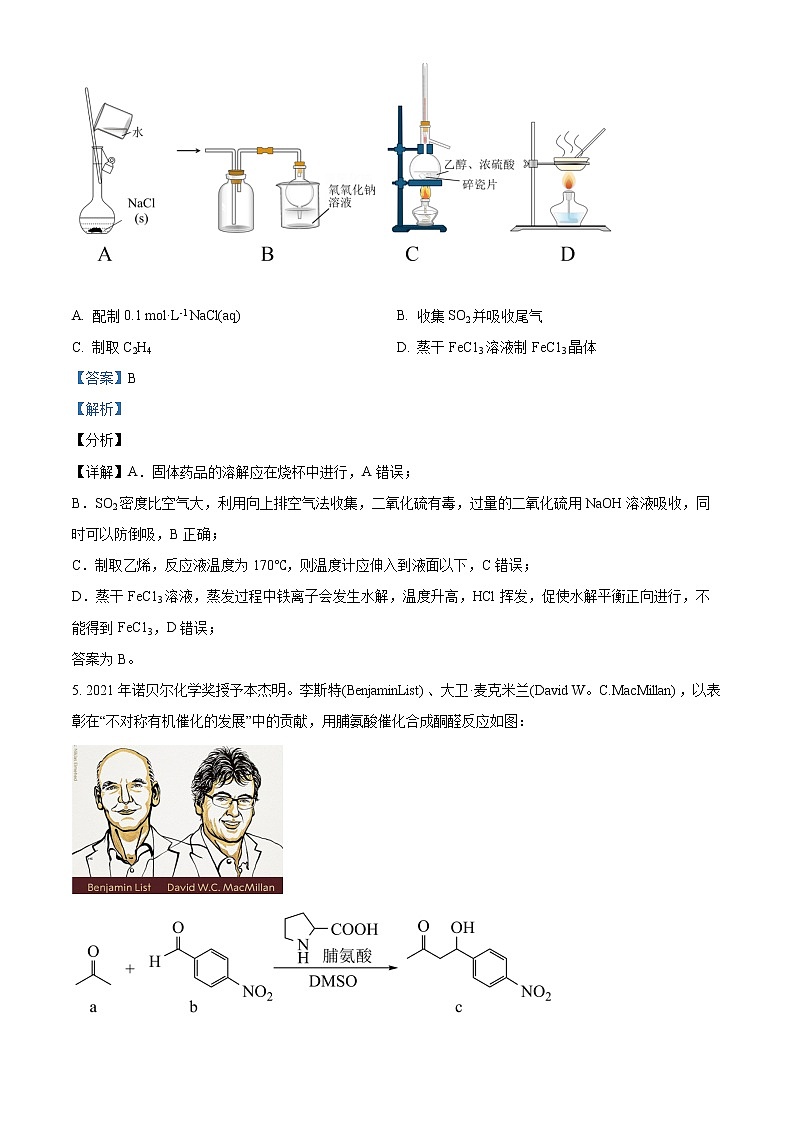
4. 利用下列装置进行实验,能达到实验目的的是
A. 配制0.1 mol·L-1 NaCl(aq) B. 收集SO2并吸收尾气
C. 制取C2H4 D. 蒸干FeC13溶液制FeC13晶体
【答案】B
【解析】
【分析】
【详解】A.固体药品的溶解应在烧杯中进行,A错误;
B.SO2密度比空气大,利用向上排空气法收集,二氧化硫有毒,过量的二氧化硫用NaOH溶液吸收,同时可以防倒吸,B正确;
C.制取乙烯,反应液温度为170℃,则温度计应伸入到液面以下,C错误;
D.蒸干FeC13溶液,蒸发过程中铁离子会发生水解,温度升高,HCl挥发,促使水解平衡正向进行,不能得到FeC13,D错误;
答案为B。
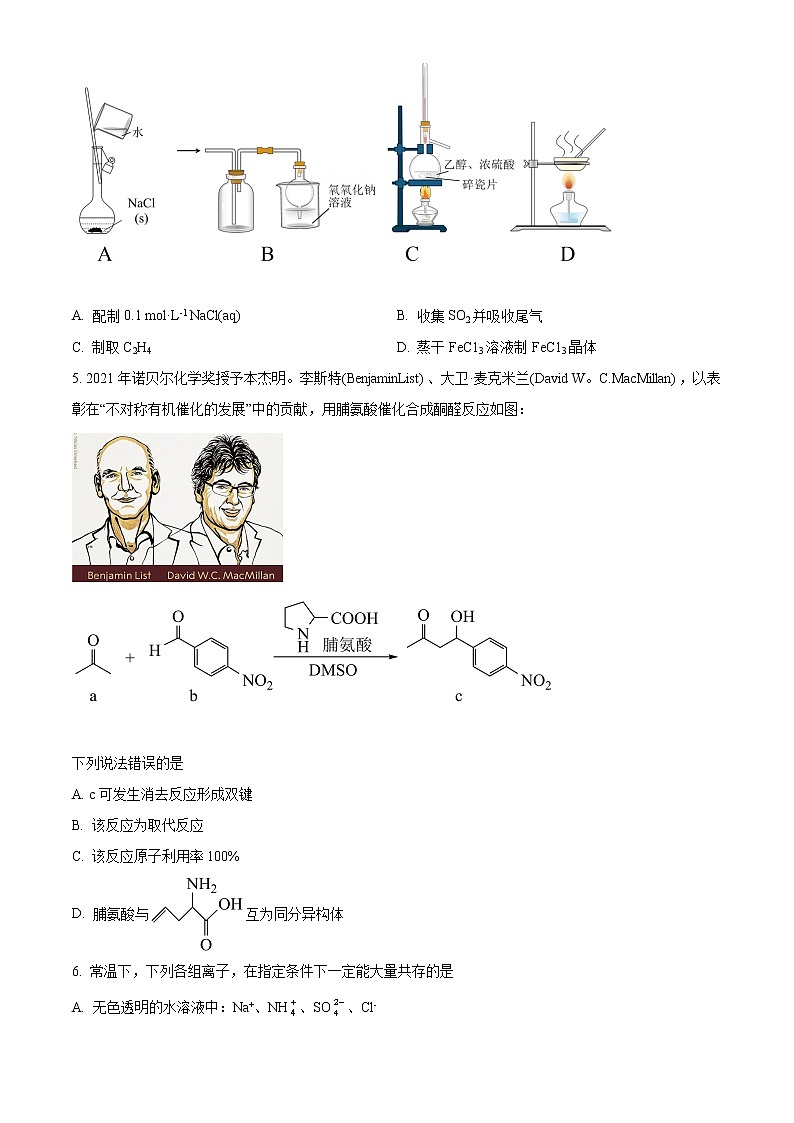
5. 2021年诺贝尔化学奖授予本杰明。李斯特(BenjaminList)、大卫·麦克米兰(David W。C.MacMillan),以表彰在“不对称有机催化的发展”中的贡献,用脯氨酸催化合成酮醛反应如图:
下列说法错误的是
A. c可发生消去反应形成双键
B. 该反应为取代反应
C. 该反应原子利用率100%
D. 脯氨酸与互为同分异构体
【答案】B
【解析】
【详解】A.c中含羟基,可发生消去反应形成双键,A项正确;
B.该反应由两个反应物得到一个产物,为加成反应,B项错误;
C.反应物中的原子全部进入目标产物c,原子利用率100%,C项正确;
D.两者分子式相同,结构不同,互为同分异构体,D项正确;
故选:B。
6. 常温下,下列各组离子,在指定条件下一定能大量共存的是
A. 无色透明的水溶液中:Na+、NH、SO、Cl-
B. 含大量Fe3+的水溶液中:Ca2+、K+、Br-、S2-
C. 滴加甲基橙显红色的水溶液中:Mg2+、Fe2+、SO、NO
D. 由水电离的c(H+)=1.0×10-13mol/L的溶液中:K+、Na+、Cl-、HCO
【答案】A
【解析】
【详解】A.各种离子之间不反应,都是无色离子,能够大量共存,故A正确;
B.Fe3+、S2-之间发生氧化还原反应,不能大量共存,故B错误;
C.滴加甲基橙显红色的水溶液呈酸性,Fe2+、NO在酸性条件下发生氧化还原反应,不能大量共存,故C错误;
D.由水电离的c(H+)=1.0×10-13mol/L的溶液呈酸性或碱性,HCO在酸性、碱性环境下均不能大量共存,故D错误;
故选:A。
7. 氢化铝钠(NaAlH4)是最有研究应用前景的络合金属氢化物,氢化铝钠储放氢时发生反应:3NaAlH4Na3AlH6+2Al+3H2↑。下列说法正确的是
A. NaAlH4中氢元素为+1价
B. 1molNa3AlH6含10mol离子
C. 在反应中有50%的氢被氧化
D. 反应中氧化产物与还原产物的物质的量之比为1:1
【答案】C
【解析】
【详解】A.Na为+1价、Al为+3价,故H为-1价,A错误;
B.Na3AlH6由Na+和AlH组成,1molNa3AlH6含4mol离子,B错误;
C.反应中总共有12个H,有6个H的化合价升高,故有50%被氧化,C正确;
D.H元素化合价升高,氧化产物为H2,Al元素化合价降低,还原产物为Al,故物质的量之比为3:2,D错误;
故选:C。
8. 下列除杂方法合理的是
A. 除N2中的NO2:水,洗气
B. 除C2H5OH中的H2O:生石灰,分液
C. 除HCl中的Cl2:饱和食盐水,洗气
D. 除C2H5Br中的Br2:NaHSO3溶液,分液
【答案】D
【解析】
【详解】A.二氧化氮气体和水反应生成一氧化氮气体引入新的杂质气体,A错误;
B.生石灰和水反应生成氢氧化钙,然后蒸馏得到纯净的乙醇,B错误;
C.氯化氢极易溶于水,而氯气在饱和食盐水中溶解度较小,C错误;
D.溴和亚硫酸氢钠反应生成盐溶液,与有机层C2H5Br不相溶,分液分离出C2H5Br,D正确;
故选D。
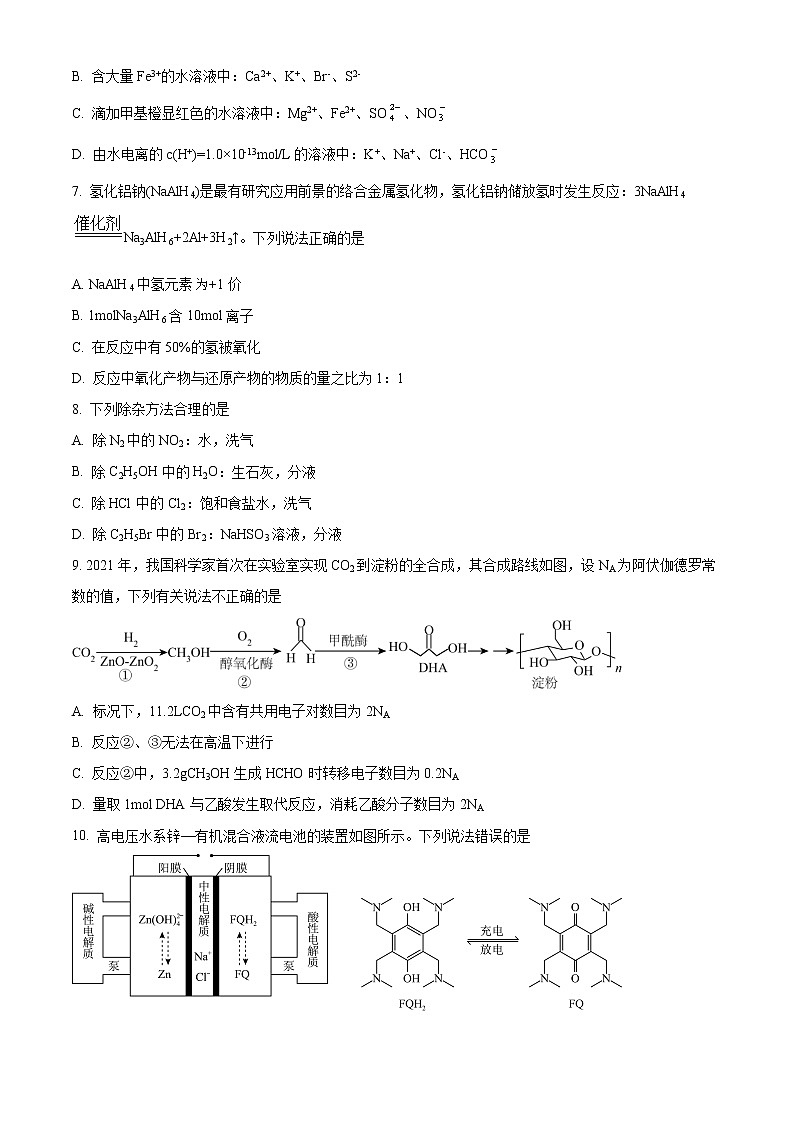
9. 2021年,我国科学家首次在实验室实现CO2到淀粉的全合成,其合成路线如图,设NA为阿伏伽德罗常数的值,下列有关说法不正确的是
A. 标况下,11.2LCO2中含有共用电子对数目为2NA
B. 反应②、③无法在高温下进行
C. 反应②中,3.2gCH3OH生成HCHO时转移电子数目为0.2NA
D. 量取1mol DHA与乙酸发生取代反应,消耗乙酸分子数目为2NA
【答案】D
【解析】
【详解】A.1个CO2含有4个共用电子对,所以标况下,11.2LCO2中含有共用电子对数目为=2NA,A正确;
B.反应②、③均在酶催化作用下发生反应,温度过高,酶会失活,所以不能在高温下进行,B正确;
C.反应②中,若1molCH3OH生成HCHO,转移电子的物质的量为2mol,3.2gCH3OH生成HCHO时转移电子数目为=0.2NA,C正确;
D.根据上图可知,1molDHA中含2mol羧基,但酯化反应是可逆反应,所以量取1mol DHA与乙酸发生取代反应,消耗乙酸分子数目少于2NA,D错误;
故选D。
10. 高电压水系锌—有机混合液流电池的装置如图所示。下列说法错误的是
A. 充电时,中性电解质NaCl的浓度增大
B. 放电时,负极反应式为Zn-2e-+4OH-=Zn(OH)
C. 充电时,1molFQH2转化为FQ转移2mol电子
D. 放电时,正极区溶液pH增大
【答案】A
【解析】
【分析】高电压水系锌-有机混合液流电池工作原理为:放电时为原电池,金属Zn发生失电子的氧化反应生成Zn2+,为负极,则FQ所在电极为正极,正极反应式为2FQ+2e-+2H+═FQH2,负极反应式为Zn-2e-+4OH-=Zn(OH);充电时电解池,原电池的正负极连接电源的正负极,阴阳极的电极反应与原电池的负正极的反应式相反,电解质中阳离子移向阴极、阴离子移向阳极。
【详解】A. 充电时装置为电解池,电解质中阳离子移向阴极、阴离子移向阳极,NaCl溶液中的钠离子和氯离子分别发生定向移动,即电解质NaCl的浓度减小,故A错误;
B. 放电时为原电池,金属Zn为负极,负极反应式为Zn-2e-+4OH-=Zn(OH),故B正确;
C. 充电时电解池,阳极反应为FQH2-2e-=2FQ+2e-+2H+,则1molFQH2转化为FQ时转移2mol电子,故C正确;
D.放电时为原电池,正极反应式为2FQ+2e-+2H+═FQH2,即正极区溶液的pH增大,故D正确;
故选:A。
11. 下列说法正确的是
A. Na露置在空气中最终变为NaOH
B. 可以用H2还原MgO来冶炼金属Mg
C. 擦去氧化膜的Al条在酒精灯上加热,铝会熔化但不滴落
D. 向Fe2(SO4)3溶液中加入过量Zn粉生成FeSO4溶液
【答案】C
【解析】
【分析】
【详解】A.Na露置在空气中被空气中的O2氧化产生Na2O,Na2O与H2O反应产生NaOH,NaOH溶液吸收CO2生成Na2CO3,因此Na露置在空气中最终变为Na2CO3,A错误;
B.Mg是活泼金属,冶炼时要用电解熔融的MgCl2的方法治炼,不能采用H2还原MgO的方法,B错误;
C.擦去氧化膜的Al条在酒精灯上加热,Al与空气中的O2反应产生Al2O3,由于Al2O3的熔点高达2050℃,因此铝熔化后被表面熔点高的氧化膜包裹,故铝熔化但不滴落,C正确;
D.向Fe2(SO4)3溶液中加入过量Zn粉,首先发生反应:Fe2(SO4)3+Zn=2FeSO4+ZnSO4,然后发生反应:Zn+FeSO4=ZnSO4+Fe,故Fe2(SO4)3溶液最终被过量Zn还原产生Fe单质,无FeSO4溶液,D错误;
故合理选项是C。
12. 常温下,向一定浓度的H2X溶液中滴加NaOH溶液,混合溶液的的pH与离子浓度变化的关系如图所示。下列叙述错误的是
A. 直线m表示pH与的关系
B. H2X的电离常数Ka2的数量级为10-5
C. N点水电离出的c(H+)=1×10-4.3mol·L-1
D. 当混合溶液呈中性时,c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-)
【答案】C
【解析】
【分析】根据直线m,当pH=0时或=-1.3,对应电离常数为10-1.3;根据直线n,当pH=0时或=-4.3,对应电离常数为10-4.3, ,所以、。
【详解】A.直线m对应电离常数为10-1.3,所以直线m表示pH与的关系,故A正确;
B.直线m对应电离常数为10-1.3、直线n对应电离常数为10-4.3,H2X的电离常数Ka2的数量级为10-5,故B正确;
C.直线n表示pH与的关系,,N点=0,则c(H+)=1×10-4.3, HX-电离出氢离子使溶液呈酸性,水电离受到抑制,水电离出的c(H+)=1×10-9.7mol·L-1,故C错误;
D.当混合溶液呈中性时,,所以c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-),故D正确;
选C。
第II卷(共64分)
13. 铝、硅、磷三种元素的单质及其化合物在生产生活中有广泛应用。
(1)基态硅原子的价电子的轨道表达式_______;第三周期元素中第一电离能介于铝和磷元素之间的有_______(填元素符号)。
(2)比较铝、磷元素的简单离子半径_______(用相关化学符号表示)。
(3)下列关于三种元素的化合物的叙述正确的是_______。
①三种元素的最高价氧化物均能与水直接化合
②三种元素的最高价氧化物均存在晶体形式,且晶体类型不同
③、均既能与酸又能与碱反应,均属于两性氧化物
(4)与比较,沸点较高的是_______,两种分子中键角较大的是_______,其中的分子构型为_______。
(5)三种单质的晶胞结构如下
这三种晶胞中的原子的个数比为_______。
(6)①工业由粗硅制高纯硅的化学方程式_______。
②利用电池(工作原理如下图所示)能有效地将转化成化工原料草酸铝,根据图示,下列表述正确的是_______。
A.该电池的使用可有效利用
B.电池工作时,电流从铝电极流向多孔碳电极
C.在整个反应过程中的作用是催化剂
D.含离子液体是熔融态的
【答案】(1) ①. ②. Mg、Si、S
(2)P3->Al3+
(3)② (4) ①. SiCl4 ②. SiCl4 ③. 三角锥形
(5)1:2:4 (6) ①. Si+2Cl2SiCl4、SiCl4+2H2Si+4HCl ②. AC
【解析】
【小问1详解】
已知硅是14号元素,则基态硅原子的价电子的电子排布式为:3s2sp2,则其轨道表达式,同一周期从左往右元素第一电离能呈增大趋势,IIA与IIIA、VA与VIA反常,故第三周期元素中第一电离能介于铝和磷元素之间的有Mg、Si、S三种元素,故答案为:;Mg、Si、S;
【小问2详解】
已知Al3+的核外电子层比P3-少一层,故铝、磷元素的简单离子半径大小顺序为:P3->Al3+,故答案为:P3->Al3+;
【小问3详解】
①三种元素的最高价氧化物中Al2O3、SiO2均不能与水直接化合,而P2O5能直接与水化合生成H3PO4,①错误;
②三种元素的最高价氧化物即Al2O3、SiO2和P2O5均存在晶体形式,Al2O3属于离子晶体,SiO2属于原子(共价)晶体,P2O5属于分子晶体,故三者晶体类型不同,②正确;
③、均既能与酸又能与碱反应,但SiO2仅与HF反应不是通性而是特性,故Al2O3属于两性氧化物,而SiO2属于酸性氧化物,③错误;
故答案为:②;
【小问4详解】
与均为分子晶体,且SiCl4的相对分子质量比PCl3的大,SiCl4晶体中的分子间作用力更大,故沸点较高的是SiCl4,中心原子无孤电子对,是正四面体结构,而中心原子有1对孤电子对,是三角锥形结构,故两种分子中键角较大的是SiCl4,其中中心原子P原子周围的价层电子对数为:3+=4,故其分子构型为三角锥形,故答案为:SiCl4;SiCl4;三角锥形;
【小问5详解】
由题干晶胞示意图可知,一个Al晶胞中含有Al数目为:=4,一个Si晶胞中含有Si个数为:+4=8,一个P4晶胞中含有P4分子数目为:=4,则含有P原子个数为:4×4=16,这三种晶胞中的原子的个数比为4:8:16=1:2:4,故答案为:1:2:4;
【小问6详解】
①工业由粗硅制高纯硅是用粗硅先与Cl2反应生成SiCl4,再用H2还原SiCl4,其涉及的化学方程式为:Si+2Cl2SiCl4、SiCl4+2H2Si+4HCl,故答案为:Si+2Cl2SiCl4、SiCl4+2H2Si+4HCl;
②由题干原电池装置图可知,该原电池中Al作负极,Al失电子、发生氧化反应生成铝离子;多孔碳电极作正极,CO2得到电子、发生还原反应生成,氧气在第一个反应中作反应物、在第二个反应中作生成物,即正极反应式第一步为:6O2+6e-=6,第二步为:6CO2+6=3+6O2,所以O2反应前后质量、化学性质不变,是催化剂,电池总反应为2Al+6CO2═Al2(C2O4)3,据此分析解题:
A.该电池的使用是能将CO2转化为,实现变废为宝,故可有效利用,A正确;
B.由分析可知,电池工作时,Al为负极,多孔电极为正极,故电流从多孔碳电极流向铝电极,B错误;
C.正极上发生还原反应,其正极反应式第一步为:6O2+6e-=6,第二步为:6CO2+6=3+6O2,即在第一个反应中作反应物、在第二个反应中作生成物,所以氧气在反应中作催化剂,C正确;
D.已知AlCl3是共价化合物,熔融态的不导电,故含的离子液体不是熔融态的,D错误;
故答案为:AC。
14. 斑蝥素(G)具有良好的抗肿瘤活性,其一种合成路线如下:
已知:Ⅰ.
Ⅱ.
回答下列问题:
(1)A中含氧官能团的名称是_______,B的分子式为_______。
(2)②的反应类型是_______。
(3)反应③的化学方程式为_______。
(4)E的结构简式为_______。
(5)碳原子上连有4个不同的原子或原子团时,该碳原子称为手性碳原子。F中有_______个手性碳原子。
(6)芳香化合物W是G的同分异构体,写出满足下列条件的W的结构简式:_______。
①能发生银镜反应
②能与:溶液发生显色反应
③能发生水解反应,且酸性条件下两种水解产物的核磁共振氢谱均只有2组峰
(7)设计以丙烯醛、1,3—丁二烯为起始原料制备的合成路线:_______(其他试剂任用)。
【答案】(1) ①. 酮羰基和酯基 ②. C7H9NO3
(2)消去反应 (3)+ 3H2O+CH3OH+NH3
(4) (5)4
(6) (7)CH2=CHCH=CH2
【解析】
【分析】由E的分子式、F的结构简式,可知E与发生加成反应生成F,推知E为 ,F脱硫形成2个甲基得到G;A中羰基与HCN发生加成反应生成B,B分子内脱下1分子水生成C,C→D发生信息I中反应引入-COOH、同时酯基水解,D分子内脱下1分子水生成E,推知C为、D为;(7)与CH2=CHCHO发生加成反应生成,再与HCN发生加成反应生成,最后在酸性条件下水解生成,由此分析解题。
【小问1详解】
由题干合成流程图中A的结构简式可知,A中含氧官能团的名称是酮羰基和酯基,由B的结构简式可知B分子式为C7H9NO3,故答案为:酮羰基和酯基;C7H9NO3;
【小问2详解】
由题干合成流程图中B、C结构简式可知②的反应过程中分子内脱去1分子水形成碳碳双键,该反应类型是消去反应,故答案为:消去反应;
【小问3详解】
由题干合成流程图可知,反应③即C在HCl的水溶液中发生水解反应生成D和NH4Cl、CH3OH,则该反应的化学方程式为+3H2O +CH3OH+NH3,故答案为:+ 3H2O+CH3OH+NH3;
【小问4详解】
由分析可知,E的结构简式为,故答案为:;
小问5详解】
碳原子上连有4个不同的原子或原子团时,该碳原子称为手性碳原子。F中有4个手性碳原子,如图所示:,故答案为:4;
【小问6详解】
由题干合成流线图可知,G的分子式为:C10H12O4,则芳香化合物W是G的同分异构体,且满足下列条件①能发生银镜反应即含有醛基或甲酸酯基,②能与:溶液发生显色反应即含有酚羟基,③能发生水解反应即含有酯基,且酸性条件下两种水解产物的核磁共振氢谱均只有2组峰,则W的结构简式为: ,故答案为:;
【小问7详解】
与CH2=CHCHO发生加成反应生成,再与HCN发生加成反应生成,最后在酸性条件下水解生成,据此分析确定合成路线为:CH2=CHCH=CH2 ,故答案为:CH2=CHCH=CH2 。
15. FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检查装置的气密性;②通入干燥的Cl2,赶尽装置中的空气;③用酒精灯在铁屑下方加热至反应完成;④…… ⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为___________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是___________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)___________。
(4)装置B中的冷水作用为___________;装置C的名称为___________;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:___________。
(5)在虚线框内画出尾气吸收装置E并注明试剂______
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为___________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应为___________。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;②___________。
【答案】(1)2Fe+3Cl2 2FeCl3
(2)在沉积的FeCl3固体下方加热
(3)②⑤ (4) ①. 冷却,使FeCl3沉积,便于收集产品 ②. 干燥管 ③. K3[Fe(CN)6]
(5) (6)2Fe3++H2S=2Fe2++S↓+2H+
(7)Fe2+-e-=Fe3+
(8)FeCl3得到了循环利用
【解析】
【小问1详解】
铁与氯气在点燃或加热的条件下发生反应生成氯化铁,其化学方程式为:2Fe+3Cl2 2FeCl3;
【小问2详解】
从题干信息“FeCl3易升华”来看,在沉积的FeCl3固体下方加热可将其转化为气态,再在气流作用下,带入B中使其凝华;
【小问3详解】
装置干燥,通入的气体干燥均可防止其潮解,故步骤中②⑤合题意;
【小问4详解】
水浴作用是使进入B中凝华,即:冷却,使FeCl3沉积,便于收集产品;C为干燥管;是否失效就是要检验Fe2+还有无,最佳试剂为K3[Fe(CN)6],未失效则会发生:3Fe2++2[Fe(CN)6]3-= Fe3[Fe(CN)6]2↓(蓝色沉淀);
【小问5详解】
氯气为酸性气体,所以过量Cl2用NaOH溶液吸收;
【小问6详解】
Fe3+会与H2S发生氧化还原反应,生成亚铁离子与硫单质和氢离子,其离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+;
【小问7详解】
因还原性:Fe2+大于Cl-,故不产生Cl2,应为:Fe2+-e-=Fe3+
【小问8详解】
总的结果是得到了S和H2相当于H2S的分解,FeCl3未被消耗,起到了循环利用的作用。
16. 氮及其化合物的利用是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。
(1)已知:①
②CO的燃烧热为
若某反应③的平衡常数表达式为,请写出反应③的热化学方程式:_______。
(2)欲研究在某催化剂作用下反应③的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间该反应的正反应速率如图所示,A、B两点对应温度下正反应速率变化的原因可能是_______。
(3)将NO和CO以一定的流速通过两种不同的催化剂(、)进行反应,相同时间内测得的脱氮率(脱氮率即NO的转化率)如图所示。M点_______(填“是”或“不是”)对应温度下的平衡脱氮率,理由是_______。
(4)通过传感器可监测的含量,其工作原理如图。
①Pt电极上发生的是_______反应(填“氧化”或“还原”)。
②写出NiO电极上的电极反应式:_______。
(5)某温度下,在一密闭容器中充入一定量发生反应 ,其正反应速率表达式为(为速率常数,只与温度有关),测得反应速率和NO浓度的数据如表所示。
序号
①
0.10
②
0.20
③
0.30
则_______;下列对于该反应的说法正确的是_______(填标号)。
A.当混合气体颜色保持不变时,反应达到化学平衡状态
B.当的比值保持不变时,反应达到化学平衡状态
C.反应达到化学平衡状态时,每消耗0.1mol NO就会消耗0.05mol
D.反应达到平衡状态后,若降低温度,则混合气体的颜色变浅
E.反应达到平衡状态后,若增大容积,则混合气体的平均相对分子质量减小
【答案】(1)2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-746.5 kJ•mol-1
(2)温度过高时催化剂的催化活性降低
(3) ①. 不是 ②. 该反应为放热反应,温度降低,平衡正向移动,平衡脱氮率比温度高时的大,根据cat 2对应曲线可知,M点对应温度的平衡脱氮率应该更高
(4) ①. 还原 ②. NO+O2--2e-=NO2
(5) ①. 4.00×10-5 ②. ACE
【解析】
【小问1详解】
某反应的平衡常数表达式为K=,则反应的化学方程式为2CO(g)+2NO(g)=N2(g)+2CO2(g),①N2(g)+O2(g)2NO(g),②CO(g)+O2(g)═CO2(g)ΔH2=-283.0kJ•mol-1,根据盖斯定律:②×2-①计算反应2CO(g)+2NO(g)=N2(g)+2CO2(g)的焓变ΔH=-283.0kJ•mol-1×2-(+180.5kJ•mol-1)=-746.5 kJ•mol-1,故答案为:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-746.5 kJ•mol-1;
【小问2详解】
一般而言,升高温度,反应速率会加快,但图中A→B的过程中,随着温度升高,正反应速率在不断减小,可能原因是温度过高,催化剂失去活性,导致反应速率降低,故答案为:温度过高时催化剂的催化活性降低;
【小问3详解】
由图可知M点不是对应温度下的平衡脱氮率,对于曲线cat2而言,M点时反应没有达到平衡状态(450℃左右达到平衡),同时该反应正向为放热反应,根据曲线cat2可知,M点对温度的平衡脱氮率应该高于M点的脱氮率,故答案为:不是;该反应为放热反应,温度降低,平衡正向移动,平衡脱氮率比温度高时的大,根据cat 2对应曲线可知,M点对应温度的平衡脱氮率应该更高;
【小问4详解】
①由图可知,Pt电极上O2发生得电子的还原反应生成O2-,故答案为:还原;
②由图可知,NiO电极上NO发生失电子的反应生成NO2,作负极,负极反应式为NO+O2--2e-=NO2,故答案为:NO+O2--2e-=NO2;
【小问5详解】
正=k正•cn(NO),根据表中①②数据可知,c(NO)增大2倍时,正增大16倍,即正与c4(NO)成正比,则n=4,代入实验①中得到正=k正•cn(NO)=4.00×10-9=k正•(0.10)4,k正=4.00×10-5;正反应4NO(g)N2(g)+2NO2(g)是气体体积减小的放热反应,NO2为红棕色气体,则
A.NO2为红棕色气体,当混合气体颜色保持不变时,各物质浓度不变,反应达到化学平衡状态,A正确;
B.反应中的比值始终为2不变,则的比值保持不变的状态不一定是平衡状态,B错误;
C.反应达到化学平衡状态时正(NO)=2逆(NO2),即每消耗0.1molNO就会消耗0.05molNO2,C正确;
D.正反应4NO(g)⇌N2(g)+2NO2(g)是放热反应,反应达到平衡状态后,若降低温度,平衡正向移动,则混合气体的颜色变深,D错误;
E.正反应4NO(g)⇌N2(g)+2NO2(g)是气体体积减小的反应,反应达到平衡状态后,若增大容器体积即减小压强,平衡逆向移动,混合气体的质量不变,气体的物质的量增大,则混合气体的平均相对分子质量减小,E正确;
故答案为:4.00×10-5;ACE。
2024天津市耀华中学高三上学期开学检测化学试题含答案: 这是一份2024天津市耀华中学高三上学期开学检测化学试题含答案,共8页。
天津市耀华中学2023届高三第一次统练化学试题: 这是一份天津市耀华中学2023届高三第一次统练化学试题,共17页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
2022天津市耀华中学高三上学期第三次月考化学试题含答案: 这是一份2022天津市耀华中学高三上学期第三次月考化学试题含答案,文件包含天津市耀华中学2022届高三学期第三次月考化学试题含答案docx、天津市耀华中学2022届高三学期第三次月考化学试题docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。












