





高中第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型教学课件ppt
展开学习任务一 共价晶体的结构和性质任务驱动: 怎样从原子结构角度理解金刚石、硅和锗的熔点和硬度依次下降?
1.共价晶体的结构特点(1)构成微粒及作用力 (2)空间构型:整块晶体是一个三维的共价键_____结构,不存在_____的小分子,是一个“巨分子”。
2.共价晶体与物质的类别
3.共价晶体的熔、沸点(1)共价晶体由于原子间以较强的共价键相结合,熔化时必需破坏共价键,而破坏它们需要很高的温度,所以共价晶体具有_____的熔点。(2)结构相似的共价晶体,原子半径越___,键长越___,键能越___,晶体的熔点越___。【想一想】含有共价键的晶体都是共价晶体吗?提示:共价晶体中都有共价键,但含有共价键的不一定是共价晶体。如CO2、H2O等分子晶体中也含有共价键。
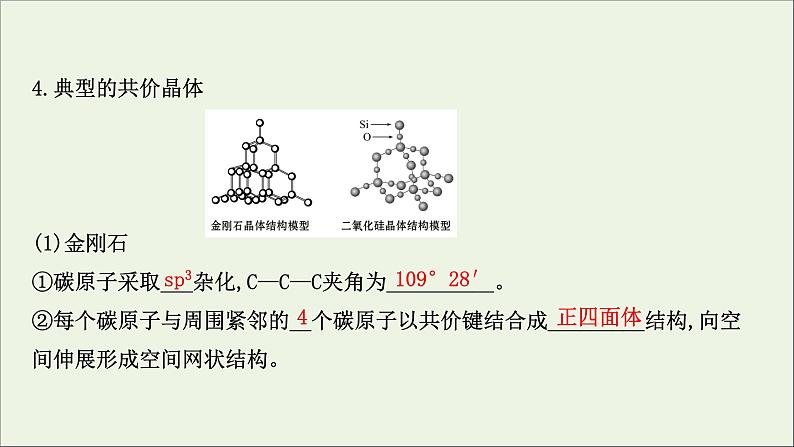
4.典型的共价晶体 (1)金刚石①碳原子采取___杂化,C—C—C夹角为__________。②每个碳原子与周围紧邻的__个碳原子以共价键结合成_________结构,向空间伸展形成空间网状结构。
③最小碳环由__个碳原子组成,且最小环上有4个碳原子在同一平面内;每个碳原子被12个六元环共用。(2)晶体硅把金刚石中的C原子换成Si原子,得到晶体硅的结构,不同的是Si—Si键长__C—C键长。
(3)二氧化硅晶体①Si原子采取___杂化,正四面体内O—Si—O键角为__________。②每个Si原子与__个O原子形成__个共价键,___原子位于正四面体的中心,__原子位于正四面体的顶点,同时每个O原子被__个硅氧正四面体共用;每个O原子和__个Si原子形成__个共价键,晶体中Si原子与O原子个数比为_____。③最小环上有___个原子,包括__个O原子和__个Si原子。
【想一想】(1)SiO2是二氧化硅的分子式吗?提示:不是。二氧化硅为共价晶体,晶体中不存在单个分子,其化学式为Si与O的最简个数比,而不是分子式。(2)在SiC晶体中,最小的环上有几个原子?1 ml SiO2中含有Si—O键的物质的量是多少?提示:在SiC晶体中,最小的环上有6个原子,其中有3个硅原子,3个碳原子;在1 ml SiO2中含4 ml Si—O键。
学习任务二 分子晶体的结构与物质类别任务驱动: 我们知道冰容易熔化,干冰容易汽化,碘晶体容易升华,你知道这些晶体为什么具有上述的特殊性质吗?它们的结构是怎样的呢? 1.分子晶体的结构特点(1)构成微粒及作用力
2.分子晶体的物理性质(1)分子间以___________________相结合,分子晶体熔化时克服______________,不破坏共价键,一般具有_____的熔点、沸点和_____的硬度,_____的挥发性。(2)组成和结构相似,晶体中不含氢键的物质,相对分子质量越大,分子间作用力越___,熔、沸点越___。
3.分子晶体与物质的类别
4.三种典型的分子晶体的组成和结构(1)碘晶体 ①碘晶体的晶胞是一个长方体,在它的_________________各有1个I2分子,每个晶胞中有__个I2分子。②I2分子之间以_________结合。
(2)干冰晶体 ①干冰中的CO2分子间只存在_________,不存在_____。②每个晶胞中有__个CO2分子,___个原子;每个CO2分子周围等距离紧邻的CO2分子数为___个。③干冰晶体中分子之间通过_________相结合,熔化时分子内的化学键_______。
(3)冰晶体 ①水分子之间的主要作用力是_____,当然也存在_________。②_____有方向性,它的存在迫使在___________的水分子与___________方向的__个相邻水分子互相吸引。
【想一想】 (1)晶体冰中水分子和氢键数目有什么关系?提示:晶体冰中每个水分子可以与紧邻的4个水分子形成氢键(不是2个);每个水分子平均形成2个氢键(不是4个)。(2)为什么说冰晶胞的结构和金刚石的晶胞结构相似?提示:冰晶胞的结构和金刚石的晶胞结构相似,每个晶胞平均拥有8个水分子。晶体中C、O均采用sp3杂化,均与4个其他原子形成四面体结构单元,因此,冰晶胞的结构与金刚石的晶胞结构有一定的相似性。
学习任务三 晶体结构的复杂性任务驱动:石墨同层中所有碳原子都以共价键相连,构成平面网状结构,这类似共价晶体的结构特点,层与层之间有范德华力相连,这类似于分子晶体,石墨中有自由电子,能导电,这又类似于金属晶体,那么石墨属于什么晶体?
【想一想】(1)石墨晶体为什么具有导电性?提示:石墨晶体中每个C原子未参与杂化的轨道中含有1个未成对电子,能形成遍及整个平面的大π键,由于电子可以在整个六边形网状平面上运动,因此石墨沿平行的层能导电。(2)稀有气体由单原子构成,它属于共价晶体吗?提示:不是,它属于分子晶体。
(3)石墨为什么很软?提示:石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。(4)石墨的熔沸点为什么很高(高于金刚石)?提示:原因之一:石墨各层均为平面网状结构,碳原子之间既有C—C键又有大π键,故熔沸点很高。由于金刚石内只有C—C键没有大π键,所以石墨的熔点高于金刚石。
3.结构复杂的晶体——硅酸钠晶体
探究任务一 四种晶体类型的比较【图片情境】如图为晶体结构模型:
【问题探究】1.观察金刚石和二氧化硅的结构模型讨论:1 ml C组成的金刚石中含有多少摩尔C—C键?1 ml SiO2晶体中含有多少摩尔Si—O键?金刚石晶体中C原子数目与C—C键数目之比为多少?提示:2,4,1∶2。在金刚石晶体中,1个C原子与4个C原子形成4个C—C键,而每2个C原子之间才形成一个键,所以1 ml C形成的C—C键个数为4× ml=2 ml,金刚石晶体中C原子个数与C—C键数之比为1∶2。SiO2晶体结构相当于将金刚石中的C原子全都改换为Si原子,同时在Si—Si键中间增添一个O原子,所以1 ml SiO2晶体中含有4 ml Si—O键。
2.为什么共价晶体结构比金属晶体和离子晶体结构松散,但却比金属晶体和离子晶体有更强的稳定性?提示:共价键具有方向性和饱和性,使共价晶体中某个原子周围结合的其他原子是有限的,因此比较松散。由于整个晶体中各原子都以强作用力共价键相互结合,且构成了空间网状结构,所以共价晶体更稳定。3.所有分子晶体中是否均存在化学键?提示:不是。绝大多数分子晶体的微粒内部都存在化学键,如N2、H2O、SO2等分子内部都有共价键,而稀有气体为单原子分子,分子内部无化学键,分子之间以范德华力结合,所以并非所有分子晶体的分子内部都存在化学键。
4.为什么液态水变为冰时,体积膨胀,密度减小? 提示:冰晶体中主要是水分子依靠氢键而形成的,因氢键具有一定的方向性,使水分子间的间距比较大,有很大空隙,比较松散。所以水结成冰后,体积膨胀,密度减小。
【探究总结】1.四种晶体类型的组成与性质比较
2.四种晶体的结构特征(1)离子晶体的结构特征①离子键无方向性和饱和性,在离子晶体中阴、阳离子与异电性离子接触尽可能采用最密堆积,可以看作是不等径圆球密堆积。②构成微粒:阴离子和阳离子,离子晶体中不存在单个分子。(2)金属晶体的结构特征由于自由电子为整个金属所共有,所以金属键没有方向性和饱和性,从而导致金属晶体最常见的结构型式具有堆积密度大,原子配位数高,能充分利用空间等特点。
(3)共价晶体的结构特征①在共价晶体中,各原子均以共价键结合,因为共价键有方向性和饱和性,所以中心原子周围的原子数目是有限的,原子不采取密堆积方式。②共价晶体的组成微粒是原子,不存在单个分子,其化学式仅代表原子的个数比。③空间构型:空间网状结构。
(4)分子晶体的结构特征①分子间不存在氢键的分子晶体,由于范德华力没有方向性和饱和性,所以分子尽可能采取密堆积方式。②分子间存在氢键的分子晶体,由于氢键具有方向性和饱和性,所以分子不能采取密堆积方式。
【探究训练】 下表列举了几种物质的性质,据此判断属于分子晶体的是____________。
【解题指南】(1)共价晶体的熔、沸点不一定高于金属晶体和离子晶体。如MgO(2 800 ℃)>SiO2(1 713 ℃)、钨(3 410 ℃)>SiO2(1 713 ℃)。(2)平面网状结构的晶体不属于共价晶体。(3)共价晶体中只存在共价键,不存在离子键和范德华力。(4)稀有气体原子组成的晶体不是共价晶体。【解析】分子晶体熔、沸点一般比较低,硬度较小,固态不导电。所有在常温下呈气态、液态的物质(除汞外)、易升华的固体物质都属于分子晶体。M的熔点高,肯定不是分子晶体;N是金属钠的性质;其余X、Y、Z、W均为分子晶体。答案:X、Y、Z、W
探究任务二 四种晶体的熔、沸点比较【科学情境】 科学研究表明,约30亿年前,在地壳下200 km左右的地幔中处在高温、高压岩浆中的碳元素,逐渐形成了具有正四面体结构的金刚石。火山爆发时,金刚石夹在岩浆中上升到接近地表时冷却,形成含有少量金刚石的原生矿床。金刚石具有诸多不同凡响的优良性质:熔点高(>3 500 ℃),不导电,硬度极高。而干冰容易气化,碘晶体容易升华。
【问题探究】1.分子晶体和共价晶体的构成微粒相同吗?提示:不同。分子晶体为分子,共价晶体为原子。2.分子晶体和共价晶体受热熔化时克服微粒间作用力相同吗?提示:不同,前者为分子间作用力,后者为共价键。3. 一般情况下分子晶体的熔点为什么比离子晶体和共价晶体低?
提示:原子、离子晶体的微粒通过化学键构成,所以熔点高、硬度大;而分子晶体则是通过分子间作用力构成,熔化时,破坏的只是分子间作用力,分子内的化学键并未破坏,故分子晶体的熔点通常较低。
【探究总结】晶体熔、沸点高低的比较1.晶体类型不同一般为共价晶体>离子晶体>分子晶体。金属晶体的熔、沸点有的很高(如钨),有的很低(如汞)。理由:共价晶体的熔、沸点与共价键有关,离子晶体的熔、沸点与离子键有关,金属晶体的熔、沸点与金属键有关,分子晶体的熔、沸点与分子间作用力有关。化学键的作用力远大于分子间作用力。
2.晶体类型相同(1)共价晶体一般来说,对结构相似的共价晶体来说,键长越短,键能越大,晶体的熔、沸点越高。例如:金刚石(C—C)>二氧化硅(Si—O)>碳化硅(Si—C)>晶体硅(Si—Si)。(2)离子晶体离子所带电荷越多,离子半径越小,则离子键越强,熔、沸点越高。如熔点:MgO>NaCl>CsCl。
(3)金属晶体金属原子的价电子数越多,半径越小,金属键越强,熔、沸点越高。如熔点:Al>Mg>Na。(4)分子晶体①若分子间有氢键,则分子间作用力比结构相似的同类晶体大,故熔、沸点较高。如HF>HI;NH3>PH3;H2O>H2Te。②组成和结构相似的分子晶体,一般相对分子质量越大,范德华力越大,熔、沸点越高。如I2>Br2>Cl2>F2;SnH4>GeH4>SiH4>CH4。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,范德华力越大,熔、沸点越高。如CO>N2。④同类别的同分异构体,支链越多,熔、沸点越低。如正戊烷>异戊烷>新戊烷。⑤状态不同的物质在相同条件下,熔、沸点:固体>液体>气体。例如:S>Hg>O2。
【典例】化学探究小组根据指导教师的要求查阅资料,列出了下表中物质的熔点,回答有关问题。
(1)卤化钠及碱金属的氯化物的熔点与卤离子及碱金属离子的________有关,随着________的增大,熔点依次降低。 (2)硅的卤化物熔点及硅、锗、锡、铅的氯化物的熔点与________有关,随着________的增大,________增大,故熔、沸点依次升高。 (3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与________有关,因为一般________比________熔点高。
【解题指南】晶体熔、沸点比较的两个“首先”(1)晶体熔、沸点比较时应先分析晶体类型。(2)分子晶体熔、沸点比较时应先判断分子间是否存在氢键。【解析】分析表中物质及熔点规律,将物质晶体类型合理分类,由同类晶型熔点变化趋势发现影响物质熔点高低的规律。答案:(1)半径 半径 (2)相对分子质量 相对分子质量 分子间作用力 (3)晶体类型 离子晶体 分子晶体
【易错提醒】(1)某些离子晶体的熔点高于某些共价晶体的熔点。 (2)某些分子晶体的熔点高于某些金属晶体的熔点。如碱金属熔点较低。(3)个别金属的熔点高于某些共价晶体的熔点。如钨(3 410 ℃)> SiO2(1 713 ℃)。(4)合金的熔点一般低于成分金属的熔点。
【探究训练】1.透明高硬度防弹铝材料(化学式为AlON)硬度为石英玻璃的4倍。氮氧化铝(AlON)属共价晶体,是一种超强透明材料。下列描述错误的是( )A.AlON和石英的化学键类型相同B.AlON和石英晶体类型相同C.AlON和Al2O3的化学键类型不同D.AlON和Al2O3晶体类型相同
【解析】选D。AlON与石英(SiO2)均为共价晶体,所含化学键均为共价键,故A、B项正确;Al2O3是离子晶体,晶体中含离子键,不含共价键,故C项正确、D项错误。
2.(2020·日照高二检测)下列关于物质熔点的排列顺序,不正确的是( )A.HI>HBr>HCl>HFB.CI4>CBr4>CCl4>CF4C.NaCl>NaBr>KBrD.金刚石>碳化硅>晶体硅【解析】选A。A中为分子晶体,但由于HF分子间存在氢键,故HF的熔点出现反常,错误;B中也为分子晶体,按相对分子质量由大到小排列,正确;C中为离子晶体,离子半径r(Cl-)
3.(2020·潍坊高二检测)下表是某些共价晶体的熔点和硬度:分析表中的数据,判断下列叙述正确的是( )①构成共价晶体的原子种类越多,晶体的熔点越高 ②构成共价晶体的原子间的共价键键能越大,晶体的熔点越高 ③构成共价晶体的原子的半径越大,晶体的硬度越大 ④构成共价晶体的原子的半径越小,晶体的硬度越大A.①② B.③④C.①③ D.②④
【解析】选D。共价晶体的熔点和硬度与构成共价晶体的原子间的共价键键能有关,而原子间的共价键键能与原子半径的大小有关。
1.(2020·青岛高二检测)将SiCl4与过量的液氨反应可生成化合物Si(NH2)4。将该化合物在无氧条件下高温灼烧,可得到氮化硅(Si3N4)固体,氮化硅是一种新型的耐高温、耐磨材料,在工业上有广泛的应用。氮化硅所属的晶体类型是( )A.共价晶体B.分子晶体C.离子晶体D.金属晶体【解析】选A。根据氮化硅(Si3N4)的元素组成,可判断它不可能为离子晶体和金属晶体;根据氮化硅的性质,可判断它不可能是分子晶体。
2.(2020·德州高二检测)下列物质的熔点、沸点高低顺序中,正确的是( )A.金刚石>晶体硅>二氧化硅>碳化硅B.CI4>CBr4>CCl4>CH4C.MgO>H2O>N2>O2D.金刚石>生铁>纯铁>钠【解析】选B。对于A选项,同属于共价晶体,熔点、沸点高低主要看共价键的强弱,显然对键能而言,晶体硅<碳化硅,错误;B选项,同为组成结构相似的分子晶体,熔点、沸点高低要看相对分子质量大小,正确;C选项,对于不同晶型,熔点高低一般为共价晶体>离子晶体>分子晶体,MgO>(H2O、O2、N2),又H2O>O2>N2,错误;D选项,生铁为铁合金,熔点要低于纯铁,错误。
3.(2020·南京高二检测)科学家用激光将置于铁室中石墨靶上的碳原子炸松,与此同时再用射频电火花喷射氮气,此时碳、氮原子结合成碳氮化合物薄膜。据称,这种化合物可能比金刚石更坚硬。其原因可能是 ( )A.碳、氮原子构成平面结构的晶体B.碳氮键键长比金刚石中的碳碳键键长更短C.氮原子电子数比碳原子电子数多D.碳、氮单质的化学性质均不活泼
【解析】选B。由“这种化合物可能比金刚石更坚硬”可知,该晶体应该是一种共价晶体,共价晶体的结构是一种空间网状结构而不是平面结构,A选项错误;氮原子的半径比碳原子的半径小,二者所形成的共价键的键长要比碳碳键的键长短,所以该晶体的硬度应该比金刚石更高,B选项正确;原子的电子数和单质的活泼性一般不会影响所形成的晶体的硬度等,所以C、D选项错误。
4.(2020·福州高二检测)德、俄两国化学家共同宣布,在高压下氮气会发生聚合得到一种低熔点物质——高聚氮,这种高聚氮的N—N键比N2分子中的N≡N键要弱得多,其晶体结构如图所示。下列有关高聚氮的说法正确的是( )A.高聚氮晶体属于共价晶体B.高聚氮晶体中每个氮原子和另外3个氮原子相连C.高聚氮属于高分子化合物D.高聚氮转变成氮气是氧化还原反应
【解析】选B。由题中信息,N—N键要比N≡N键弱得多,且高聚氮的熔点较低,说明高聚氮不是共价晶体;而高分子化合物一般是针对有机物而言,且高聚氮的相对分子质量也不够大,故不是高分子化合物;因高聚氮只含氮元素,转变为N2,化合价不变,故不属于氧化还原反应;由结构知每个氮原子和另外3个氮原子相连。
5.(双选)科学家成功地在高压下将CO2转化为具有类似SiO2结构的共价晶体,下列关于CO2的共价晶体说法正确的是( )A.CO2的共价晶体和分子晶体互为同素异形体B.在一定条件下,CO2共价晶体转化为分子晶体是化学变化C.CO2的共价晶体和CO2的分子晶体具有相同的物理性质D.在CO2的共价晶体中,每个C原子周围结合4个O原子,每个O原子与两个C原子相结合【解析】选B、D。同素异形体的研究对象是单质;CO2的晶体类型的转变已生成了新物质,故为化学变化;CO2的不同晶体具有不同的物理性质。CO2的共价晶体类似于SiO2晶体,每个C原子结合4个O原子,每个O原子结合2个C原子。
6.(2020·青岛高二检测)HN3称为叠氮酸,常温下为无色有刺激性气味的液体, 也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸,而叠氮化钠可从下列反应制得:NaNH2+N2O ==== NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成Cu 。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
(1)基态铜原子核外电子排布式为_______。 (2)元素N、S、P的第一电离能(I1)由大到小的顺序为____________。 (3)HN3属于______晶体, 的空间构型是____________,与 互为等电子体的分子的化学式为________(写1种)。 的电子式为________,其中心原子的杂化类型是__________。 (4)Cu 中的键型为____________,超导氧化物A的化学式为__________。 (5)治癌药物B的结构简式为______________。
【解析】(1)根据铜的原子序数和构造原理可写出:1s22s22p63s23p63d104s1或[Ar]3d104s1。(2)同主族元素,从上到下第一电离能逐渐减小,N和P原子的外层电子构型具有较稳定的p3半满结构,第一电离能比硫的大,则N、S、P的第一电离能(I1)由大到小的顺序为N>P>S。(4)根据晶胞中顶点、面、体心的分配关系,A的化学式为YBa2Cu3O7 。(5)B异构体具有可溶性,说明其为极性分子:
答案:(1)1s22s22p63s23p63d104s1或[Ar]3d104s1(2)N>P>S(3)分子 直线形 CO2(N2O、CS2等) sp3(4)配位键 YBa2Cu3O7(5)
7.(1)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于__________(填晶体类型)。 三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体类型为__________。 (2)通常人们把拆开1 ml某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱。
请回答下列问题:①比较下列两组物质的熔点高低(填“>”或“<”)。SiC____________Si;SiCl4____________SiO2。 ②如图立方体中心的“ ”表示硅晶体中的一个原子,请在立方体的顶点用“ ”表示出与之紧邻的硅原子。
【解析】(1)由于分子间作用力很弱,分子晶体汽化或熔融时,只需克服分子间的作用力,不破坏化学键,所以分子晶体一般具有较低的熔点和沸点,较小的硬度,易升华,有较强的挥发性等特点。(2)SiC和晶体Si皆为共价晶体,由于碳化硅晶体中的Si—C键的键能大于硅晶体中Si—Si键的键能,故SiC的熔点比Si高;SiCl4为分子晶体,SiO2为共价晶体,故SiCl4的熔点比SiO2低。晶体硅的结构与金刚石相似,每个硅原子都被相邻的4个硅原子包围,这4个硅原子位于四面体的四个顶点上,被包围的硅原子处于正四面体的中心。
鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型教学ppt课件: 这是一份鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型教学ppt课件,共60页。PPT课件主要包含了NO1,NO2,NO3,点击右图进入等内容,欢迎下载使用。
鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型教学课件ppt: 这是一份鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型教学课件ppt,共29页。
高中化学第2节 几种简单的晶体结构模型教学ppt课件: 这是一份高中化学第2节 几种简单的晶体结构模型教学ppt课件,共51页。PPT课件主要包含了课前自主学习,概念及物理性质,金属原子,金属键,金属阳离子,自由电子,阳离子和阴离子,离子键,阴离子,晶格能等内容,欢迎下载使用。













