






化学鲁科版选择性必修2同步教学课件第3章 不同聚集状态的物质与性质 阶段复习课
展开
这是一份化学鲁科版选择性必修2同步教学课件第3章 不同聚集状态的物质与性质 阶段复习课,共26页。
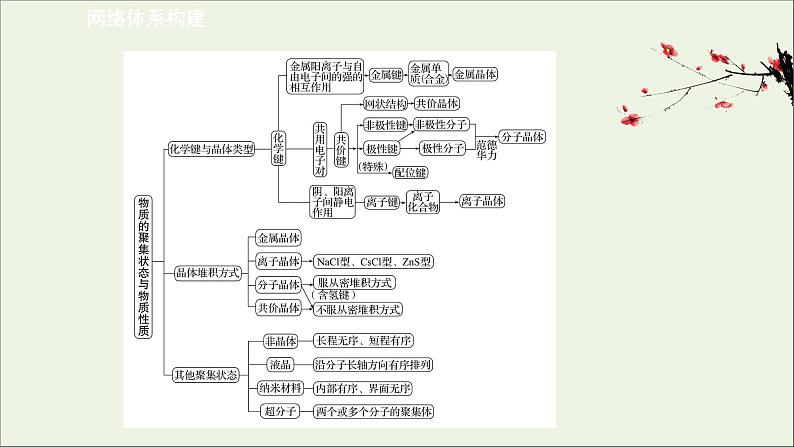
阶段复习课 第3章 网络体系构建【基础回扣】一、晶体类型的判断方法1.依据物质的分类判断(1)金属氧化物(如K2O等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体。(2)金属单质(除汞外)与合金是金属晶体。(3)常见的共价晶体单质有金刚石、晶体硅、晶体硼等;常见的共价晶体化合物有碳化硅、二氧化硅等。(4)大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)都是分子晶体。2.根据物质的物理性质判断晶体的类型(1)在常温下呈气态或液态的物质,其晶体应属于分子晶体(Hg除外),如H2O、H2等。对于稀有气体,虽然构成物质的微粒为原子,但应看作单原子分子,因为微粒间的相互作用力是范德华力,而非共价键。(2)在熔融状态下能导电的晶体(化合物)是离子晶体。如:NaCl熔融后电离出Na+和Cl-,能自由移动,所以能导电。(3)有较高的熔点,硬度大,并且难溶于水的物质大多为共价晶体,如晶体硅、二氧化硅、金刚石等。(4)易升华的物质大多为分子晶体。3.根据物质所含化学键的类型判断晶体的类型(1)离子晶体与化学键的关系:①离子晶体中一定含有离子键,可能含有共价键。注意,可以再细化:离子晶体中一定含有离子键,可能含有极性共价键、非极性共价键、配位键。②含有离子键的化合物一定是离子化合物。③离子晶体一定是由阴、阳离子构成的,但晶体中可以含有分子,如结晶水合物。④离子晶体中一定含有阳离子,但含有阳离子的晶体不一定是离子晶体。(2)分子晶体与分子间作用力及化学键的关系:①分子晶体中一定含有分子间作用力。②稀有气体形成的晶体是分子晶体,而稀有气体是单原子分子,其晶体中只含有分子间作用力。③除稀有气体外的其他分子晶体均含有分子间作用力和分子内共价键。④分子晶体中的分子间作用力决定物质的物理性质(如熔点、硬度、溶解性等),而共价键决定分子的化学性质。(3)共价晶体与化学键的关系:①共价晶体中一定有共价键,且只有共价键,无分子间作用力。②共价晶体一定是由原子构成的,可以是同种元素的原子,也可以是不同种元素的原子。③共价化合物形成的晶体可能是共价晶体,也可能是分子晶体。【易错提醒】判断晶体类型,既可以从结构入手,也可以从物理性质入手:(1)由非金属元素组成的二元化合物不是离子晶体(二元以上未必正确,如NH4Cl、NH4NO3)。(2)熔点在一千摄氏度以下无共价晶体。(3)固态不导电,熔融态导电的是离子晶体。(4)熔点低,能溶于有机溶剂的晶体是分子晶体。(5)金属元素与非金属元素组成的化合物未必都是离子晶体,一般用元素电负性差来判断。组成元素电负性差大于1.7的一般是离子晶体,但不全符合,还与元素化合价有关。二、物质熔、沸点高低的比较首先判断物质的状态:固体>液体>气体,如I2>Hg>O2。1.不同晶型的物质的熔、沸点高低顺序一般是:共价晶体>离子晶体>分子晶体。同一晶型的物质,则晶体内部结构微粒间的作用越强,熔、沸点越高。2.共价晶体要比较共价键的强弱,一般地说,原子半径越小,形成的共价键的键长越短,键能越大,其晶体熔、沸点越高。如熔点:金刚石>碳化硅>晶体硅。键长:C—CSi—Si3.离子晶体要比较离子键的强弱。一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用就越强,其离子晶体的熔、沸点就越高,如熔点: MgO>MgCl2>NaCl>CsCl。4.分子晶体:(1)组成和结构相似的物质,相对分子质量越大,分子间作用力越大,熔、沸点越高,如熔、沸点:O2>N2,HI>HBr>HCl,I2>Br2>Cl2>F2。(2)组成和结构不相似的物质,分子极性越大,其熔、沸点就越高,如熔、沸点:CO>N2。(3)在同分异构体中,一般地说,支链数越多,熔、沸点越低,如熔、沸点:正戊烷>异戊烷>新戊烷;同分异构体的芳香烃及其衍生物,其熔、沸点高低顺序是邻>间>对位化合物。5.金属晶体中金属离子半径越小,离子电荷数越多,其金属阳离子与自由电子间的作用越强,金属熔、沸点就越高。三、晶胞结构及有关简单计算1.熟悉几种常见的晶胞结构及晶胞含有的粒子数目 A.NaCl(含4个Na+,4个Cl-)B.干冰(含4个CO2)C.CaF2(含4个Ca2+,8个F-)D.金刚石(含8个C)E.体心立方(含2个原子)F.面心立方(含4个原子)2.掌握晶胞的基本计算方法(1)晶胞中所含粒子数的计算方法——均摊法原则:晶胞任意位置上的一个粒子如果是被n个晶胞所共有,那么,每个晶胞对这个粒子分得的份额就是 。 (2)计算方法特别注意:①当晶胞为六棱柱时,其顶点上的粒子被6个晶胞共用,每个粒子属于该晶胞的部分为 ;而不是 。②审题时一定要注意是“分子结构”还是“晶体结构”,若是分子结构,其化学式由图中所有实际存在的原子个数决定,原子个数比可以不约简。3.有关晶胞各物理量的关系对于立方晶胞,可简化成下面的公式进行各物理量的计算:a3×ρ×NA=n×M,a表示晶胞的棱长,ρ表示密度,NA表示阿伏加德罗常数,n表示1 mol晶胞中所含粒子的物质的量,M表示摩尔质量,a3×ρ×NA表示1 mol晶胞的质量。如NaCl: a3ρNA=4M(M=58.5)。【易错提醒】(1)判断某种微粒周围等距且紧邻的微粒数目时,要注意运用三维想象法。如NaCl晶体中,Na+周围的Na+数目(Na+用“○”表示): 每个面上有4个,共计12个。(2)常考的几种晶体主要有干冰、冰、金刚石、SiO2、石墨、CsCl、NaCl、K、Cu等,要熟悉以上代表物的空间结构。当题中信息给出与某种晶体空间结构相同时,可以直接套用某种结构。素养应用提升1.(1)一些氧化物的熔点如下表所示:试解释表中氧化物之间熔点差异的原因?提示:Li2O、MgO为离子晶体,P4O6、SO2为分子晶体;晶格能:MgO>Li2O,分子间作用力:P4O6>SO2。(2)如图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因是什么? 提示:S8、二氧化硫形成的晶体均是分子晶体,由于S8相对分子质量大,分子间范德华力强,所以其熔点和沸点要比二氧化硫的熔点和沸点高很多。(3)①四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图所示。 SiX4的沸点按F、Cl、Br、I顺序依次升高的原因是什么? ②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:按F、Cl、Br、I顺序,PbX2中的化学键的离子性和共价性的变化趋势如何?提示:①均为分子晶体,范德华力随相对分子质量增大而增大;②PbX2中的化学键的离子性减弱,共价性增强。(4)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是什么?提示:GaF3为离子晶体,GaCl3为分子晶体。2.经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。 (1)从结构角度分析,R中两种阳离子的相同之处和不同之处是什么?(2)R中阴离子 中的σ键总数有几个?(3)分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则 中的大π键应如何表示?提示:(1)R中两种阳离子分别为 和H3O+, 中原子N含有4个σ键,孤电子对数为(5-1-4×1)/2=0,价层电子对数为4,杂化类型为sp3,空间构型为正四面体形,H3O+中心原子是O,含有3个σ键,孤电子对数为(6-1-3)/2=1,价层电子对数为4,杂化类型为sp3,空间构型为三角锥形,因此它们的共价键类型、中心原子的杂化轨道类型、中心原子的价层电子对数均相同,不同之处是空间构型。(2) 中σ键总数为5个。(3) 的大π键应表示为 。3.采用差紫外谱法研究了新型芳酰胺-吖啶分子钳(1~7)对苯胺、苯二胺(邻、间、对)等中性分子的识别性能。测定了结合常数(Ka)和自由能变化(ΔG),结果表明,所有的分子钳受体与所考查的客体分子均形成1∶1型超分子配合物。识别作用的主要推动力为多重氢键、范德华力等的协同作用。主客体间尺寸/形状匹配、几何互补等因素对识别性能均有重要的影响。上述材料中都涉及了哪些微粒间的相互作用?提示:共价键、配位键、氢键及范德华力。






