





所属成套资源:新人教版化学必修第二册课件PPT全册
- 6.1 化学反应与能量变化(第2课时) (课件)-【备课必备】2022-2023学年高一化学同步优选备课系列(人教版2019必修第二册) 课件 1 次下载
- 6.1 化学反应与能量变化(第3课时) (课件)-【备课必备】2022-2023学年高一化学同步优选备课系列(人教版2019必修第二册) 课件 1 次下载
- 6.2 化学反应速率和限度(第1课时) (课件)-【备课必备】2022-2023学年高一化学同步优选备课系列(人教版2019必修第二册) 课件 1 次下载
- 6.1 化学反应与能量变化(第1课时)(练习)-【备课必备】2022-2023学年高一化学同步优选备课系列(人教版2019必修第二册) 试卷 2 次下载
- 6.1 化学反应与能量变化(第2课时)(练习)-【备课必备】2022-2023学年高一化学同步优选备课系列(人教版2019必修第二册) 试卷 2 次下载
人教版 (2019)必修 第二册第二节 化学反应的速率与限度备课ppt课件
展开
这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度备课ppt课件,共19页。PPT课件主要包含了可逆反应的特点,可逆反应的定义,对点训练1,典型的可逆反应有,微点拨,保持一定,化学平衡的移动,对点训练2,直接标志,①同种物质等内容,欢迎下载使用。
一、化学平衡的研究对象——可逆反应
3、可逆反应的表示方法:可逆反应的化学方程式中,用“ ”号 代替 “===”号
在同一条件下,正反应方向和逆反应方向均能同时进行的化学反应称为可逆反应
(1)反应不能进行到底
(2)在一定条件下反应物与生成物同时存在
(3)正、逆反应方向同时进行
正反应:反应物→生成物
逆反应:生成物→反应物
1、下列反应中,不属于可逆反应的是( )
A.2NO2===N2O4与N2O4===2NO2
B.H2+I2 2HI与2HI H2+I2
C.CO2+H2O===H2CO3与H2CO3===CO2↑+H2O
D.CaO+CO2===CaCO3与CaCO3=====CaO+CO2↑
2、当可逆反应:2SO2+O2 2SO3达到平衡后,通入18O2,再次达到平衡时,18O存在于( )
A.SO3和O2中 B.SO2和SO3中 .SO2、O2和SO3中 D.SO2和O2中
NH3 +H2O NH3 ·H2O
SO2 +H2O H2SO3
启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
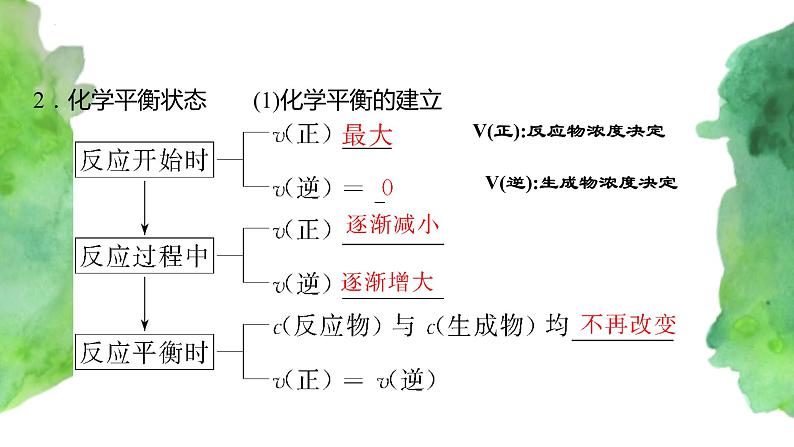
V(正):反应物浓度决定
V(逆):生成物浓度决定
2.化学平衡状态 (1)化学平衡的建立
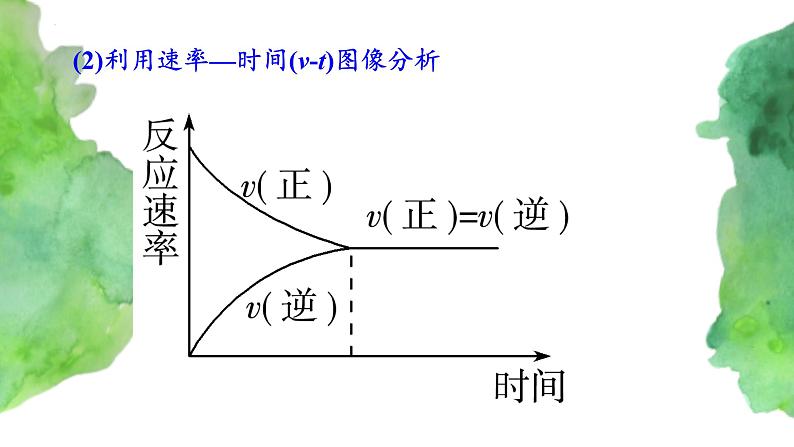
(2)利用速率—时间(vt)图像分析
在一定条件下,当反应进行到一定程度时,正反应速率与逆反应速率相等,反应物的浓度和生成物的浓度都不再改变,达到一种表面静止的状态,称之为化学平衡状态,简称化学平衡
2、化学平衡状态的概念:
②对于可逆反应来说,当处于化学平衡状态时,转化率、产率达到了最大限度
①化学平衡状态是可逆反应在一定条件下所能达到的或完成的最大限度,即该反应进行 的限度。化学反应的限度决定了反应物在该条件下转化为生成物的最大转化率
3、化学平衡状态的特征
平衡时,各物质的转化率(α)、百分含量(w%)、物质的量(n)、物质的质量(m)、物质的量浓度(c)、混合气体的平均摩尔质量()、混合气体的密度(ρ)、压强(P)等所有物理量全部恒定
2、下列说法中不正确的是( )
A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,这个反应的正反应速率和逆反应速率相等
C.可以通过控制反应条件,使2 ml SO2与1 ml O2反应生成2 ml SO3
D.化学反应的限度可以通过改变条件来改变
1、对于可逆反应达到平衡时,下列说法不正确的是( )
A.反应物与生成物的浓度不再改变 B.正反应速率与逆反应速率均为零
C.各物质的组成之比不再改变 D.该条件下的反应物的转化率最大
可逆反应达到平衡状态时主要有以下两个特征:①v正=v逆;②混合物中各组分的百分含量不变(除百分含量外其他在反应过程中变化的量,达到平衡后均不再发生变化,即“变量不变”),以上两个特征可作为判断可逆反应达平衡的标志
二、化学平衡状态的判断方法
(1)正、逆反应速率相等
v正=v逆≠0,v生成=v消耗 或 v断键=v成键
a.两个不同的方向进行
b.速率之比等于化学计量数之比
以mA(g)+nB(g) pC(g)+qD(g)为例
a.对于纯气体参加的可逆反应
①m+n≠p+q时,总压强一定 (其他条件一定)
②m+n=p+q时,总压强一定 (其他条件一定)
(2)各组分的浓度保持一定
①各组分的浓度不随时间的改变而改变
②各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变
① 一定时,只有当m+n≠p+q时
② 一定时,但m+n=p+q时
反应体系内有色物质的颜色一定
恒温恒压时,若m+n≠p+q,则密度一定时
b.对于非纯气体参加的可逆反应
以mA(s)+nB(g) pC(g)+qD(g)为例
①n≠p+q时,总压强一定 (其他条件一定)
②n=p+q时,总压强一定 (其他条件一定)
① 一定时,只有当n≠p+q时
② 一定时,但n=p+q时
①对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等则一定处于平衡状态
②对绝热密闭容器,温度保持不变则一定处于平衡状态
③若反应中有固体或液体,平均相对分子质量一定、密度一定则一定处于平衡状态
例题 可逆反应2NO2(g) 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n ml O2的同时生成2n ml NO2
②单位时间内生成n ml O2的同时生成2n ml NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
三、“三段式”突破平衡转化率和物质百分含量的计算
mA(g)+nB(g) pC(g)+qD(g)起始/ml a b 0 0转化/ml mx nx px qx平衡/ml a-mx b-nx px qx
气体体积分数(物质的量分数):
四、化学反应条件的控制
1、化学反应条件的控制
(1)目的
①促进有利的化学反应,提高原料的利用率,加快反应速率
②控制有害的化学反应,减小甚至消除有害物质的产生,控制副反应的发生
(2)基本措施
①改变化学反应速率:改变反应物的温度、溶液中溶质的浓度、气体压强(或浓度)、固体表面积以及催化剂的合理使用等
②改变可逆反应进行的限度:改变可逆反应体系的温度、溶液中溶质的浓度、气体压强(或浓度)等
(3)考虑因素:控制反应条件的成本和实际可能性
2、提高煤的燃烧效率问题探究
(1)煤燃烧时,将煤块粉碎成煤粉的依据是接触面积增大(2)选择保温隔热且耐热的炉(灶)膛材料的主要目的是防止热量散失
(3)充分利用煤燃烧后的废气中的热量可采取的措施是将燃烧后的废气通过交换装置,供其他方面使用
3、提高燃料的燃烧效率的措施
(1)尽可能使燃料充分燃烧,提高能量的转化率。(2)尽可能充分利用燃料燃烧所释放出的热能,提高热能的利用率
4、提高燃料的燃烧效率的意义在于节约能源、节省资源、减少污染
相关课件
这是一份高中化学人教版 (2019)必修 第二册实验活动9 乙醇、乙酸的主要性质备课课件ppt,共21页。PPT课件主要包含了分子式,C2H4O2,结构简式,结构式,官能团,乙酸的结构,乙酸的物理性质,NaHCO3,澄清石灰水,探究乙酸的弱酸性等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第七章 有机化合物实验活动9 乙醇、乙酸的主要性质备课课件ppt,共20页。PPT课件主要包含了烃的衍生物,对点训练1,物理性质,对点训练2,乙醇的化学性质,实验现象,实验结论,微点拨,乙醇的氧化反应,①实验探究等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度备课ppt课件,共23页。PPT课件主要包含了化学反应速率,对点训练1,反应的转化率α,恒容时,恒压时,实验2-6等内容,欢迎下载使用。










