




2020-2021学年第二节 氮及其化合物备课课件ppt
展开
这是一份2020-2021学年第二节 氮及其化合物备课课件ppt,共19页。PPT课件主要包含了自主学习,第VA族,氮分子N2,蛋白质,硝酸盐,氮气的物理性质,很稳定,工业合成氨,N2的制法,自主检测等内容,欢迎下载使用。
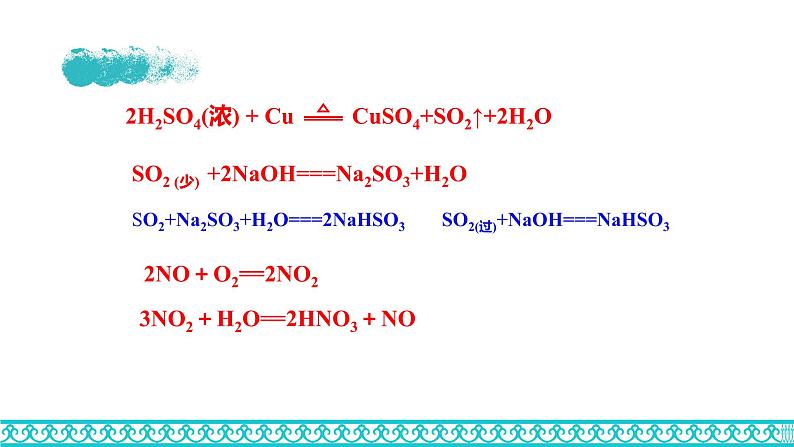
SO2 (少) +2NaOH===Na2SO3+H2O
2NO+O2==2NO2
3NO2+H2O==2HNO3+NO
SO2+Na2SO3+H2O===2NaHSO3
SO2(过)+NaOH===NaHSO3
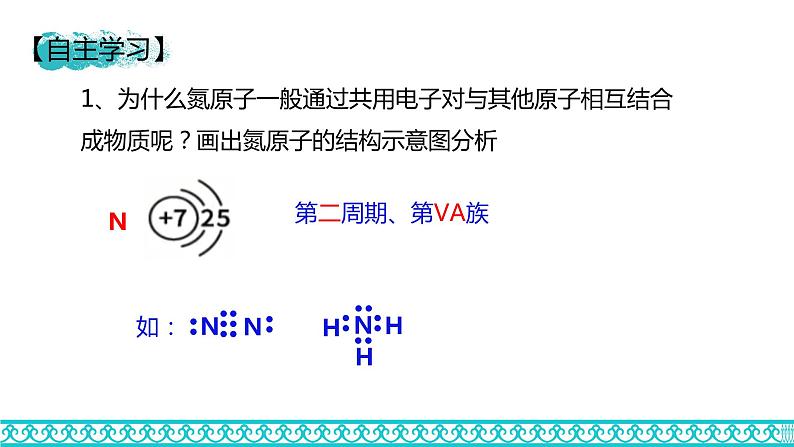
1、为什么氮原子一般通过共用电子对与其他原子相互结合成物质呢?画出氮原子的结构示意图分析
2、氮元素在自然界中的存在在空气中主要是以_____________形成存在(占空气体积_______%),部分氮元素以化合物的形式存在于动植物体内的____________中,还有部分存在于土壤、海洋里的__________和 __________中。
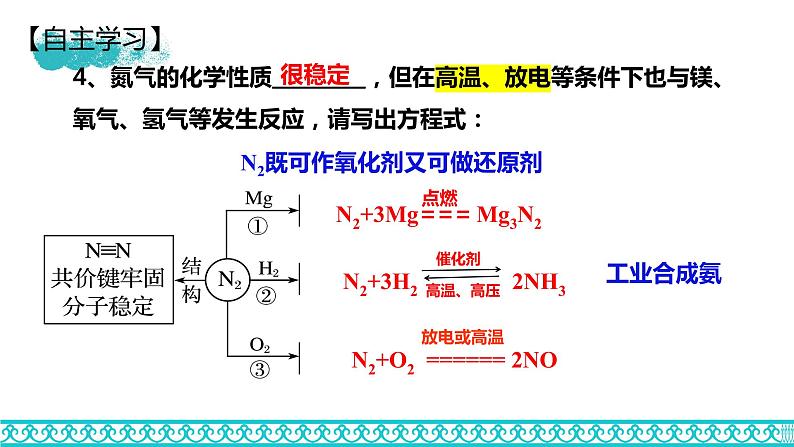
4、氮气的化学性质_________,但在高温、放电等条件下也与镁、氧气、氢气等发生反应,请写出方程式:
N2既可作氧化剂又可做还原剂
降温、加压 逐渐升温
空气----------液化空气--------氮气 (N2的沸点低先挥发出来,把余下的液氧加压储存于钢瓶)
(1)工业上用空气作原料
碳燃烧 通过碱溶液
空气--------混合气体---------氮气
除掉空气中氧气得到N2是化学变化
下列关于氮气的说法,错误的是( )。A.氮气在通常情况下不燃烧,也不支持燃烧,不能供给呼吸B.液氮可用于医学和高科技领域,制造低温环境C.利用氮气的稳定性,工业上用氮气替代稀有气体作焊接金属的保护气D.在高温高压、催化剂条件下与氢气反应时,氮气作还原剂
自然固氮:________________、______________
人工固氮:_____________
让人又爱又恨的NO和NO2
二、一氧化氮和二氧化氮
无色的有毒气体,不溶于水
红棕色、有刺激性气味的有毒气体,易溶于水,
1/3氧化剂;2/3还原剂
NO:收集; NO2(或NO、NO2 混合气体):碱液(如NaOH溶液)
2NO2 + 2NaOH == NaNO3 + NaNO2 + H2O
导致光化学烟雾和酸雨,破坏臭氧层
吸入空气后气体变为红棕色
气体变为无色,注射器活塞向内移动
总:4NO+3O2+2H2O=4HNO3 或 4NO2+O2+2H2O=4HNO3
1、如果要将注射器中的NO充分转化,可以采取什么措施? 如何用一个方程式表示其过程?上述实验对工业上生产硝酸有什么启示?
通入适量的氧气或空气,经过多次循环氧化吸收;4NO+3O2+2H2O=4HNO3可充分利用原料,减少NO的排放,保护环境
2、NO、NO2是酸性氧化物吗?
和碱反应只生成对应的盐和水的氧化物
3、把一支充满NO2气体的试管倒置在水槽中充分反应后有什么现象?
由反应3NO2+H2O==2HNO3+NO可知:当NO2与H2O充分反应后,试管内气体变为无色,且剩余气体占试管体积的1/3
设计两种方案鉴别红棕色气体NO2和溴蒸气
1、加水充分振荡,溶液呈橙色为溴蒸气,无色为NO2
3NO2 + H2O = 2HNO3 + NO
Br 2 + H2O = HBr + HBrO
2、加入硝酸银溶液,产生淡黄色沉淀的为溴蒸气,无淡黄色沉淀的为NO2
HBr + AgNO3 = AgBr↓+ HNO3
NO2具有氧化性,可使KI淀粉试纸变蓝,鉴别NO2和溴蒸气不能用淀粉KI试纸。
NO2+SO2=SO3+NO
NO2通入NaHCO3溶液中,会有什么现象?为什么?
3NO2+H2O=2HNO3+NO HNO3+NaHCO3=NaNO3+CO2↑+H2O
红棕色气体变为无色,有无色气体生成。
雷雨过后庄稼总是更加旺盛,俗称“雷雨发庄稼”请用所学的化学知识解释原因。
相关课件
这是一份高中化学学考复习第十讲氮及其化合物课件,共29页。PPT课件主要包含了答案D,硝酸的工业制法等内容,欢迎下载使用。
这是一份5.2氮及其化合物——2022-2023学年高中化学学业水平复习课件(人教版2019必修二),共33页。PPT课件主要包含了原子结构,既不容易得到3个电子,也不容易失去5个电子,动植物体内的蛋白质中,氮气与氮的固定,自然固氮,人工固氮,高能固氮,生物固氮,豆科植物的根瘤菌固氮等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第二节 氮及其化合物图文课件ppt,共31页。PPT课件主要包含了核心素养,氨的分子结构,有刺激性气味,化学性质,想想看,氨气溶于水溶液显碱性,⑴氨与水的反应,氨水的成份,特别注意,氨水的密度等内容,欢迎下载使用。










