

所属成套资源:2022池州贵池区高二上学期期中考试及答案(九科)
2022池州贵池区高二上学期期中考试化学试题含答案
展开
这是一份2022池州贵池区高二上学期期中考试化学试题含答案,共11页。试卷主要包含了选择题的作答,非选择题的作答,5;等内容,欢迎下载使用。
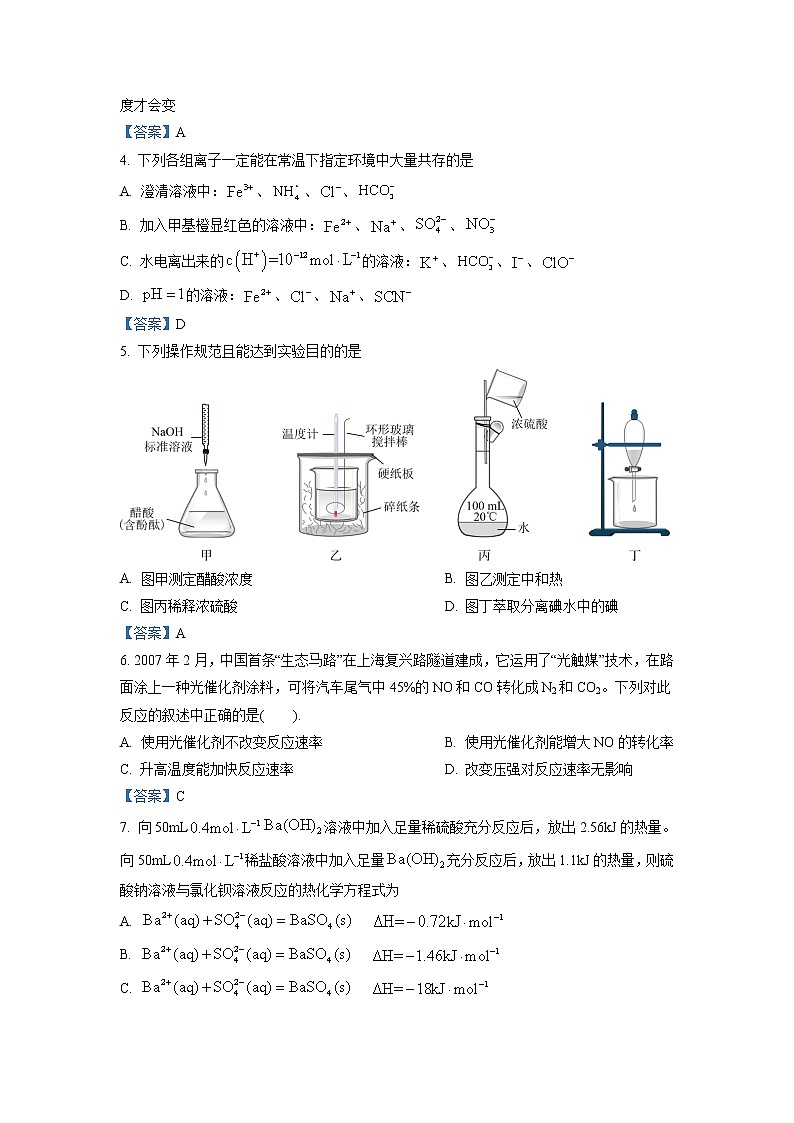
贵池区2021~2022学年度第一学期期中教学质量检测高二化学试卷(考试时间:90分钟试卷满分:100分)命题单位:池州二中注意事项:1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。可能用到的相对原子质量:H1;O16;Cl35.5;一、选择题(每小题只有一个选项符合题意,每题3分,共48分)1. 中国国家主席习近平出席第七十六届联合国大会一般性辩论并发表重要讲话指出:“中国将力争2030年前实现碳达峰、2060年前实现碳中和,这需要付出艰苦努力,但我们会全力以赴。中国将大力支持发展中国家能源绿色低碳发展,不再新建境外煤电项目。”“碳中和”是指的排放总量和减少总量相当。下列措施中能促进碳中和最直接有效的是A. 将重质油裂解为轻质油作为燃料 B. 大规模开采可燃冰作为新能源C. 通过清洁煤技术减少煤燃烧污染 D. 研发催化剂将还原为甲醇【答案】D2. 化学和生活密切相关,下列生产生活中实例不能用勒夏特列原理解释的是A. 摇晃后的可乐开启后有大量气泡B. 合成氨工业中温度选择400-500℃C. 酸遇紫色石蕊试剂变红D. 生产硫酸的过程中用过量的空气和二氧化硫反应【答案】B3. 拿破仑在俄国时,当时法国士兵军服的纽扣都是用金属锡做的。灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿。试分析现把白锡制成的器皿放在0℃、100kPa的室内存放,它会不会变成灰锡而不能再继续使用?已知:在0℃、100kPa条件下白锡转化为灰锡反应的焓变和熵变分别为ΔH=-2.1809kJ·mol-1,ΔS=-6.6J·mol-1·K-1。A. 会变 B. 不会变 C. 不能确定 D. 升高温度才会变【答案】A4. 下列各组离子一定能在常温下指定环境中大量共存的是A. 澄清溶液中:、、、B. 加入甲基橙显红色的溶液中:、、、C. 水电离出来的的溶液:、、、D. 的溶液:、、、【答案】D5. 下列操作规范且能达到实验目的的是A. 图甲测定醋酸浓度 B. 图乙测定中和热C. 图丙稀释浓硫酸 D. 图丁萃取分离碘水中的碘【答案】A6. 2007年2月,中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2。下列对此反应的叙述中正确的是( ).A. 使用光催化剂不改变反应速率 B. 使用光催化剂能增大NO的转化率C. 升高温度能加快反应速率 D. 改变压强对反应速率无影响【答案】C7. 向50mL溶液中加入足量稀硫酸充分反应后,放出2.56kJ的热量。向50mL稀盐酸溶液中加入足量充分反应后,放出1.1kJ的热量,则硫酸钠溶液与氯化钡溶液反应的热化学方程式为A. B. C. D. 【答案】C8. 某同学想了解食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是指示剂的变色范围,叙述正确的是指示剂石蕊甲基橙甲基红酚酞变色范围(pH)5.0~8.03.1~4.44.4~6.28.2~10.0 A. 该实验应选用甲基橙作指示剂B. 盛装标准液的滴定管用蒸馏水洗涤过,未用标准液润洗会导致所测食醋中醋酸浓度偏大C. 用量筒量取一定体积的食醋溶液,用碱式滴定管量取一定体积的NaOH标准液D. 滴定时,眼睛一直注视着刻度线【答案】B9. 已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是①生成物的质量分数一定增加②生成物的产量一定增大③反应物的转化率一定增大④反应物的浓度一定降低⑤正反应速率一定大于逆反应速率⑥平衡常数一定增大A. ①② B. ③⑤ C. ②⑤ D. ④⑥【答案】C10. 布洛芬片常用来减轻感冒症状,其结构简式如图,下列有关说法错误的是A. 布洛芬分子式为B. 布洛芬与苯乙酸是同系物,都能和碳酸氢钠反应C. 1mol布洛芬最多能与3mol氢气发生加成反应D. 布洛芬在苯环上发生取代反应,其一氯代物有4种【答案】D11. 将一定量的X加入某密闭容器中,发生反应:,平衡时混合气体中X的物质的量分数与温度关系如图所示。下列推断正确的是A. 平衡后加入高效催化剂可使混合气体的平均摩尔质量增大B. 压强大小有:C. 升高温度,该反应平衡常数K减小D. 在该条件下M点X平衡转化率为【答案】B12. 下列离子方程式的书写及评价均合理的是选项离子方程式评价A将通入到含的溶液中:正确:过量,可将、均氧化B溶液与足量的溶液反应:正确:酸式盐与碱反应生成正盐和水C过量通入到溶液中:正确:说明酸性:强于D的溶液和的溶液等体积互相均匀混合:正确:与消耗的的物质的量之比为2∶3 A. A B. B C. C D. D【答案】D13. 三甲胺N(CH3)3是重要的化工原料。我国科学家实现了在铜催化剂条件下将N,N-二甲基甲酰胺[(CH3)2NCHO,简称DMF]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示(*表示物质吸附在铜催化剂上),下列说法正确的是A. 该历程中决速步骤为B. 该历程中的最大能垒(活化能)为2.16eVC. 升高温度可以加快反应速率,并提高DMF的平衡转化率D. 若1molDMF完全转化为三甲胺,则会释放出1.02eV·NA的能量【答案】D14. 常温下,pH均为2、体积均为的、、溶液,分别加水稀释至体积为V,溶液pH随的变化关系如图所示,下列叙述错误的是A. 的电离度:a点<b点B. 当时,三种溶液同时升高温度,减小C. 当时,大于D. 是强酸,、是弱酸,且【答案】C15. T℃,某密闭容器中发生:,达到平衡后,下列说法正确的是A. 该反应的化学平衡常数表达式为B. 加入CaO后,c(CO2)将减小C. 升高温度,该反应平衡将向正反应方向移动D. 将密闭容器体积缩小为原来一半,再次平衡后,CO2的浓度增大为原来2倍【答案】C16. 温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1molNO2,发生反应:2C(s)+2NO2(g)N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法不正确的是A. T℃时,该反应的化学平衡常数为Kc=mol·L-1B. 由图可知,c点V正>V逆C. 向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡小D. 容器内的压强:pa∶pb=6∶7【答案】D二、填空题(请将答案填写到答题卷相应位置,共52分)17. 氮是一种重要的元素,含氮化合物是化工、能源、环保等领域的研究热点。回答下列问题:(1)已知:试写出表示氨气的标准燃烧热的热化学方程式:_______。(2)已知:合成尿素的反应为。向恒容密闭容器中按物质的量之比4∶1充入和,使反应进行,保持温度不变,测得的转化率随时间的变化情况如图所示。①若用的浓度变化表示反应速率,则A点的逆反应速率_______B点的正反应速率(填“>”“<”或“=”)。②下列叙述中不能说明该反应达到平衡状态的是_______(填选项字母)。A.体系压强不再变化B.气体平均摩尔质量不再变化C.的消耗速率和的消耗速率之比为2∶1D.固体质量不再发生变化③工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有_______(填选项字母)。A.升高温度B.加入催化剂C.将尿素及时分离出去D.增大反应体系的压强(3)汽车尾气已成为许多大城市空气的主要污染源,其中存在大量。实验发现,易发生二聚反应并快速达到平衡。向真空钢瓶中充入一定量的进行反应,测得温度分别为和时的转化率随时间变化的结果如图所示。温度为时,达到平衡时体系的总压强为200kPa,X点的物质的量分数为_______(保留三位有效数字),X点对应的平衡常数_______(用分压表示,保留小数点后三位);提高平衡转化率的条件为_______(任写两点)。【答案】(1) (2) ①. < ②. C ③. D (3) ①. 78.6% ②. 0.086 ③. 降低温度,充入NO气体18. 某研究性学习小组利用溶液和酸性溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:实验序号实验温度/K 溶液颜色褪至无色所需时间/s酸性溶液溶液A29320.0240.10B20.0230.18C31320.020.11 (1)通过实验A、B,可探究出_______(填外部因素)的改变对化学反应速率的影响,其中_______、_______,通过实验_______(填实验序号)可探究出温度变化对化学反应速率的影响,其中_______。(2)若,则由此实验可以得出的结论是_______。忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用的浓度变化表示的反应速率_______。(3)该小组的一位同学通过查阅资料发现,上述实验过程中随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对与草酸之间的反应有某种特殊作用,则该作用是_______。设计实验证明,分别取等体积等浓度的和混合,平均分成两份,一份中不加任何试剂,一份加入少量固体,观察到两溶液都没有褪色,原因是:_______。【答案】(1) ①. 浓度 ②. 1mL ③. 293 ④. BC ⑤. 3mL (2) ①. 当其他条件不变时,浓度越大,反应速率越快 ②. (3) ①. 催化作用 ②. 过量(或不足)19. 氯及其化合物在工业生产中具有很重要的作用。(1)舍勒制氯气的方法至今仍是实验室制氯气的常用方法,其离子方程式为:_______。要想得到纯净干燥的氯气,一般先通入饱和的食盐水,然后再通入浓硫酸中。饱和食盐水的作用:①_______②降低氯气在水中的溶解度。试通过平衡移动的原理分析饱和食盐水降低氯气在水中的溶解度。原因是:_______。(2)氯的化合物在有机合成中占有很重要的作用。一般可以通过在一硬质玻璃烧瓶中加入过量,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)来制取。已知:氯铂酸钡固体加热时部分分解为、和,T℃时平衡常数。在T℃,碘蒸气初始压强为30.0kPa。T℃平衡时,测得烧瓶中压强为40.2kPa,则_______kPa,反应的平衡常数_______。(3)氯的许多化合物为疫情防控提供了强有力的物质支撑。已知:①次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数[,X为或与pH的关系如图所示。的电离常数值为_______。②常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为、、的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到溶液。上述过程中,生成的反应属于歧化反应,每生成1mol消耗的量为_______mol;产生“气泡”的化学方程式为_______。③84消毒液的主要成分为和。已知25℃时,下列酸的电离平衡常数如下:化学式电离平衡常数写出少量的通入84消毒液中的离子方程式:_______。④二氯异氰尿酸钠是一种常用的消毒剂,具有很强的氧化性,对各种致病性微生物如病毒、细菌芽孢、真菌等有很强的杀生作用,是一种适用范围广,高效的杀菌剂,二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。已知:实验检测原理为:准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量溶液,密封在暗处静置5min;用标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗溶液20.00mL。滴定终点的现象是:_______,该样品有效氯=_______。【答案】(1) ①. ②. 吸收 ③. 饱和食盐水中浓度达到饱和,抑制了的溶解 (2) ①. 20 ②. 0.01 (3) ①. ②. 1.25 ③. ④. ⑤. 当加入最后一滴标准液时,溶液由蓝色变为无色,且半分钟内不复原 ⑥. 63.4%
相关试卷
这是一份2024池州贵池区高一上学期期中化学试卷含答案,文件包含安徽省池州市贵池区2023-2024学年高一上学期期中化学试卷docx、安徽省池州市贵池区2023-2024学年高一上学期期中化学答案docx等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。
这是一份2024池州贵池区高二上学期期中考试化学含答案,共9页。试卷主要包含了5ml/L,0~8,2~10等内容,欢迎下载使用。
这是一份2024池州贵池区高二上学期期中化学试卷含答案,文件包含安徽省池州市贵池区2023-2024学年高二上学期期中化学试卷docx、安徽省池州市贵池区2023-2024学年高二上学期期中化学答案docx等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。








