
- 4.1.3 核素(自主学案)-2022-2023学年高一化学同步学习高效学与练(人教版2019必修第一册) 学案 0 次下载
- 4.1.4 原子结构与元素的性质(自主学案)-2022-2023学年高一化学同步学习高效学与练(人教版2019必修第一册) 学案 0 次下载
- 4.2.1 元素性质的周期性变化规律(自主学案)-2022-2023学年高一化学同步学习高效学与练(人教版2019必修第一册) 学案 0 次下载
- 4.3.1 离子键(自主学案)-2022-2023学年高一化学同步学习高效学与练(人教版2019必修第一册) 学案 0 次下载
- 4.3.2 共价键(自主学案)-2022-2023学年高一化学同步学习高效学与练(人教版2019必修第一册) 学案 0 次下载
2021学年第四章 物质结构 元素周期律第二节 元素周期律导学案及答案
展开2022-2023学年高一化学同步学习高效学与练(自主学案)
第四章 物质结构 元素周期律
第二节 元素周期律
第2课时 元素周期表和元素周期律的应用
课程学习目标
1.知道元素周期表的简单分区,进一步认识元素周期表是元素周期律的具体表现形式。
2.学会运用元素周期表、元素周期律的有关知识,指导科学研究和工农业生产。
学科核心素养
1.通过对“元素周期表的简单分区”的学习,增强宏观辨识与微观探析、证据推理与模型认知的能力。
2.通过对“元素周期表、元素周期律应用”的学习,培养科学探究精神和社会责任感。
【知识回顾】
1.元素周期表中,同一周期从左到右,金属性逐渐__减弱__,非金属性逐渐__增强__;同一主族自上而下,金属性逐渐__增强__,非金属性逐渐__减弱__。
2.元素周期表中,第三周期中金属与非金属分界处的元素是__铝(Al)__和__硅(Si)__。
3.常用作半导体材料的硅,在元素周期表中的位置是__第三周期第ⅣA族__。
【新知学习】
一.元素周期律
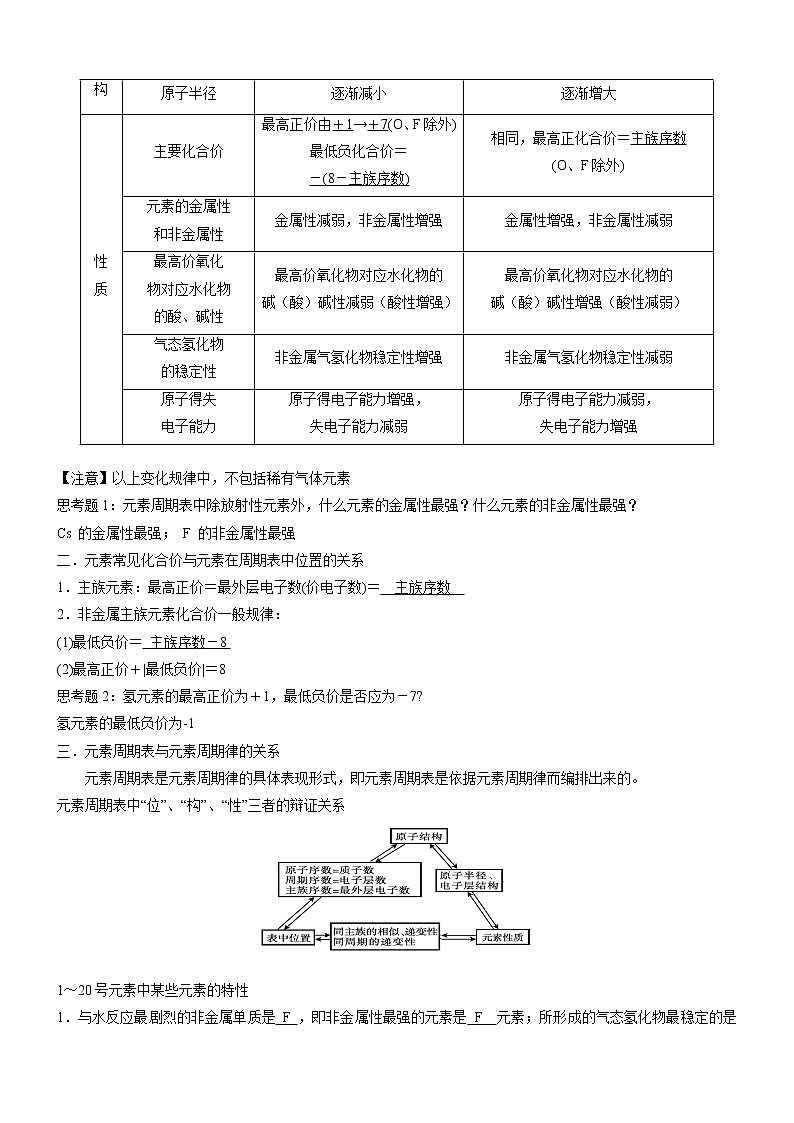
1.元素的金属性和非金属性的递变情况:图表中虚线表示金属元素和非金属元素的
分界线,其左下角区域为金属元素,右上角区域为非金属元素。
2.元素周期表中同周期、同主族元素原子结构和元素性质的递变规律
周期表中位置 | 同周期(左→右) | 同主族(上→下) | |
原 子 结 构 | 核电荷数 | 依次增加 | 增大 |
电子层数 | 相同 | 依次增加 | |
最外层电子数 | 依次增加 | 相同 | |
原子半径 | 逐渐减小 | 逐渐增大 | |
性 质 | 主要化合价 | 最高正价由+1→+7(O、F除外) 最低负化合价= -(8-主族序数) | 相同,最高正化合价=主族序数 (O、F除外) |
元素的金属性 和非金属性 | 金属性减弱,非金属性增强 | 金属性增强,非金属性减弱 | |
最高价氧化 物对应水化物 的酸、碱性 | 最高价氧化物对应水化物的 碱(酸)碱性减弱(酸性增强) | 最高价氧化物对应水化物的 碱(酸)碱性增强(酸性减弱) | |
气态氢化物 的稳定性 | 非金属气氢化物稳定性增强 | 非金属气氢化物稳定性减弱 | |
原子得失 电子能力 | 原子得电子能力增强, 失电子能力减弱 | 原子得电子能力减弱, 失电子能力增强 | |
【注意】以上变化规律中,不包括稀有气体元素
思考题1:元素周期表中除放射性元素外,什么元素的金属性最强?什么元素的非金属性最强?
Cs 的金属性最强; F 的非金属性最强
二.元素常见化合价与元素在周期表中位置的关系
1.主族元素:最高正价=最外层电子数(价电子数)= 主族序数
2.非金属主族元素化合价一般规律:
(1)最低负价= 主族序数-8
(2)最高正价+|最低负价|=8
思考题2:氢元素的最高正价为+1,最低负价是否应为-7?
氢元素的最低负价为-1
三.元素周期表与元素周期律的关系
元素周期表是元素周期律的具体表现形式,即元素周期表是依据元素周期律而编排出来的。
元素周期表中“位”、“构”、“性”三者的辩证关系
1~20号元素中某些元素的特性
1.与水反应最剧烈的非金属单质是 F ,即非金属性最强的元素是 F 元素;所形成的气态氢化物最稳定的是 HF 。
2.与水反应最剧烈的金属单质是 K ;原子半径最大的主族元素是 K 元素。
3.自然界中硬度最大的单质是含 C 元素的金刚石;最高正价与最低负价的代数和为零,且气态氢化物中含氢的百分含量最高的元素是 C 元素。
4.常温下有颜色的气体单质是 Cl2 。
5.原子半径最小,它的阳离子就是质子的元素为 H 元素;同位素之一的原子核中只有质子而没有中子的是 H 元素。
6.最高价氧化物对应水化物的酸性最强的是 Cl 元素。
7.密度最小的金属单质是 Li 。
8.最高价氧化物及其水化物具有两性的元素是 Al 元素;地壳中含量最高的金属元素是 Al 元素。
9.地壳中含量最高的元素是 O 元素,次者是 Si 元素。
四.元素周期表和周期律的应用
1.便于对元素性质进行系统研究。
2.为发现新元素及预测它们的原子结构和性质提供了线索。
3.在周期表中 金属和非金属分界线 处寻找半导体材料。
4.农药中含有的As、F、Cl、S、P等元素集中在周期表 非金属 区域。
5.在 过渡元素 中寻找催化剂和耐高温、耐腐蚀的合金材料。
6.在周期表一定区域内寻找元素,发现物质的新用途。
思考题3:钫(Fr)是碱金属元素中原子序数最大的元素,根据它在周期表中的位置预言其性质。
(写出两点即可)
钫(Fr)的金属性非常强,与水反应十分剧烈,生成的FrOH是强碱。
【典例1】请运用元素周期表的有关理论分析判断,下面几种元素及其化合物性质的推断中正确的是( )
A.铊(Tl)的氧化物的水化物可能具有两性
B.砹(At)为无色固体,HAt不稳定,AgAt具有感光性,且不溶于水
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.H2Se 是无色、有毒、比H2S稳定的气体
【答案】C
【解析】
同主族元素从上到下金属性增强,Tl的金属性大于Al的金属性,则铊(Tl)的氧化物的水化物为强碱,故A错误;同主族元素从上到下非金属性减弱,且化合物性质相似,则砹(At)为有色固体,HAt不稳定,AgAt具有感光性,且不溶于水,故B错误;硫酸钡、硫酸钙均不溶于水,则硫酸锶(SrSO4)是难溶于水的白色固体,故C正确;非金属性:S>Se,可知H2Se 是无色、有毒、不如H2S稳定的气体,故D错误。
(变式训练1)砷(As)为第四周期第ⅤA族元素,根据元素周期表和元素周期律的知识,下列有关推测不正确的是( )
A.砷有-3、+3、+5等多种化合价
B.原子半径:As>P
C.酸性:H3AsO4>H2SO4
D.热稳定性:HBr>AsH3
【答案】C
【解析】
砷为第ⅤA族元素,可以有-3、+3、+5等多种化合价,故A正确;同主族元素从上到下原子半径增大,原子半径:As>P,故B正确;同主族元素从上到下非金属性减弱,非金属性:P>As,则H3AsO4的酸性比H3PO4弱,同周期元素从左到右非金属性增强,H2SO4酸性大于H3PO4,酸性:H3AsO4<H2SO4,故C错误;非金属性:Br>As,热稳定性:HBr>AsH3,故D正确。
【知识进阶】
元素的位置、原子结构、性质之间的关系
【问题探究】
1.什么元素(放射性元素除外)的金属性最强?什么元素的非金属性最强?分别位于元素周期表中的什么位置?
铯的金属性最强,氟的非金属性最强,分别位于元素周期表的左下角和右上角。
2.如果已知X、Y为周期表中相邻的两元素,且它们的最高价氧化物对应水化物的酸性强弱为X>Y,能否确定它们的相对位置?
可根据元素非金属性的变化规律确定它们的相对位置。由已知条件可确定非金属性为X>Y,所以,如果它们同周期,则X在Y的右面;如果它们同主族,则X在Y的上面。
【知识归纳总结】
1.位—构—性关系图示
2.结构与位置的互推:
(1)掌握四个关系式。
①电子层数=周期数
②质子数=原子序数
③主族元素原子最外层电子数=主族序数
④主族元素的最高正价=族序数(氧、氟除外),最低负价=主族序数-8
(2)同主族上下相邻元素原子序数的位置、关系及实例。
位置 | 关系 | 实例 |
位于过渡元素左侧的主族元素,即第ⅠA族、第ⅡA族 | 同主族、相邻周期元素原子序数之差为上一周期元素所在周期所含的元素种数 | 钠与钾的原子序数差为19-11=8(即钠原子所在第3周期所含的元素种数) |
位于过渡元素右侧的主族元素,即第ⅢA族~ⅦA族 | 同主族、相邻周期元素原子序数之差为下一周期元素所在周期所含的元素种数 | 氯和溴的原子序数之差为35-17=18(即溴原子所在第4周期所含的元素种数) |
3.性质与位置的互推:
(1)根据元素的性质可以推知元素在周期表中的位置:若同周期元素A、B、C的金属性逐渐增强,则A、B、C在同周期中按照C、B、A的顺序从左到右排列。
(2)根据元素在周期表中的位置关系可以推断元素的性质:若同主族元素A、B、C在同一主族中从上往下排列,则可推知A、B、C的单质的氧化性依次减弱或还原性依次增强。
4.结构与性质的互推:
(1)若某元素原子的最外层电子数小于4,则该元素原子在反应中容易失电子;若某元素原子的最外层电子数大于4,则该元素原子在反应中容易得电子。
(2)若某元素原子在反应中容易得电子,则该元素原子的最外层电子数大于4;若某元素原子在反应中容易失电子,则该元素原子的最外层电子数小于4。
5.比较元素性质时,有时需要借助参照物,如比较Ca(OH)2和Al(OH)3的碱性大小,因为Ca与Al既不属于同周期又不属于同主族,可借助镁元素进行判断,三种元素在周期表中的位置如图:
镁 | 铝 |
钙 |
|
故金属性:Ca>Mg>Al,碱性:Ca(OH)2>Mg(OH)2>Al(OH)3。
6.元素“位、构、性”规律中的特例:
(1)绝大多数原子的原子核是由质子和中子构成的,只有氕(H)无中子。
(2)元素周期表中的周期一般都是从金属元素开始,但第1周期例外,是从氢元素开始的。
(3)所有元素中,碳元素形成的化合物种类最多。
(4)非金属单质一般不导电,但石墨导电,晶体硅是半导体。
(5)氟无正价,氧无最高正价;在Na2O2中氧显-1价,在NaH中氢显-1价。
点拨:(1)只有主族元素的最外层电子数等于主族序数。
(2)难得电子的原子不一定易失电子,如稀有气体原子。
【典例2】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
A.原子半径:W<X
B.常温常压下,Y单质为固态
C.气态氢化物热稳定性:Z<W
D.X的最高价氧化物的水化物是强碱
【答案】D
【解析】
由题意,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8,可推出W、X、Y、Z分别为N、Al、Si、P。A对:根据电子层数越多,原子半径越大,可得原子半径:W<X;B对:常温常压下,硅单质为固态;C对:同一主族由下到上简单气态氢化物的稳定性逐渐增强,所以热稳定性:NH3>PH3;D错:X的最高价氧化物的水化物Al(OH)3是弱碱。
〔变式训练2〕短周期元素甲~戊在元素周期表中的相应位置如表所示,下面判断正确的是( )
甲 | 乙 |
|
丙 | 丁 | 戊 |
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
【答案】C
【解析】
同周期元素原子半径从左至右是依次减小的,故A项错误;同主族元素金属性自上而下是增强的,故B项错误;同周期元素的金属性从左至右越来越弱,故对应氢氧化物的碱性是逐渐减弱的,故C项正确;同周期元素的原子最外层电子数从左到右越来越多,故D项错误。
【效果检测】
1.根据元素周期表和元素周期律分析下面的判断,其中正确的是( )
A.铍(Be)原子失电子能力比镁强 B.B的金属性比Al强
C.硒(Se)化氢比硫化氢稳定 D.氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强
【答案】D
【解析】
A. 同主族从上向下金属性增强,则铍(Be)原子失电子能力比镁弱,A项错误;
B. B和Al同主族,位于Al的上一周期,则其金属性比Al弱,B项错误;
C. 硒(Se)与S同主族,位于S的下一周期,非金属性:S>Se,故硒(Se)化氢不如硫化氢稳定,C项错误;
D. Sr与Ca同主族,位于Ca的下一周期,金属性比较:Sr> Ca,则氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强,D项正确;答案选D。
2.下列各组微粒半径大小的比较中,不正确的是( )
A.r(K)>r(Na)>r(Li) B.r(Mg2+)>r(Na+)>r(F-)
C.r(Na+)>r(Mg2+)>r(Al3+) D.r(Br-)>r(Cl-)>r(F-)
【答案】B
【解析】
A.同一主族的元素,从上到下,原子核外电子层数逐渐增多,所以原子半径逐渐增大,所以原子半径:r(K)>r(Na)>r(Li),A正确;
B.对于电子层结构相同的离子来说,核电荷数越大,离子半径越小,所以离子半径:
r(Mg2+)<r(Na+)<r(F-),B错误;
C.对于电子层结构相同的离子来说,核电荷数越大,离子半径越小,所以离子半径:
r(Na+)>r(Mg2+)>r(Al3+),C正确;
D.对于同一主族的元素形成的阴离子,从上到下,离子核外电子层数逐渐增多,所以离子半径逐渐增大,所以离子半径:r(Br-)>r(Cl-)>r(F-),D正确;故正确选项是B。
3.下列有关物质性质的比较正确的是( )
①同主族元素的单质从上到下,氧化性逐渐减弱,熔点逐渐升高
②元素的非金属性越强,气态氢化物的热稳定性越弱
③单质与水反应的剧烈程度:F2>Cl2>Br2>I2
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2﹣>Se2﹣
⑥酸性:HNO3>H3PO4.
⑦原子半径:K>Cl>S>O>F
A.①③ B.②④⑦ C.③⑥ D.⑤⑥⑦
【答案】C
【解析】
①碱金属从上到下熔点降低;而卤族元素的单质从上到下,非金属性逐渐减弱,氧化性逐渐减弱;分子间作用力越来越大,所以熔点逐渐升高,错误;
②非金属性越强,气态氢化物的热稳定性越强,错误;
③非金属性越强,对应单质与水反应越剧烈,则单质与水反应的剧烈程度:F2>Cl2>Br2>I2,正确;
④非金属性越强,最高价氧化物的水化物酸性越强,而不能比较氢化物的酸性,错误;
⑤非金属性S>Se,对应离子的还原性为S2-<Se2-,错误;
⑥非金属性N>P,最高价氧化物的水化物酸性为HNO3>H3PO4,正确;
⑦同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径:K>S>Cl>O>F,错误;
结合以上分析可知,正确的只有③⑥,故答案选C。
4.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于I A族,W与X属于同一主族。下列说法正确的是( )
A.元素X、W的简单阴离子具有相同的电子层结构
B.由Y、Z两种元素组成的化合物是离子化合物
C.W的简单气态氢化物的热稳定性比Y的强
D.原子半径:r(X)<r(Y)<r(Z)<r(W)
【答案】B
【解析】
Y是迄今发现的非金属性最强的元素,应为F,X原子的最外层有6个电子,且原子序数小于F,应为O元素,在周期表中Z位于IA族,由原子序数关系可知Z为Na元素,W与X属于同一主族,W应为S元素。
A.元素X、W的简单阴离子分别为O2-、S2-,离子的电子层结构不同,故A错误;
B.Y为F,Z为Na,由Y、Z两种元素组成的化合物为NaF,是离子化合物,故B正确;
C.非金属性F>S,元素的非金属性越强,对应的氢化物越稳定,故C错误;
D.原子核外电子层数越多,原子半径越大,同周期元素从左到右原子半径逐渐减小,则半径r(F)<r(O)<r(S)<r(Na),故D错误;
故选B。
5.a、b、c、d为短周期元素,a的原子中只有1个电子,b2−和C+离子的电子层结构相同,d与b同族。下列叙述错误的是( )
A.a与其他三种元素形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d和a形成的化合物的溶液呈弱酸性
【答案】A
【解析】
a的原子中只有1个电子,则a为氢元素,a、b、c、d为短周期元素,b2-和C+离子的电子层结构相同,则b为氧元素,C为Na元素,d与b同族,则d为硫元素。
A.H与O、S形成化合物为H2O和H2S,氢元素的化合价为+1,而NaH中氢元素的化合价为-1价,A项错误;
B.氧元素与其他元素能形成H2O、H2O2、SO2、SO3、Na2O、Na2O2等化合物,B项正确;
C.同周期元素,从左到右原子半径逐渐减小,电子层数越多,原子半径越大,原子半径:Na>S>O>H,C项正确;
D.d和a形成的化合物为H2S,硫化氢是二元弱酸,H2S的溶液呈弱酸性,D项正确;答案选A。
6.短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是( )
A.原子半径:r(W) > r(Z) > r(Y)
B.由X、Y 组成的化合物中均不含共价键
C.Y 的最高价氧化物的水化物的碱性比Z的弱
D.X 的简单气态氢化物的热稳定性比W的强
【答案】D
【解析】
短周期主族元素X、Y、Z、W原子序数依次增大;X是地壳中含量最多的元素,X为O元素;Y原子的最外层只有一个电子,Y为Na元素;Z位于元素周期表中IIIA族,Z为Al元素;W与X属于同一主族,W为S元素。根据元素周期律作答。
【详解】
A项,Na、Al、S都是第三周期元素,根据同周期从左到右主族元素的原子半径依次减小,原子半径:r(Y)r(Z)r(W),A项错误;
B项,由X、Y组成的化合物有Na2O、Na2O2,Na2O中只有离子键,Na2O2中既含离子键又含共价键,B项错误;
C项,金属性:Na(Y)Al(Z),Y的最高价氧化物的水化物的碱性比Z的强,C项错误;
D项,非金属性:O(X)S(W),X的简单气态氢化物的热稳定性比W的强,D项正确;
答案选D。
7.W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中 W 元素的原子序数为Z元素原子序数的两倍,下列说法正确的是( )
A.X在元素周期表中位于第3周期第VIA 族
B.X、Y、Z三种元素对应原子的半径依次减小
C.XZ2 和YZ2 的化学性质相似
D.利用 W 的含氧酸酸性强于Y 的含氧酸酸性,可证明非金属性:W>Y
【答案】B
【解析】
W 元素的原子序数为Z元素原子序数的两倍,则W为硫(S),Z为氧(O);从而得出Y为氮(N),X为硅(Si)。
A.X为硅(Si),在元素周期表中位于第3周期第ⅣA 族,A不正确;
B.X(Si)的电子层数多一层,Y(N)、Z(O)同周期且Y在Z的左边,三种元素对应原子的半径依次减小,B正确;
C.XZ2 (SiO2)和YZ2 (NO2)的化学性质不同,C不正确;
D.没有指明 W(S)的含氧酸与Y(N) 的含氧酸是否为最高价含氧酸,所以不能证明非金属性:W>Y,D不正确;
故选B。
8.以下有关原子结构、元素周期律及元素周期表的叙述正确的是( )
A.所有主族元素原子的最外层电子数都等于元素的最高正化合价
B.多电子原子中,在离核较近的区域内运动的电子能量较低
C.第IA族元素从上到下,单质的熔点逐渐降低
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
【答案】B
【详解】
A.并不是所有主族元素原子的最外层电子数都等于元素的最高正化合价,如O无最高正价,F无正价,A错误;
B.多电子原子中,电子是分层排布的,能量低的电子总是优先进入离核较近的区域内运动,故离核近的区域运动的电子能量较低,B正确;
C.第IA族元素从上到下,单质的熔点逐渐降低,H2的熔点低于Li,C错误;
D.元素周期表中位于金属和非金属分界线附近的元素属于两性元素,可以用于作良好的半导体材料,D错误;
故答案为:B。
9.有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16.三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子.有关判断不正确的是( )
A.X元素位于ⅥA族 B.A不能溶解于B中
C.B的沸点高于C的沸点 D.A和C不可能发生氧化还原反应
【答案】D
【解析】
B和C为化合物,且属于10电子分子,说明是氢化物,可能是HF、H2O、NH3、CH4中的两个,根据原子半径顺序,Z为H,原子序数之和为16,且单质X和单质Y能发生反应,即Y为N,X为O。
A、根据上述分析,X为O,位于第二周期第VIA族,故A说法正确;
B、A为NO,B为H2O,NO不溶于水,故B说法正确;
C、H2O常温下为液态,C为NH3,常温下为气态,因此H2O的沸点高于NH3,故C说法正确;
D、根据化合价的变化规律可知,NO和NH3一定条件下可以发生6NO+4NH3=5N2+6H2O,故D说法错误。
故选D。
10.W、X、Y、Z为原子序数依次增大的短周期主族元素,W最外层电子数是内层电子数的3倍,Y在短周期元素中原子半径最大,Z的最高正价与最低负价代数之和为4。下列说法不正确的是( )
A.氢化物的稳定性:X > W > Z
B.Z与W形成的某种物质能使品红溶液褪色
C.X与Y形成共价化合物
D.W与Y组成的某种物质可以作为呼吸面具的供氧剂
【答案】C
【解析】
W、X、Y、Z为原子序数依次增大的短周期主族元素,W最外层电子数是内层电子数的3倍,W位于第二周期,为氧元素;Y在短周期元素中原子半径最大,Y是钠元素,所以X是氟元素;Z的最高价与最低价代数之和为4,Z的最高价是+6价,为硫元素。
A. 非金属越强,氢化物越稳定,则氢化物的稳定性:X>W>Z,A正确;
B. Z与W形成的某种物质能使品红溶液褪色,该物质是二氧化硫,B正确;
C. X与Y形成离子化合物NaF,C错误;
D. W与Y组成的物质可以作为呼吸面具的供氧剂,该物质是过氧化钠,D正确;
答案选C。
【点睛】
准确判断出元素种类以及灵活应用元素周期律是解答的关键,注意“位—构—性”推断的核心是“结构”,即根据结构首先判断其在元素周期表中的位置,然后根据元素性质的相似性和递变性预测其可能的性质;也可以根据其具有的性质确定其在周期表中的位置,进而推断出其结构。
11.现有下列短周期元素的数据(已知Be的原子半径为0.089nm):
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高正化合价 |
| +2 | +1 | +5 | +7 | +1 | +5 | +3 |
最低负化合价 | -2 |
|
| -3 | -1 |
| -3 |
|
(1)⑧号元素在周期表中的位置是____;上述元素处于同一主族的有____。(用元素符号表示)
(2)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式:____。
(3)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等)。根据下列要求回答问题:
①Li和Li作核反应堆最佳热载体,LiH和LiD用作高温堆减速剂。下列说法正确的是____。
A.Li和Li互为同位素 B.Li和Li属于同种核素
C.LiH和LiD的化学性质不同 D.LiH和LiD是同种物质
②下列说法不正确的是____。
A.碱性:Be(OH)2<LiOH<NaOH<KOH
B.半径:K>Na>Li>Li+
C.氧化性:Li+<Na+<K+<Rb+<Cs+
D.金属性:Cs>Rb>K>Na>Li>Be
【答案】第二周期,第ⅢA族; Li和Na、N和P;
; AD; C。
【解析】
元素周期律,同周期从左到右,原子半径逐渐变小;同主族从上到下,原子半径逐渐变大。通过表中原子半径及Be的原子半径为0.089nm,元素①、⑦、⑧的原子半径比Be小,推断元素①、⑦、⑧为第二周期元素,根据最高正化合价,推出①、⑦、⑧分别为O、N、B;③和⑥的最高正化合价为+1,且⑥的半径比③大,推断③和⑥分别为Li、Na元素;②的原子半径比⑥小,且最高正化合价为+2,则②为Mg;④和⑦的最高正化合价都为+5,且④的原子半径比⑦大,所以④和⑦分别是P、N元素,⑤的最高正化合价为+7,最低负化合价为-1,则⑤为Cl元素。即元素依次为O、Mg、Li、P、Cl、Na、N、B,
(1)⑧号元素为B,其在周期表中的位置是第二周期,第ⅢA族;上述元素处于同一主族的有Li和Na、N和P;
(2)元素①和⑥能形成较稳定的化合物是Na2O,则与水反应的离子方程式为 ;
(3)A.Li和Li质子数相同,中子数不同互为同位素,A正确; B. Li和Li属于同位素,为不同的核素,B错误;
C. LiH和LiD是由同种元素构成的化合物,化学性质基本相同,C错误;
D. LiH和LiD是同种元素构成的化合物,是同种物质,D正确。
所以正确的为AD。
② A. 同周期从左到右,金属性减弱,非金属性变强,最高价氧化物对应水化物的酸性逐渐变强,碱性减弱;同主族元素从上到下,最高价氧化物对应水化物的酸性减弱。所以碱性:Be(OH)2 < LiOH < NaOH < KOH,A项正确;
B. 同主族元素,从上到下,原子半径逐渐变大,Li+因为失去了最外层电子,所以半径小于Li,即半径:K>Na>Li>Li+,B项正确;
C. 由于同主族元素从上到下元素的还原性变强,所以氧化性:Li+>Na+>K+>Rb+>Cs+,C项错误;
D. 由于同主族元素从上到下元素的金属性变强,金属性:Cs>Rb>K>Na>Li>Be,D项正确。
所以不正确的选C。
高中化学第三节 化学键学案: 这是一份高中化学第三节 化学键学案,共11页。学案主要包含了新知学习,知识进阶,问题探究,知识归纳总结,效果检测等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表学案: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表学案,共10页。学案主要包含了知识回顾,新知学习,科学探究,课堂练习,总结和比较,思考与交流,知识进阶,知识归纳总结等内容,欢迎下载使用。
化学必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表导学案: 这是一份化学必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表导学案,共9页。学案主要包含了新知学习,课堂练习,知识进阶,知识归纳总结,效果检测等内容,欢迎下载使用。













