











2023遂宁射洪中学高三上学期第一次月考试题(9月)理综含答案(缺物理答案)
展开A.“玉兔号”月球车帆板太阳能电池的材料是氮化硅或二氧化硅
B.新冠肺炎防疫期间,可用酒精消毒,酒精浓度越大消毒效果越好
C.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
D.汽车尾气中含有的氮氧化物是汽油不完全燃烧生成的
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温下,100 mL pH=1的醋酸溶液中含有的氢离子数目为0.01NA
B.一定量的钠与8 g氧气反应,若两者均无剩余,转移电子的数目为NA
C.等物质的量的14NO和13CO气体中所含中子数均为15NA
D.1 ml丙烯酸(CH2===CHCOOH)中含有双键的数目为NA
9.甲酸香叶脂(结构如右图)为无色透明液体,具有新鲜蔷薇嫩叶的香味,可用于配制香精。下列有关该有机物的叙述正确的是( )
A.分子式为C11H19O2
B.含有羧基和碳碳双键两种官能团
C.能发生加成反应和水解反应
D.1 ml该物质与足量Na反应生成标准状况下气体11.2 L
10.短周期主族元素X、Y、Z、W的原子序数依次增大,常温下它们的单质有一种固体和三种气体。由这四种元素的一种或两种组成的三种有色物质与水发生氧化还原反应时,水既不作氧化剂也不作还原剂。下列说法正确的是
A.简单气态氢化物的沸点:W>Y
B.原子半径:r(Z)>r(W)>r(X)>r(Y)
C.这三种有色物质与水反应后,所得溶液均呈酸性
D.X、Y、Z、W分别与氢元素形成的化合物中化学键均为极性共价键
11.下列实验操作规范且能达到目的的是
12.下列各反应对应的离子方程式正确的是( )
A.向含3 ml次氯酸钠的溶液中通入1 ml二氧化硫:3ClO-+H2O+SO2===2HClO+SOeq \\al(2-,4)+Cl-
B.向碳酸氢钠溶液中加入过量氢氧化钙溶液:2HCOeq \\al(-,3)+Ca2++2OH-===CaCO3↓+2H2O+COeq \\al(2-,3)
C.氢氧化钡溶液与硫酸溶液反应得到中性溶液:Ba2++OH-+H++SOeq \\al(2-,4)===BaSO4↓+H2O
D.50 mL 1 ml·L-1的FeI2溶液中通入0.05 ml Cl2:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
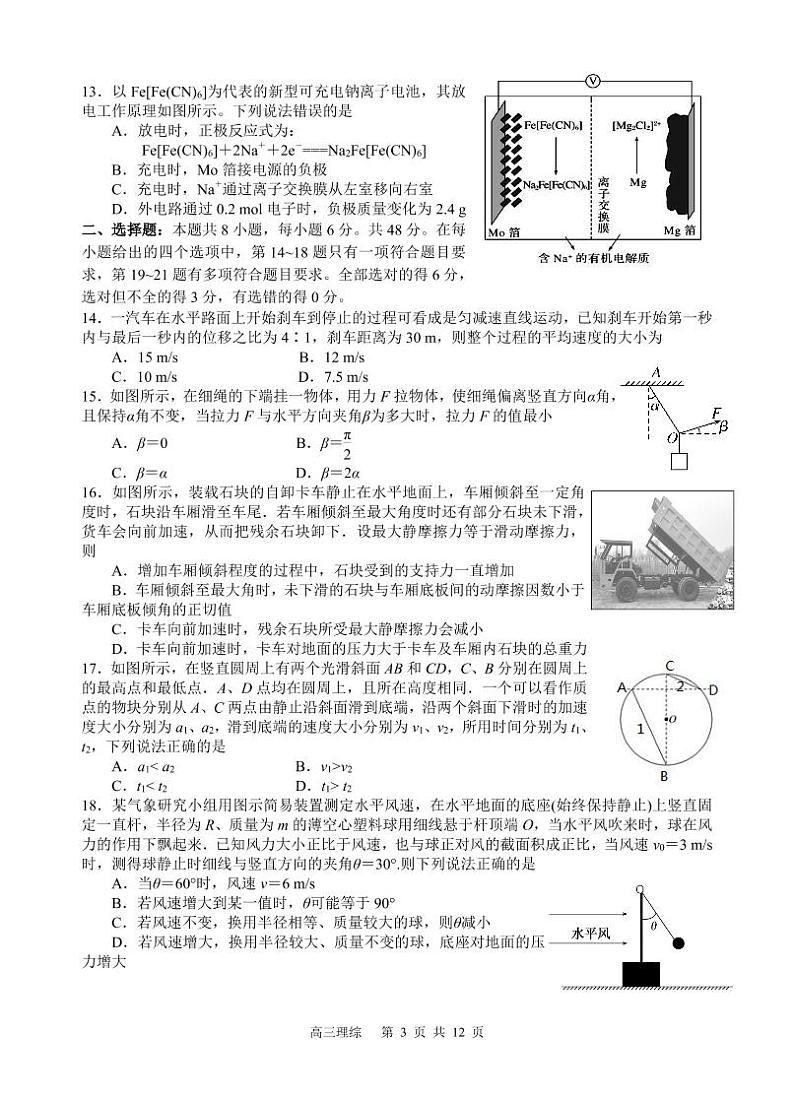
13.以Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法错误的是
A.放电时,正极反应式为:Fe[Fe(CN)6]+2Na++2e-===Na2Fe[Fe(CN)6]
B.充电时,M箔接电源的负极
C.充电时,Na+通过离子交换膜从左室移向右室
D.外电路通过0.2 ml电子时,负极质量变化为2.4 g
26. (14分)二氧化钒(VO2)是一种新型热敏材料。实验室以V2O5为原料合成用于制备VO2的氧钒( IV )碱式碳酸铵晶体,过程如下:
回答下列问题:
(1)步骤i中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为_________。
也可只用浓盐酸与V2O5来制备VOCl2溶液,从环境角度考虑,该方法的缺点是____________。
(2)步骤ii可在下图装置(气密性良好)中进行。已知:VO2+能被O2氧化。
①药品填装完成后的实验操作是________________________(填活塞“a”“b”的操作)。
②若无装置B,则导致的后果是_______________________。
(3)加完VOCl2后继续搅拌数分钟,使反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于CO2保护下的干燥器中,静置过夜,得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,除去水分,再用乙醚洗涤2次,抽干称重。用饱和NH4HCO3溶液洗涤除去的阴离子主要是__________________________________。
(4)测定氧钒( IV )碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加0.02 ml·L-1的KMnO4溶液至稍过量,充分反应后继续加1% NaNO2溶液至稍过量,再用尿素除去过量的NaNO2 ,最后用0.08 ml·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00 mL。(滴定反应:VO2+ + Fe2++2H+===VO2++ Fe3++H2O)
①NaNO2溶液的作用是___________________。
②粗产品中钒的质量分数为_______________(精确到小数点后两位)。
27.一种利用水钴矿[主要成分为C2O3、C(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CCl2·6H2O的工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、C2+、Fe2+、Al3+、Mn2+、Ca2+、Mg2+等
②部分阳离子开始沉淀和完全沉淀的pH见下表
③CCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定,加热至110~120℃时失去结晶水变成无水氯化钴。
(1)写出C2O3与Na2SO3和盐酸反应的离子方程式______________________。
(2)加入NaClO3的目的是______________________;加入过量NaClO3可能生成有毒气体,该气体是___________(填化学式)
(3)为了除去Fe3+、Al3+,需加Na2CO3调pH,则pH应控制的范围为_____________________.
(4)加萃取剂的目的是___________;金属离子在萃取剂中的萃取率与pH的关系如图,据此分析pH的最佳范图为___________(填字母序号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)CCl2·6H2O常用减压烘干法烘干,原因是___________。
28.氧化铁在工业上有广泛的应用。
(1)炼铁高炉中存在以下热化学方程式
I.C(s) +CO2(g) =2CO(g) =+172.5kJ·ml-1
II.Fe2O3(s) +CO(g)2FeO(s)+CO2(g) =-3kJ·ml-1
III.FeO(s) +CO(g)Fe(s) +CO2(g) =-11kJ ·ml-1
IV.Fe2O3 (s) +3CO(g)2Fe(s)+3CO2(g)
①上述反应中,=___________ kJ ·ml-1
②下图中能表示反应IV的平衡常数对数值(lgK)与温度的关系的是___________(填“I”或“II”),原因是___________。
③1500°C时,在某体积可变的密闭容器中,按物质的量比2:3加入Fe2O3和CO发生反应IV ,则达平衡时,Fe2O3的转化率为___________;下列措施能够提高Fe2O3转化率的是___________(填字母序号)。
a.对体系加压
b.升高反应体系的温度
c.加入适量的Na2O固体
d.增大CO在原料中的物质的量比
(2)一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁,其反应为: Fe2O3(s)+3CH4(g)2Fe(s)+ 3CO(g) +6H2(g) ΔH >0
①反应在2 L的密闭容器中进行,5 min后达到平衡,测得Fe2O3在反应中质量消耗3.2 g,则该段时间内用反应物表达的平均反应速率为___________ml·L-1·min-1
②该反应达到平衡时,某物理量(Y)随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA___________ KB(填“>”“<"或“=”)。纵坐标可以表示的物理量有___________填字 母序号)。
a.H2的逆反应速率
b.CH4的的体积分数
c.混合气体的平均相对分子质量
d.混合气体的密度
35.(15分)GaN是研制微电子器件、光电子器件的第三代半导体材料。
(1)基态Ga的核外电子排布为[Ar]3dl04s24p',转化为下列激发态时所需能量最少的是
(2)与镣同主族的B具有缺电子性,硼2化钠(NaBH4)是冇机 合成中重要的还原剂,其阴离子田七的立体构型为 。另一种含硼的阴离子[B4O5(OH)j的结构如图所示,其中B原子的杂化方式为 。
(3)GaN、GM,、GaAs爆融状态均不导电,据此判断它们是 (填“共价”或“离子”) 化介物。它们的品体结构与金刚石州似,其粉点如下表所示,试分析GaN、GaP、 GaAs增点依次降低的原因。
(4)GaAs的晶胞结构如图甲所示,将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料
如图乙所示。
②图乙中,a、b的分数坐标分别为(0,0,0)和(1,1,0),则c点Mn的分数坐标为 . 摻杂Mn之后,品体中Mn、Ga、As的原子个数比为 。
①图甲中,GaAs的相对分子质最为晶体密度为pg・cm-3, M表示阿伏伽德罗常 数的值,则晶胞中距离最近的两个Ga原子间距离为 nm (列出计算式)。
36.[化学——选修5:有机化学基础](15分)
化合物G俗称依普黄酮,是一种抗骨质疏松药物的主要成分。以甲苯为原料合成该化合物的路线如下图所示。
已知:①G的结构简式为
②RCOOH++H2O
(1)反应①的反应条件为 ,反应②的反应类型为 。
(2)化合物H用习惯命名法命名为 。
(3)E与足量的H2,完全加成后所生成的化合物中手性碳原子(连接四个不同原子或基团)的个数为 。
(4)已知N为催化剂,则E+HC(OC2H5)3→F的化学方程式为 。
(5)D有多种同分异构休,同时满足下列条件的同分异构体的数目为_______。
①芳香族化合物;②可与金属Na反应产生氢气;③能与银氨溶液发生银镜反应。
(6)根据上述信息,设计以苯酚和乙苯为原料,制备的合成路线 (无机试剂任选)。
。
化学参考答案
27.C2O3+SO32-+4H+=2C2++SO42-+2H2O 将Fe2+氧化成Fe3+ Cl2 5.2≤pH<7.6 除去溶液中的Mn2+ B 降低烘干温度,防止产品熔化或分解失去结晶水变为无水氯化钴
【来源】湖南省怀化市2019届高三3月第一次模拟考试理科综合化学试题
【解析】
【分析】
含钴废料中加入盐酸和亚硫酸钠,可得CCl2、AlCl3、FeCl2、MnCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CCl2,为得到CCl2•6H2O晶体,应控制温度在86℃以下蒸发,加热时要防止温度过高而失去结晶水,可减压烘干。
【详解】
(1)水钴矿的主要成分为C2O3,加入盐酸和亚硫酸钠,浸出液含有C2+,所以C2O3和亚硫酸钠在酸性条件下发生氧化还原,根据电荷守恒和得失电子守恒,反应的离子方程式为:C2O3+SO32-+4H+=2C2++SO42-+2H2O;
(2)NaClO3的作用是将Fe2+氧化成Fe3+,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;在酸性条件下,过量NaClO3与氯离子发生氧化还原反应生成氯气;
(3)Fe3+完全水解的pH为3.7,Al3+完全水解的pH为5.2,C2+开始水解的PH为7.6,所以为了除去Fe3+、Al3+,加入Na2CO3调pH应控制的范围为5.2≤pH<7.6;
(4)根据流程图可知,存在Mn2+、C2+金属离子的溶液中,加入萃取剂的目的是除去溶液中的Mn2+;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,故选B;
(5)根据题意知,CCl2•6H2O常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴,为防止其分解,制得的CCl2•6H2O需减压烘干。
28.【答案】(1) -25 I 因为该反应正向放热,升高温度,平衡逆向移动,K减小,lgK减小 25% cd
(2) 0.006 < bc
【解析】(1)①已知I.C(s) +CO2(g) =2CO(g) =+172.5kJ·ml-1
II.Fe2O3(s) +CO(g)2FeO(s)+CO2(g) =-3kJ·ml-1
III.FeO(s) +CO(g)Fe(s) +CO2(g) =-11kJ ·ml-1
根据盖斯定律,由Ⅱ+Ⅲ×2得反应IV.Fe2O3 (s) +3CO(g)2Fe(s)+3CO2(g),则 ,故答案为:-25;
②因为该反应正向放热,升高温度,平衡逆向移动,K减小,lgK减小,图中能表示该反应的平衡常数对数值(1g K) 与温度的关系的是Ⅰ,故答案为:I;因为该反应正向放热,升高温度,平衡逆向移动,K减小,lgK减小;
③1500℃时,lgK=0,则K==1,根据反应Fe2O3 (s) +3CO(g)2Fe(s)+3CO2(g),则参与反应的CO和剩余的CO相等,在某体积可变的密闭容器中按物质的量比2∶3加入Fe2O3 和CO,设CO为3ml,则Fe2O3为2ml,反应消耗CO为1.5ml,则消耗Fe2O3为0.5ml,平衡时Fe2O3的转化率=;
a.对体系加压,平衡向气体体积缩小的逆反应方向移动,Fe2O3转化率减小,a项错误;
b.升高反应体系的温度,平衡逆向移动,Fe2O3转化率减小,b项错误;
c.加入适量的Na2O 固体与二氧化碳反应,平衡正向移动,Fe2O3转化率增大,c项正确;
d.增大CO 在原料中的物质的量比,更多的Fe2O3消耗,转化率增大,d项正确;
故答案为:25%;cd;
(2)①Fe2O3在反应中质量减少3.2g,其物质的量为=0.02ml,根据Fe2O3(s)+3CH4(g)2Fe(s)+ 3CO(g) +6H2(g)可知,消耗0.02ml Fe2O3生成0.06ml CO,则该段时间内CO的平均反应速率为= 0.006ml·L-1·min-1,故答案为:0.006;
②该反应是吸热反应,升温平衡正向移动,平衡常数增大,则KA<KB;
a.H2的逆反应速率随温度的升高而增大,a项错误;
b.升温平衡正向移动,CH4的体积分数减小,b项正确;
c.升温平衡正向移动,气体的质量增加,而气体的物质的量增大,气体物质的量增大的大于气体质量增加的,所以混合气体的平均相对分子质量减小,c项正确;
d.升温平衡正向移动,气体的质量增加,但是容器体积不变,则混合气体的密度增大,d项错误;
故答案为:<;bc。
35.
36. (15分,除标注外,每空2分)
(1)光照 取代反应 (2)间苯二酚 (3)4
(4)
(5)17
(6)(3分)物质
GaN
GaP
GaAs
熔点/°c
1700
1480
1238
2024遂宁射洪中学高三上学期入学考试理综物理试题含解析: 这是一份2024遂宁射洪中学高三上学期入学考试理综物理试题含解析,文件包含四川省遂宁市射洪中学校2023-2024学年高三上学期入学考试理综物理试题含解析docx、四川省遂宁市射洪中学校2023-2024学年高三上学期入学考试理综物理试题无答案docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。
2023-2024学年四川省遂宁市射洪中学高三上学期入学考试理综物理试题(解析版): 这是一份2023-2024学年四川省遂宁市射洪中学高三上学期入学考试理综物理试题(解析版),文件包含四川省遂宁市射洪中学校2023-2024学年高三上学期入学考试理综物理试题Word版含解析docx、四川省遂宁市射洪中学校2023-2024学年高三上学期入学考试理综物理试题Word版无答案docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。
四川省遂宁市射洪中学2022-2023学年高二物理上学期第一次月考试题(10月)(Word版附答案): 这是一份四川省遂宁市射洪中学2022-2023学年高二物理上学期第一次月考试题(10月)(Word版附答案),共8页。试卷主要包含了考试结束后,将答题卡交回等内容,欢迎下载使用。












