





人教版 (2019)必修 第一册第二节 离子反应授课课件ppt
展开
这是一份人教版 (2019)必修 第一册第二节 离子反应授课课件ppt,共31页。PPT课件主要包含了知识铺垫,新知预习,自主测试,探究一,探究二,素养脉络,随堂检测,答案B,答案C等内容,欢迎下载使用。
1.复分解反应是指两种化合物互相交换成分,生成另外两种化合物的反应。其发生的条件为生成沉淀、放出气体或生成水。2.写出a.H2SO4、b.NaOH、c.BaCl2在水溶液中的电离方程式:
(1)a和b两溶液混合后发生反应的化学方程式为H2SO4+2NaOH=Na2SO4+2H2O;(2)a和c两溶液混合后发生反应的化学方程式为H2SO4+BaCl2=2HCl+BaSO4↓;(3)b和c两溶液混合不能(填“能”或“不能”)发生复分解反应,原因是二者混合无气体、沉淀或水生成。
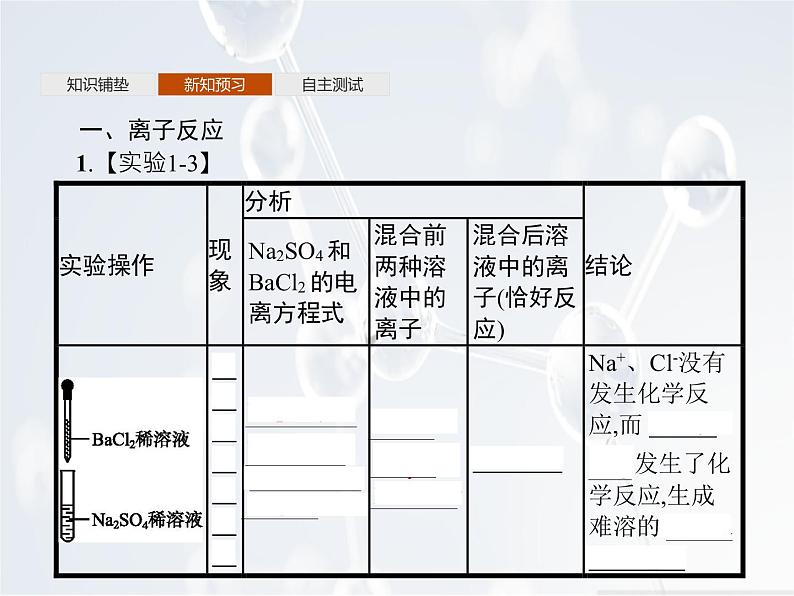
一、离子反应1.【实验1-3】
2.离子反应:电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。3.离子反应的表示方法——离子方程式(1)定义:用实际参加反应的离子符号来表示反应的式子。(2)书写步骤(以Na2SO4溶液与BaCl2溶液的反应为例)①写——写出化学方程式:Na2SO4+BaCl2=BaSO4↓+2NaCl。②拆——把易溶于水且易电离的物质写成离子形式,难溶的物质、气体和水等仍用化学式表示:2Na++S +Ba2++2Cl-=BaSO4↓+2Na++2Cl-。③删——删去方程式两边不参加反应的离子,并将方程式化为最简:S +Ba2+=BaSO4↓。④查——检查离子方程式两边各元素的原子个数和电荷总数是否相等。
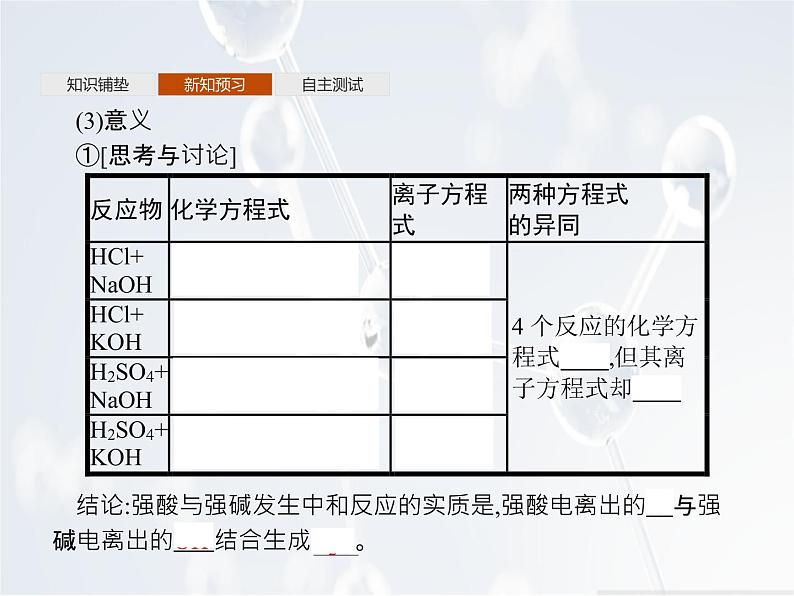
(3)意义①[思考与讨论]
结论:强酸与强碱发生中和反应的实质是,强酸电离出的H+与强碱电离出的OH-结合生成H2O。
②离子方程式的意义离子方程式不仅可以表示某个具体的化学反应,还可以表示同一类型的离子反应。【微思考】离子方程式H++OH-=H2O只能表示强酸与强碱间发生的中和反应吗?提示H++OH-=H2O还能表示某些盐与强碱间的复分解反应,如反应NaHSO4+NaOH=Na2SO4+H2O等。
二、离子反应的类型及发生反应的条件1.类型:复分解反应和置换反应等。2.复分解反应类型的离子反应发生的条件
1.下列各组物质相互混合后,不会发生离子反应的是 ( )A.Na2SO4溶液和MgCl2溶液B.Na2CO3溶液和稀硫酸C.NaOH溶液和Fe2(SO4)3溶液D.Ca(OH)2溶液和盐酸答案A解析B项中C 和H+发生离子反应;C项中Fe3+和OH-发生离子反应;D项中OH-和H+发生离子反应。
2.下列离子方程式书写正确的是( )A.盐酸与碳酸钡反应:
B.硫酸铜溶液中滴加氢氧化钠溶液:2OH-+Cu2+=Cu(OH)2↓C.SO3溶于水:SO3+H2O=H2SO4D.锌与稀盐酸反应:Zn+H+=Zn2++H2↑
答案B解析A项中碳酸钡不能拆写成C 和Ba2+;C项中H2SO4未拆成离子形式;D项中离子方程式未配平。
离子方程式的书写与正误判断 问题探究1.判断下列离子方程式的正误,并指出错误的原因。
(1)盐酸与Cu(OH)2反应:H++OH-=H2O( )(2)CuO溶于盐酸:O2-+2H+=H2O( )(3)Na2CO3溶液与稀硫酸反应:Na2CO3+2H+=2Na++CO2↑+H2O( )(4)CuSO4溶液与Ba(OH)2溶液反应:Cu2++2OH-=Cu(OH)2↓( )(5)CO2通入澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O( )
(6)NaHCO3溶液与稀硫酸反应:C +2H+=CO2↑+H2O( )
(7)Fe与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑( )(8)Cu与AgNO3溶液反应:Cu+Ag+=Ag+Cu2+( )提示(1)错误,Cu(OH)2为难溶物,不能拆成Cu2+和2OH-。(2)错误,CuO为氧化物,不可拆成Cu2+和O2-。
(7)错误,Fe与盐酸反应生成Fe2+。(8)错误,反应前后电荷不守恒。
深化拓展1.离子方程式的书写关键书写离子方程式的关键是“拆”,且要“拆”得合理。(1)熟记可“拆”的强酸、强碱和易溶盐。有关盐的溶解性口诀:钾钠铵盐都可溶,硝酸盐遇水无影踪,硫酸盐不溶硫酸钡,氯化物不溶氯化银。(2)不能拆成离子的物质:难溶的物质、弱酸、弱碱、水(难电离的物质)、气体、单质、氧化物。2.离子方程式正误判断的方法(1)看离子反应是否符合客观事实。不可主观臆造产物及反应,如2Fe+6H+=2Fe3++3H2↑就不符合客观事实。
(2)看表示各物质的化学式是否正确。 如多元弱酸的酸式酸根离子在离子方程式中不能拆开写,而
(3)看是否漏掉离子反应。如Ba(OH)2溶液与CuSO4溶液反应,既要写Ba2+与S 的离子反应,又要写Cu2+与OH-的离子反应。(4)看质量及电荷是否守恒。如AgNO3溶液与Cu反应,不能写成Ag++Cu=Cu2++Ag,而应写成2Ag++Cu=Cu2++2Ag。(5)看反应物或产物的配比是否正确。
归纳总结(1)可拆为离子的物质①强酸:HCl、H2SO4、HNO3等。②强碱:NaOH、KOH、Ca(OH)2、Ba(OH)2等。③可溶性盐:NaCl、Na2SO4、NH4Cl等。(2)不可拆为离子的物质①单质:Cl2、Fe、Na等。②氧化物:Na2O、CaO、CO2等。③弱酸:H2CO3、CH3COOH、HClO、HF、H2S等。④弱碱:NH3·H2O、Fe(OH)3、Cu(OH)2等。⑤难溶物:AgCl、CaCO3、BaCO3等。⑥水。
素能应用典例1写出下列反应的离子方程式。(1)KOH溶液和HCl溶液反应: ; (2)Ba(OH)2溶液和H2SO4溶液反应: ; (3)Na2CO3溶液和HNO3溶液反应: 。
解析书写离子方程式时,要严格按照“写、拆、删、查”四个步骤进行。在熟练之后,提倡直接写出离子方程式。在书写过程中,要特别注意易溶、易电离的物质,如:HCl、H2SO4、HNO3、KOH、Ba(OH)2、NaOH及钠盐、钾盐、硝酸盐等可溶性盐,要用离子符号表示,而H2O、BaSO4、CaCO3、CO2、MgO等要用化学式表示。
变式训练1铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
A.OH-+HCl=H2O+Cl-B.Ca(OH)2+Cu2+=Ca2++Cu(OH)2↓C.Fe+Cu2+=Cu+Fe2+D.2Fe+6H+=2Fe3++3H2↑
答案C解析A处是澄清石灰水与稀盐酸的反应,离子方程式应为OH-+H+=H2O,故A项错误;B处是澄清石灰水与氯化铜溶液的反应,离子方程式应为2OH-+Cu2+=Cu(OH)2↓,故B项错误;C处是铁与氯化铜溶液的反应,离子方程式应为Fe+Cu2+=Cu+Fe2+,故C项正确;D处是铁与稀盐酸的反应,离子方程式应为Fe+2H+=Fe2++H2↑,故D项错误。
离子共存的判断问题探究
(1)在酸性条件下,一定不能大量共存的有 (填序号,下同)。 (2)在碱性条件下,一定不能大量共存的有 。 (3)在无色溶液中,一定不能共存的有 。 (4)在含有 Ba2+的溶液中,一定不能大量共存的有 。
深化拓展1.离子之间反应的条件同一溶液中,若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存。
2.离子共存问题中易忽视的三类隐含条件
素能应用典例2下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )
变式训练2某无色溶液中,可大量共存的离子组是( )
答案A解析B项,无色溶液中Cu2+不能大量存在;C项,H+与C 不能大量共存;D项,Mg2+与OH-不能大量共存。
1.下列各组物质间的反应中,不属于离子反应的是( )A.Zn+H2SO4(稀)B.NaCl溶液+AgNO3溶液C.C+O2 D.Fe+CuSO4溶液答案C解析A、B、D选项中的反应都是在溶液中进行的反应,且每一组中都有离子参与反应,所以都是离子反应;C与O2反应无论产物是CO还是CO2,都不是电解质在溶液中进行的反应,不属于离子反应。
2.下列各组离子能在溶液中大量共存的是( )
3.下列同组中的两个不同反应(在溶液中进行),可用同一离子方程式表示的是( )A.Na2CO3+HNO3与NaHCO3+HNO3B.CaCl2+Na2CO3与Ca(NO3)2+K2CO3C.Ba(OH)2+NaHSO4与BaCl2+NaHSO4D.NaOH+H2SO4与Fe(OH)3+H2SO4答案B
4.下列离子方程式正确的是( )A.大理石溶于盐酸的反应:CaCO3+2H+=Ca2++CO2↑+H2OB.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++AgC.向稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑D.盐酸跟氢氧化镁反应:H++OH-=H2O答案A解析A项中CaCO3为不溶物,应写化学式,而盐酸完全电离,应拆成离子,A项正确;B项中电荷不守恒,正确的离子方程式应为Cu+2Ag+=2Ag+Cu2+;C项Fe与稀硫酸反应生成FeSO4、H2,选项中离子方程式与事实不相符,正确的离子方程式应为Fe+2H+=Fe2++H2↑;D项中Mg(OH)2为难溶物,应写化学式,故B、C、D项错误。
5.(1)向CuCl2溶液中滴加NaOH溶液,现象是 ,离子方程式: 。 (2)向NaHCO3溶液中滴加稀硫酸,现象是 ,离子方程式: 。 (3)稀硝酸与KOH溶液混合,现象是 ,离子方程式: 。 (4)上述三个反应均属于 (填基本反应类型)反应,反应发生条件的不同点是第一个生成 ,第二个生成 ,第三个生成 。
相关课件
这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应教课内容课件ppt,共39页。PPT课件主要包含了交换离子等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应教学ppt课件,共39页。PPT课件主要包含了交换离子等内容,欢迎下载使用。
这是一份高中人教版 (2019)第二节 离子反应背景图课件ppt,共49页。PPT课件主要包含了自主预习·新知导学,合作探究·释疑解惑,课堂小结,完成下表,2拆分原则等内容,欢迎下载使用。










