












高中化学人教版 (2019)必修 第一册第三章 铁 金属材料第二节 金属材料集体备课课件ppt
展开
这是一份高中化学人教版 (2019)必修 第一册第三章 铁 金属材料第二节 金属材料集体备课课件ppt,文件包含第三章第二节金属材料课时1pptx、2金属材料pptx等2份课件配套教学资源,其中PPT共37页, 欢迎下载使用。
问题2:
为什么我们日常使用的大部分金属材料都是合金?
合金是由两种或两种以上的______________________熔合而成的具有_______特性的物质。
问题1:
金属材料包括纯金属和它们的合金,什么是合金?
金属(或金属和非金属)
合金具有许多优良的物理、化学或机械性能。合金的硬度、熔点不同于其各成分金属。合金的性能可以通过所添加的合金元素的种类、含量和生成合金的条件等来调节,可满足不同的需要,因此合金在工业上具有比纯金属更广泛的用途。
(1)合金的硬度比其成分金属 ,机械性能一般____各成分金属。(2)合金的熔点一般______它的各成分金属。
合金与纯金属的性能差异
(3)合金的导电性和导热性低于任一组分金属。利用合金的这一特性,可制造高电阻和高热阻材料,制造有特殊性能的材料。(4)有的抗腐蚀能力强(如不锈钢),在铁中掺入15%铬和9%镍得到一种耐腐蚀的不锈钢,适用于化学工业。
问题3:
为什么合金的硬度比成分金属大?
1、下列关于合金的叙述正确的是( )
①具有金属的特性 ②通过熔合而成
③含有两种或两种以上金属或金属与非金属
④一般来说,合金的熔点比各成分的熔点低A.①②B.③④ C.②③④D.全部
【解析】合金一般是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质,其熔点一般低于成分金属,硬度高于成分金属。
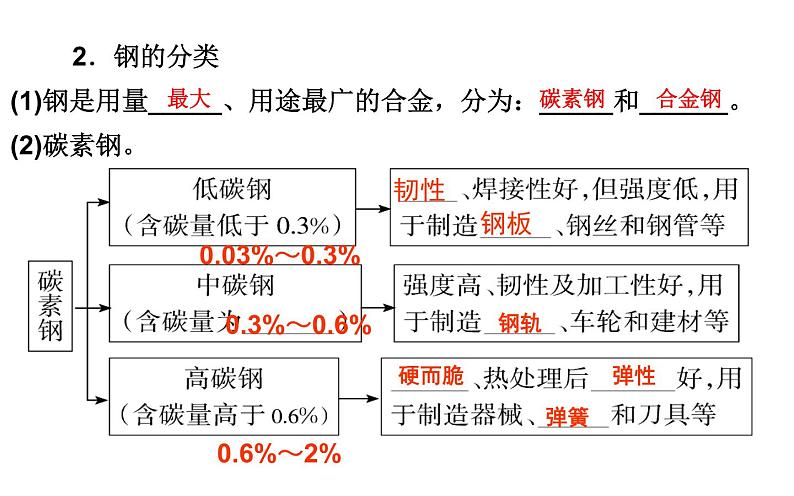
2.钢的分类
(1)钢是用量_____、用途最广的合金,分为:_____和______。(2)碳素钢。
0.03%~0.3%
(3)合金钢。
①又叫特种钢,特殊性能:强度、_____大,可塑性、____好,耐磨,________等。
②不锈钢
含铬17%~19%
含镍8%~13%
思考:阅读书本P74资料卡片
2、在碳素钢中,由于含碳量不同,高碳钢、中碳钢和低碳钢的性能有很大差异;向碳素钢中加入不同的合金元素,可制得不同性能的合金钢。这对你有什么启示?
1、合金元素不同,其性能不同2、结构决定性能,性能决定其用途3、改变合金元素来开发新功能的金属材料
1、碳素钢的含碳量的高低与其硬度、韧性有何关系?
【答】碳素钢的含碳量越高,硬度越大;
含碳量越低,韧性越好。
2018年,王国栋所在的东北大学轧制技术及连轧自动化国家重点实验室,在国际上率先研发出2000MPa级汽车用热冲压用高强钢;在液化天然气低温容器用钢上,世界上普遍采用的材料是9Ni(镍)钢,在保证钢材性能的前提下,实验室与企业合作,用5Ni钢做出了9Ni钢的性能,大幅节约了成本。在生产工艺上,研发出薄带连铸、无头轧制等新流程、新工艺,正在向企业转化,可应用于多个重要钢种的生产。
银白色金属、密度小、质软,熔点低、良好的导电导热性和延展性。
2、铝的原子结构与化学性质
画出铝的原子结构示意图为:
K Ca Na Mg Zn Fe Sn Pb H Cu Hg …
Al的化学性质活泼,具有较强的还原性。
问题3:Al的化学性质活泼,为什么不易被氧化呢?
铝箔熔化,表面失去光泽,熔化的铝并不滴落,好象有一层膜兜着
因为铝表面有一层氧化膜保护了铝。构成膜的氧化铝(Al2O3)的熔点很高,没有熔化,包在外面使熔化的液态铝不会滴落下来。
活泼的金属在空气中易与氧气反应,生有一层氧化物。有的氧化膜疏松,不能保护内层金属,如铁和钠等。有的氧化物致密,可以保护内层金属不被继续氧化,如镁和铝等。
在一支试管,加入5mL盐酸,再向试管中放入一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象?
实验表明,铝表面的保护膜和铝均能与盐酸发生反应。
Al2O3 + 6HCl = 2AlCl3 + 3H2O2Al + 6HCl = 2AlCl3 + 3H2↑
写出以上实验发生的化学反应方程式
取两支试管,分别加固5mLNaOH溶液,再向试管中分别放入铝片和打磨过的铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象
问题4:为什么铝锅是不能存放碱性溶液的?
放入打磨过的铝片的试管中立即产生气泡;而放入未打磨过的铝片的试管中开始没有气泡,一段时间后才产生气泡。两只试管中均放出一种可燃性的气体。
实验表明,铝表面的保护膜和铝均能与NaOH发生反应
Al2O3 + 2NaOH = 2NaAlO2 + H2O2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2 ↑ (偏铝酸钠)
写出氧化铝与盐酸,氧化铝与氢氧化钠溶液反应的
离子方程式。
Al2O3 + 2OH- = 2AlO2- + H2OAl2O3 + 6H+ = 2Al3+ + 3H2O
像氧化铝这样既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,叫做两性氧化物 。
由于铝和氧化铝均能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
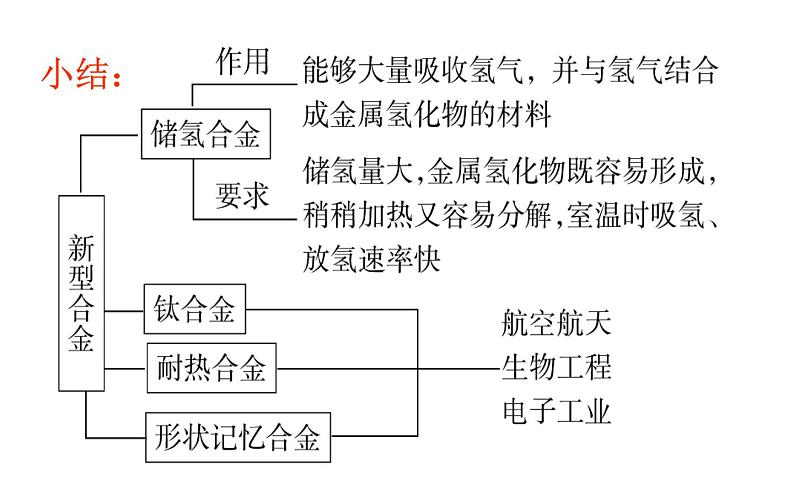
3.铝合金(1)铝合金中的合金元素有:___、____、Si、Mn、Zn及________等。
(3)稀土元素。包含元素:镧系元素(从镧到镥,原子序数从57~71的15种元素)及_____、____共17种元素。
【解析】车厢大部分采用铝合金材料制造,这是因为铝合金具有质地轻、强度大、抗腐蚀能力比较强的优点,A正确;铝合金的化学性质的确比较活泼,但与被用于制造高铁车厢没有必然联系,B错误;
2.哈大齐高铁的通车,标志我国高寒地区高铁技术领先世界,车厢大部分采用铝合金材料制造,这是因为铝合金( )A.质地轻,强度大,抗腐蚀能力比较强B.具有比较活泼的化学性质C.各种成分在自然界中含量丰富,容易获取D.比纯铝熔点高,耐高温
铝元素在地壳中含量居第三位,含量比较丰富,但因铝性质活泼,只能采用电解法制取,成本较高,并不容易获得,C错误;铝合金的熔点比纯铝的低,D错误。
3、Al(OH)3既能与酸反应,生成铝盐( Al3+ ),又能与碱反应生成偏铝酸盐( AlO2- ),属于两性氢氧化物,试写出Al(OH)3与盐酸、氢氧化钠溶液反应的离子方程式。
Al(OH)3 +3H+ = Al3++3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
相关课件
这是一份人教版 (2019)必修 第一册第二节 金属材料集体备课课件ppt,共43页。
这是一份高中化学人教版 (2019)必修 第一册第二节 金属材料集体备课ppt课件,共18页。PPT课件主要包含了铁合金,铝合金,新型合金,示为+4H2O等内容,欢迎下载使用。
这是一份化学必修 第一册第二节 金属材料授课ppt课件,文件包含322物质的量在化学方程式计算中的应用pptx、课件1321常见的合金及应用pptx、铝与盐酸和氢氧化钠溶液的反应mp4等3份课件配套教学资源,其中PPT共37页, 欢迎下载使用。










