




第一单元 溶液 整合 同步练习2021-2022 鲁教版 化学九年级 全一册
展开
第一单元 溶液
易错分类归纳
易错点一 对溶液形成与特征的认识错误
典例1:判断下列描述的正误(正确的打“√”,错误的打“×”)
1.均一、稳定的液体一定是溶液(×)
2.溶液不一定是无色的(√)
3.溶质可以是固体,也可以是液体或气体(√)
4.溶液加水稀释后溶质的质量减少(×)
5.洗涤剂能洗掉餐具上的油污,因为洗涤剂能溶解油污形成溶液(×)
错因分析
1.溶液是一种或几种物质溶解到另一种物质中形成的均一、稳定的混合物。
2.溶液不一定是无色的,如硫酸铜溶液是蓝色的。
3.均一、稳定的液体不一定是溶液,如蒸馏水是纯净物,不属于溶液。
4.长期放置后不会分层的液体不一定是溶液,例如蒸馏水等纯净物。
5.洗涤剂能洗掉餐具上的油污,是因为洗涤剂具有乳化作用,不是溶解。
易错点二 对饱和溶液及溶解度概念的理解错误
典例2:判断下列描述的正误(正确的打“√”,错误的打“×”)
1.饱和溶液中一定不能再溶解其他物质(×)
2.降低温度一定能使不饱和溶液变为饱和溶液(×)
3.饱和溶液的溶质质量分数一定大于不饱和溶液(×)
4.20 ℃时,把36 g氯化钠放入64 g水中,使其充分溶解(20 ℃时氯化钠的溶解度为36 g),所得溶液是饱和溶液(√)
5.搅拌可增大物质的溶解度(×)
错因分析
1.饱和溶液是指在一定温度下、一定量的溶剂里,不能继续溶解这种溶质的溶液,饱和溶液中还能再溶解其他物质。
2.由于没有指明温度、溶液的质量,所以饱和溶液不一定比不饱和溶液含溶质多。
3.20 ℃时氯化钠的溶解度为36 g ,则36 g氯化钠放入64 g水中,没有全部溶解,该溶液是饱和溶液。
4.溶解度是在一定温度下,某固体溶质在100 g溶剂里达到饱和状态所溶解的溶质质量,搅拌不能增大物质的溶解度。
考点定向突破
考点一 溶液的形成
典例1:(2021·苏州中考改编)下列有关溶液的说法正确的是(C)
A.均一、稳定的液体都是溶液
B.少量泥土与水混合能形成溶液
C.氢氧化钠溶液的导电性比水强
D.硝酸铵与水混合会放出大量的热
解析:溶液是一种混合物,均一、稳定的液体不一定都是溶液,如水,A错误;泥土难溶于水,泥土与水不能形成溶液,B错误;氢氧化钠溶液中存在着大量能够自由移动的钠离子与氢氧根离子,导电性比水强,C正确;硝酸铵溶于水会吸收大量的热,D错误。
1.判断某物质是否是溶液,一般从以下两个方面来判断
(1)是否是混合物;
(2)是否具有均一性和稳定性。
2.溶解与乳化:
洗涤剂去除油污属于乳化,汽油去除油污属于溶解。
3.氢氧化钠溶于水放热,硝酸铵溶于水吸热,氯化钠溶于水温度基本不变。
1.(2021·云南中考)把少量下列物质分别放入水中,充分搅拌,可得到溶液的是(D)
A.牛奶 B.面粉
C.花生油 D.葡萄糖
解析:牛奶放入水中不均一、不稳定,不属于溶液,A错;面粉不溶于水,与水混合形成不均一、不稳定的悬浊液,B错;花生油不溶于水,与水混合形成不均一、不稳定的乳浊液,C错;葡萄糖易溶于水,形成均一、稳定的混合物,属于溶液,D正确。
2.(2021·衡阳中考)下列有关溶液的说法正确的是(B)
A.盐酸中溶质是食盐
B.溶液不一定是无色的
C.饱和溶液升温后一定变成不饱和溶液
D.加入蔗糖溶解后,水的导电性明显增强
解析:A.盐酸是氯化氢气体的水溶液,盐酸中溶质是氯化氢,故选项说法错误。B.溶液不一定是无色的,如硫酸铜溶液是蓝色的,故选项说法正确。C.有些物质的溶解度随着温度的升高而减小,温度升高,溶解度减小,溶液仍为饱和溶液,饱和溶液升温后不一定变成不饱和溶液,故选项说法错误。D.蔗糖是由蔗糖分子构成的,加入蔗糖溶解后,水的导电性几乎不变,故选项说法错误。
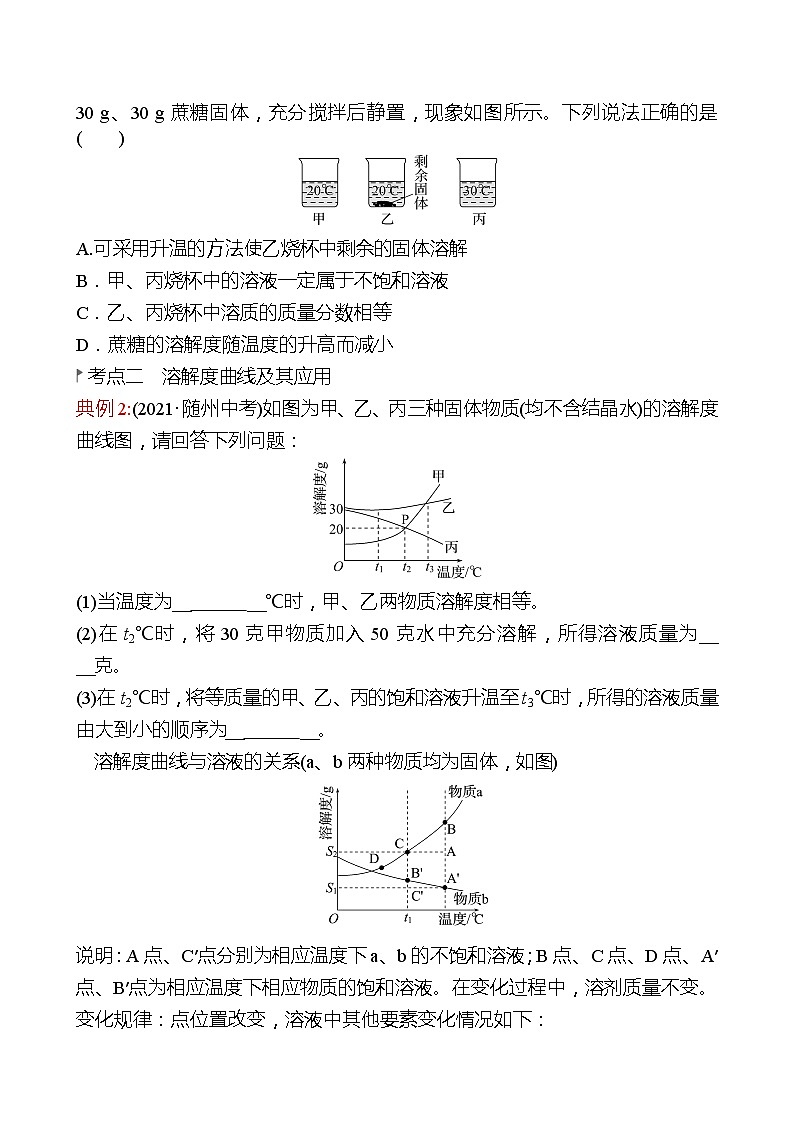
3.(2021·连云港中考)向盛有等质量水的甲、乙、丙三个烧杯中分别加入15 g、30 g、30 g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法正确的是(A)
A.可采用升温的方法使乙烧杯中剩余的固体溶解
B.甲、丙烧杯中的溶液一定属于不饱和溶液
C.乙、丙烧杯中溶质的质量分数相等
D.蔗糖的溶解度随温度的升高而减小
解析:向盛有等质量水的乙、丙烧杯中分别加入30 g蔗糖固体,充分搅拌后静置,乙中蔗糖有剩余,丙中蔗糖能全部溶解,丙中温度高,可见,蔗糖的溶解度随温度的升高而增大,则可采用升温的方法使乙烧杯中剩余的固体溶解,A正确,D错误。甲中蔗糖能全部溶解,丙中蔗糖能全部溶解,甲、丙烧杯中的溶液不一定属于不饱和溶液,也可能是恰好饱和的溶液,B错误。乙、丙烧杯中溶剂质量相等,丙中溶质的质量多,则乙、丙烧杯中溶质的质量分数不相等,C错误。
考点二 溶解度曲线及其应用
典例2:(2021·随州中考)如图为甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线图,请回答下列问题:
(1)当温度为__t3__℃时,甲、乙两物质溶解度相等。
(2)在t2℃时,将30克甲物质加入50克水中充分溶解,所得溶液质量为__60__克。
(3)在t2℃时,将等质量的甲、乙、丙的饱和溶液升温至t3℃时,所得的溶液质量由大到小的顺序为__甲=乙>丙__。
解析:(1)由图像可得,t3℃时甲、乙两物质的溶解度曲线相交于一点;(2)由图像可知,t2℃时甲物质的溶解度为20 g,即在t2℃时,在100 g水中达到饱和状态时所溶解的甲物质的质量为20 g,故在t2℃时50 g水中达到饱和状态时所溶解甲物质的质量为10 g,加入的30克甲物质中,只有10 g可溶解,剩余20 g未溶解,未溶解的物质不能作为溶液中溶质的质量;(3)由图像可知,甲、乙两物质的溶解度随温度的升高而增大,丙物质的溶解度随温度的升高而降低,故将t2℃时等质量的甲、乙、丙的饱和溶液升温至t3℃时,丙物质的溶解度减小,此过程中有溶质析出,溶液质量减少,而甲、乙两物质的溶液中无溶质析出,溶液质量不变。
溶解度曲线与溶液的关系(a、b两种物质均为固体,如图)
说明:A点、C′点分别为相应温度下a、b的不饱和溶液;B点、C点、D点、A′点、B′点为相应温度下相应物质的饱和溶液。在变化过程中,溶剂质量不变。
变化规律:点位置改变,溶液中其他要素变化情况如下:
位置 变化 | 要素变化 | ||||
温度 变化 | 溶解度 的变化 | 溶液状 态的变化 | 溶质质 量变化 | 溶质质 量分数 变化 | |
A→B | 不变 | 不变 | 不饱和 →饱和 | 增大 | 变大 |
A→C | 降低 | 变小 | 不饱和 →饱和 | 不变 | 不变 |
B→C | 降低 | 变小 | 不变 | 减小 | 变小 |
D→C | 升高 | 变大 | 不变 | 增大 | 变大 |
C'→B' | 不变 | 不变 | 不饱和 →饱和 | 增大 | 变大 |
A'→ C' | 降低 | 变大 | 饱和 →不饱和 | 不变 | 不变 |
1.(2021·苏州中考)NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是(D)
A.KNO3的溶解度一定大于NaCl
B.NaCl的溶解度受温度影响的程度比KNO3大
C.40 ℃时,KNO3饱和溶液的溶质质量分数为63.9%
D.将60 ℃时210 g KNO3饱和溶液降温至20 ℃,析出KNO3晶体78.4 g
解析:A.在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度也不能确定,故A错误;B.氯化钠的溶解度曲线较平缓,所以NaCl的溶解度受温度影响的程度比KNO3小,故B错误;C.40 ℃时,硝酸钾的溶解度是63.9 g,所以KNO3饱和溶液的溶质质量分数为×100%≠63.9%,故C错误;D.60 ℃时,硝酸钾的溶解度是110 g,210 g KNO3饱和溶液中含有溶质110 g,溶剂100 g,降温至20 ℃,溶解度变成31.6 g,析出KNO3晶体110 g-31.6 g=78.4 g,故D正确。
2.(2021·衡阳中考)A、B、C三种固体物质的溶解度曲线如图所示。回答下列问题:
(1)P点的意义__在t1__℃时A和C两种物质的溶解度相等,都是20__g__。
(2)t2 ℃时分别把10 g A、B、C加入50 g水中,能形成饱和溶液的是__C__。
(3)将t1 ℃时A、B、C的饱和溶液分别升温到t2 ℃,所得溶液的溶质质量分数由大到小的顺序为__B>A>C__。
(4)A中混有少量的B,提纯A可采用的方法是__降温结晶__。(填“蒸发结晶”或“降温结晶”)
解析:(1)P点的意义是指:在t1 ℃时A和C两种物质的溶解度相等,都是20 g;(2)t2 ℃时,A和B的溶解度大于20 g,C物质的溶解度小于20 g,所以t2 ℃时分别把10 g A、B、C加入50 g水中,能形成饱和溶液的是C;(3)将t1 ℃时A、B、C的饱和溶液分别升温到t2 ℃,A和B的溶解度变大,由饱和变为不饱和,溶质质量分数不变,还是B>A,C物质升温后溶解度变小,析出晶体,溶质质量分数变小,所以升温后所得溶液的溶质质量分数由大到小的顺序为B>A>C;(4)由于A物质的溶解度受温度影响较大,所以提纯A的方法是降温结晶。
考点三 溶质质量分数及溶液的配制
典例3:(2021·长春中考)某实验小组用质量分数为6%的氯化钠溶液(密度约为1.04 g·cm-3)和水(密度约为1 g·cm-3)配制50 g质量分数为3%的氯化钠溶液,下列说法错误的是(D)
A.实验的主要步骤有计算、量取、混匀、装瓶贴标签
B.计算需要6%的氯化钠溶液的质量是25 g(约24.0 mL),水的质量是25 g
C.实验中用到的玻璃仪器有量筒、试剂瓶、烧杯、玻璃棒、胶头滴管
D.配制好的溶液装入试剂瓶时有液体溅出,溶质的质量分数变小
解析:A.用浓溶液配制稀溶液,实验步骤为计算、量取、混匀、装瓶贴标签,不符合题意;B.需要6%的氯化钠溶液的质量是50 g×3%÷6%=25 g,需要水的质量为50 g-25 g=25 g,不符合题意;C.实验过程中需要用到的玻璃仪器有量筒、胶头滴管、烧杯、玻璃棒、试剂瓶,不符合题意;D.配制好的溶液装入试剂瓶时有液体溅出,溶液具有均一性,溶质的质量分数不变,符合题意。
1.有关溶质的质量分数计算
(1)计算公式
溶质的质量分数=×100%,也可将公式变形为
溶质质量=溶液质量×溶质的质量分数
溶液质量=
(2)溶液的稀释
计算依据:稀释前后,溶质的质量不变
2.溶液配制的方法及步骤
配制 方法 | 用固体和水配制 | 用浓溶液和水配制 (浓溶液稀释) |
操作 步骤 | ①计算 ②称量 ③溶解 ④贮存 | ①计算 ②量取 ③混匀 ④贮存 |
常用 仪器 | 胶头滴管、托盘天平、烧杯、玻璃棒、量筒和药匙 | 量筒、烧杯、 玻璃棒、胶头滴管 |
1.(2021·金华中考)常温下,取100克质量分数为5%的NaCl溶液,先按实验1将NaCl溶液分成两等份,再进行实验2操作,如图所示。
完成下列问题:
(1)配制100 g质量分数为5%的NaCl溶液,不需要用到的仪器是__A__;
A.集气瓶 B.烧杯
C.玻璃棒 D.量筒
(2)完成实验2操作后,比较甲、乙两只烧杯中溶液的溶质质量分数,其大小关系是甲__小于__乙(选填“大于”“等于”或“小于”)。
解析:(1)配制100 g质量分数为5%的NaCl溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,在这些操作中需要的仪器:托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒,故不需要用到的仪器是集气瓶。(2)溶液具有均一性,实验1中甲、乙的溶质质量分数相等,向甲中加入5 g水,向乙中加入5 g氯化钠,甲中溶质质量分数减小,乙中溶质质量分数增大,则大小关系是甲小于乙。
2.(2021·岳阳中考)实验室配制50 g质量分数为3%的NaCl溶液,操作示意图如图。请回答:
(1)图中使用到的玻璃仪器有__烧杯__、量筒、玻璃棒、广口瓶四种。
(2)图示中正确的操作顺序为__②①⑤③④__(填序号)。
(3)溶解时用玻璃棒搅拌的目的是加快溶解速率。
(4)取10 g配制好的质量分数为3%的NaCl溶液,稀释成质量分数为1%的NaCl溶液,需加水__20__g。
解析:(1)图中使用到的玻璃仪器有烧杯、量筒、玻璃棒、广口瓶四种。(2)实验室配制50 g质量分数为3%的NaCl溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,图示中正确的操作顺序为②①⑤③④。(3)溶解时用玻璃棒搅拌的目的是加快溶解速率。(4)设要加水的质量为x,根据溶液稀释前后溶质的质量不变,则10 g×3%=(10 g+x)×1%,x=20 g。










