












鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应教学ppt课件
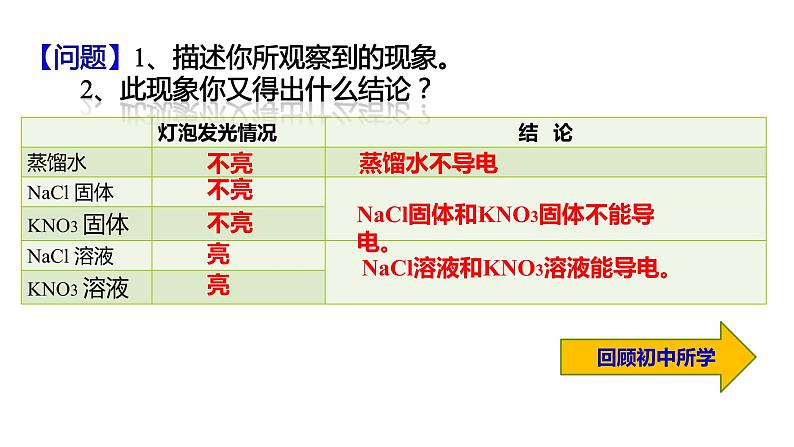
展开思考判断下列反应能否发生,如能发生,完成化学方程式,不能的话,说明理由 (1)KCl + NaNO3(2)Na2CO3 + Ca(OH)2 (3)NH4HCO3 + HCl (4)CuSO4 + KOH (5)CuSO4 + NaNO3
不能反应,无气体沉淀水生成
Na2CO3+Ca(OH)2 = 2NaOH + CaCO3
CuSO4 + 2KOH = K2SO4 + Cu(OH)2
NH4HCO3 + HCl = NH4Cl + H2O + CO2
这类反应是离子反应,要看它们混合后能否生成气体,沉淀或水,能生成,则表示能反应
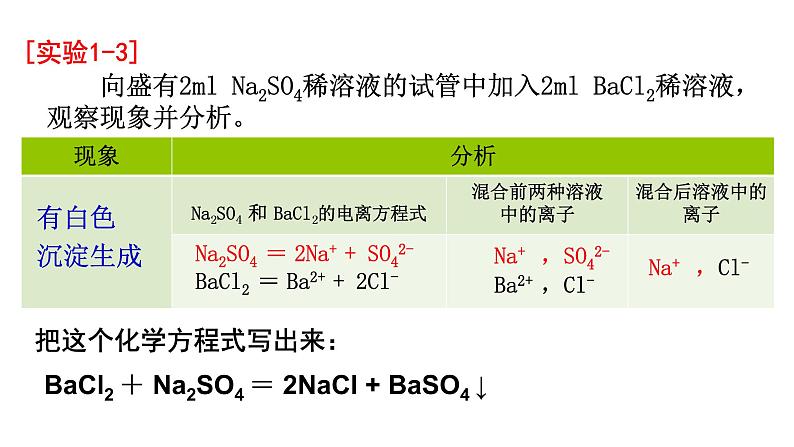
把这个化学方程式写出来:
BaCl2 + Na2SO4 = 2NaCl + BaSO4 ↓
向盛有2ml Na2SO4稀溶液的试管中加入2ml BaCl2稀溶液,观察现象并分析。
Na2SO4 = 2Na+ + SO42- BaCl2 = Ba2+ + 2Cl-
Na+ ,SO42- Ba2+ ,Cl-
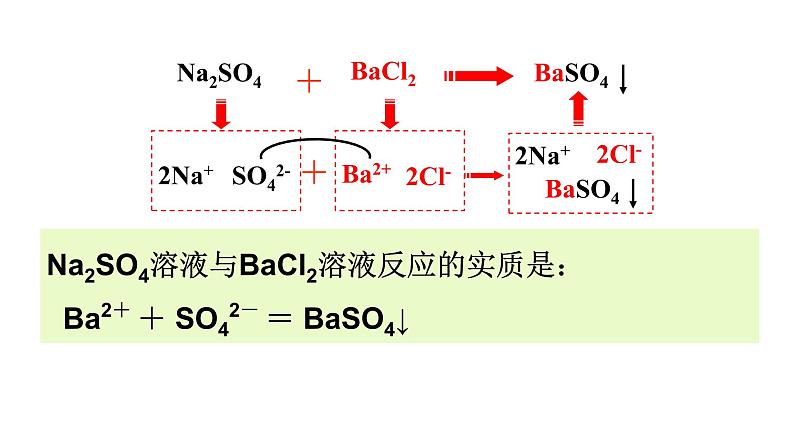
Na2SO4溶液与BaCl2溶液反应的实质是: Ba2+ + SO42- = BaSO4↓
1、有自由离子参加(或生成)的反应称离子反应
电解质在溶液中的反应实际上是离子反应
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4 ↓+ 2Na+ + 2Cl-
1、“写”--写出化学方程式:
3、离子方程式的书写步骤
3、“删” --删去方程式两边不参加反应的离子,并将方程式化简。
4、“查” --检查两边各元素的原子个数和电荷总数是否相等。
以Na2SO4溶液跟BaCl2溶液反应为例
Na2SO4 + BaCl2 = BaSO4 ↓ + 2NaCl
SO42- + Ba2+ = BaSO4 ↓
⑴凡非溶液中进行的反应一般不能写离子方程式
⑵单质、氧化物、难溶、难电离物质及气体、 在离子方程式中一律写化学式
书写离子方程式应注意的问题!
难溶物质【如CaCO3、BaSO3、FeS、BaSO4、Fe(OH)3等】写化学式。
⑴ 写:正确书写化学方程式
⑶ 删:删去方程式两边未参加反应的离子
⑷ 查:检查方程式两边是否遵守质量守恒和电荷守恒
CaCO3 + 2H+ + 2Cl- = Ca2+ + 2Cl- + H2O + CO2↑
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
例题:写出碳酸钙与盐酸溶液反应离子方程式
练习1.写出MnO2与浓盐酸反应离子方程式
写出下列反应的离子方程式
1、澄清石灰水中滴入HNO3溶液
H+ + OH- = H2O
2、Cu(OH)2溶于HCl 溶液
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
3、SO2气体溶于足量氢氧化钠溶液
SO2 + 2OH- = SO32- + H2O
4、CO2气体溶于足量澄清石灰水
NH3·H2O + H+ = NH4+ + 2H2O
CO2 + 2OH- + Ca2+ = CaCO3 ↓ + H2O
这四个反应都是中和反应,反应的化学方程式各不相同,但它们的离子方程式都是H+ + OH- = H2O ,这表明强酸与强碱发生中和反应的实质是酸电离出来的H+与碱电离出来的OH-结合生成H2O。
化学方程式表示的是某一个特定的化学反应,而离子方程式能表示同一类化学反应。
⑴能揭示反应的实质:离子间的反应。 ⑵不仅表示某一个反应,而且表示所有同一类型的离子反应。
4、离子方程式表示的意义
例如:H+ + OH- = H2O 可以表示所有强酸与强碱生成可溶性盐和水的中和反应。
上列反应的离子方程式均是:
表示稀H2SO4或可溶性硫酸盐与可溶性钡盐的反应
练习:写出下列三个反应的离子方程式
Ba2+ + SO42- = BaSO4 ↓
练习:写出下列离子方程式相应的一个化学方程式
⑴ CO32- + 2H+ = H2O + CO2↑
⑵ Cu2++ 2OH- = Cu(OH)2 ↓
⑶ Cu + 2Ag+ = Cu2+ + 2Ag+
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↑
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag+
5、离子方程式正误判断
1、看离子反应是否符合客观事实, 如Fe跟稀HCl反应:2Fe+6H+ = 2Fe3++3H2↑
2、看物质是否可拆,如 CaCO3跟稀 HCl反应: CO32- + 2H+ = CO2+H2O
3、看是否守恒(原子守恒、电荷守恒、电子守恒): 如:Cu + Ag+ = Cu2+ + Ag Na + H2O = Na+ + OH- + H2↑
4、看是否漏掉离子反应: 如稀CuSO4和Ba(OH)2 溶液反应, 写成:SO42- + Ba2+ = BaSO4↓
1、氢氧化铝与足量盐酸反应:2、澄清的石灰水跟盐酸反应:3、氨气通入醋酸溶液:4、碳酸钡溶于醋酸:
Al(OH)3 + 3H+ = Al3+ + 3H2O
CH3COOH + NH3 = CH3COONH4
BaCO3 + 2H+ = Ba2+ + H2O + CO2↑
【课堂练习】判断下列离子方程式正误
离子之间能否发生离子反应
判断下列各组离子能否大量共存?
① Ca2+ Na+ CO32- NO3-
② Ca2+ Na+ SO42- NO3-
③ H+ K+ Cl- OH-
④ NH4+ K+ OH- SO42-
⑤ H+ K+ HCO3- SO42-
⑥ Na+ K+ CO32- OH-
生成难溶物 CaCO3
生成微溶物 CaSO4
生成 NH3 · H2O
生成 弱酸 H2CO3
1、下列各组离子能在溶液中大量共存的是( ) A. Fe3+ Na+ NO3- OH- B. NH4+ Fe3+ SO42- NO3- C. SO42- Cl- Ca2+ Mg2+ D. Ba2+ K+ CO32- Cl-
2、在无色透明强酸性溶液中,能大量共存的离子组是 ( )A. Mg2+、NH4+、NO3-、 SO42- B. Na+ 、 K+ 、 Cl-、 CO32-C. K+ 、Al3+ 、OH- 、 NO3- D.Na+ 、Fe3+ 、SO42-、Cl-
鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应习题课件ppt: 这是一份鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应习题课件ppt,文件包含鲁科版高中化学必修第一册第2章元素与物质世界第2节电解质的电离离子反应第2课时离子反应课件ppt、鲁科版高中化学必修第一册第2章元素与物质世界第2节电解质的电离离子反应第2课时离子反应课后习题含答案doc等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应习题ppt课件: 这是一份鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应习题ppt课件,文件包含鲁科版高中化学必修第一册第2章元素与物质世界第2节电解质的电离离子反应第1课时电解质的电离课件ppt、鲁科版高中化学必修第一册第2章元素与物质世界第2节电解质的电离离子反应第1课时电解质的电离课后习题含答案doc等2份课件配套教学资源,其中PPT共44页, 欢迎下载使用。
鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应多媒体教学ppt课件: 这是一份鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应多媒体教学ppt课件,共29页。













