























人教版高中化学必修第二册第六章化学反应与能量课时学案
展开实验活动6 化学能转化成电能
[实验探究]
一、实验目的
1.理解氧化还原反应在化学能转化成电能过程中的作用,体会化学的价值。
2.认识原电池的构成要素及其作用。
二、实验用品
1.试剂:锌片、铜片、石墨棒、稀硫酸。
2.仪器:导线、烧杯、电流表。
三、实验方案设计
1.将电极材料用导线直接与电流表连接观察是否有电流产生。
2.将电极材料插入电解质溶液中,观察实验现象。
3.将不同电极材料制成不同的原电池装置,根据实验现象确定正、负极。
四、实验方案实施
1.电极材料实验
(1)按图用导线将电流表分别与锌片、铜片相连接,使锌片与铜片接触,观察电流表指针是否发生偏转;用石墨棒代替铜片进行上述实验。观察并记录实验现象。
电极材料 | 电流表指针是否发生偏转 | 实验结论 |
锌片、铜片 | 否 | 没有电解质溶液,不能发生原电池反应 |
锌片、石墨棒 | 否 |
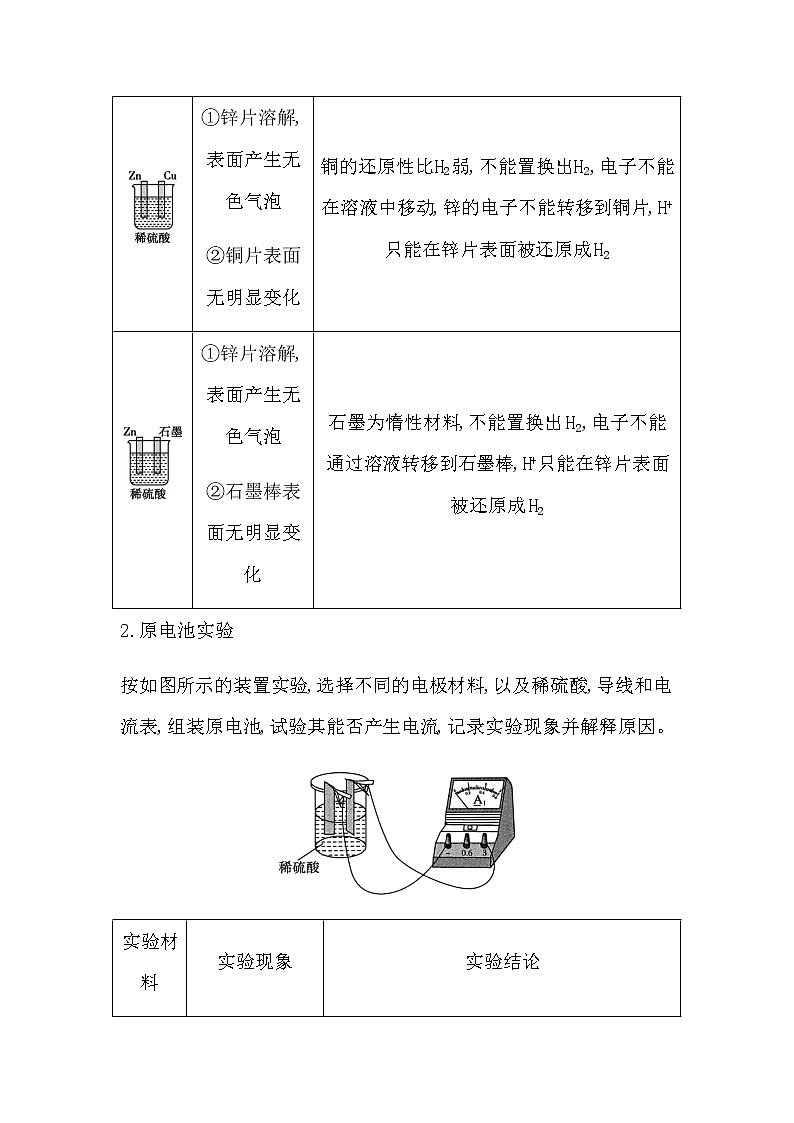
(2)按如图所示的装置做实验,记录实验现象并解释原因。
实验装置 | 实验现象 | 实验结论 |
锌片溶解,表面产生无色气泡 | 锌的还原性比H2强,溶液中的H+直接得到Zn失去的电子生成H2 | |
①锌片溶解,表面产生无色气泡 ②铜片表面无明显变化 | 铜的还原性比H2弱,不能置换出H2,电子不能在溶液中移动,锌的电子不能转移到铜片,H+只能在锌片表面被还原成H2 | |
①锌片溶解,表面产生无色气泡 ②石墨棒表面无明显变化 | 石墨为惰性材料,不能置换出H2,电子不能通过溶液转移到石墨棒,H+只能在锌片表面被还原成H2 |
2.原电池实验
按如图所示的装置实验,选择不同的电极材料,以及稀硫酸,导线和电流表,组装原电池,试验其能否产生电流,记录实验现象并解释原因。
实验材料 | 实验现象 | 实验结论 |
Zn、Cu、 稀硫酸 | ①锌片溶解 ②铜片不溶解,表面产生无色气泡 ③电流表指针偏转 | 锌失去的电子通过导线转移至铜片表面产生电流,溶液中的H+在铜片表面获得Zn失去的电子生成H2 |
Zn、石墨、 稀硫酸 | ①锌片溶解 ②石墨棒表面产生无色气泡 ③电流表指针偏转 | 锌失去的电子通过导线转移至石墨棒表面产生电流,溶液中的H+在石墨棒表面获得Zn失去的电子生成H2 |
Cu、石墨、 稀硫酸 | 铜片不溶解,电流表指针不偏转 | 铜的还原性比H2弱,不能发生氧化还原反应,没有电子转移,因而不能产生电流 |
五、问题和讨论
1.结合实验分析,组装原电池的操作注意事项有哪些?
提示:电极材料活动性不同,且能与电解质溶液发生氧化还原反应;电极可用导线连接或直接接触。
2.根据以上实验,说明原电池的工作原理。
提示:原电池工作时在负极和正极上分别发生氧化反应和还原反应,电子从负极通过导线流向正极,溶液中的阳离子(H+)从负极移向正极,阴离子从正极移向负极,构成闭合回路产生电流,使化学能转化为电能。
3.结合实验分析,原电池的构成条件或要素。
提示:①原电池反应是自发的氧化还原反应;②有两个活动性不同的电极;③将两个电极插入电解质溶液(或熔融电解质)中;④形成闭合回路。
[实验专练]
1.在如图所示的8个装置中,属于原电池的是( A )
A.④⑦ B.③④⑤ C.②④⑧ D.①④⑥
解析:①中只有一个电极,不能形成原电池;②、⑥中两电极未相连,没有形成闭合回路,不能形成原电池;③、⑧中电极相同,而且没有形成闭合回路,不能形成原电池;⑤中酒精不是电解质溶液,没有形成闭合回路,不能形成原电池。
2.下列叙述中正确的是( D )
A.原电池的负极得到电子,发生还原反应
B.原电池中较活泼的金属作正极
C.原电池中的电极一定是两种不同的金属
D.原电池中发生氧化反应的电极是负极
解析:原电池的负极失去电子,发生氧化反应,故A错误,D正确;在原电池中,一般是较活泼的金属作负极,故B错误;原电池的两个电极可以是两种不同的金属,也可以是金属和导电的非金属,故C错误。
3.一个原电池的总反应的离子方程式是Zn+Cu2+Zn2++Cu,利用该反应设计成的原电池的正确组成是( C )
选项 | 正极 | 负极 | 电解质溶液 |
A | Zn | Cu | CuCl2溶液 |
B | Zn | Cu | ZnCl2溶液 |
C | Cu | Zn | CuSO4溶液 |
D | Cu | Zn | ZnSO4溶液 |
解析:根据反应Zn+Cu2+Zn2++Cu知,锌失电子,发生氧化反应,作原电池的负极,电极反应式为Zn-2e-Zn2+,铜离子得电子发生还原反应,在原电池的正极发生反应,电极反应式为Cu2++2e-Cu,电解质溶液中含有铜离子,故选C。
4.某反应的反应物和生成物有FeCl3、FeCl2、Cu、CuCl2,小林将上述反应设计成原电池。
(1)该电池的负极材料为 ,负极反应式为 。
(2)正极材料为 ,该电池总的化学反应方程式为 。
(3)一段时间后负极质量减轻m g,下列说法正确的是 (填字母)。
A.电路中通过的电子为 mol
B.正极质量增加 g
C.原电池工作过程中将电能转化为化学能
D.原电池工作过程中Cl-向负极移动
解析:根据氧化还原反应的原理和规律,FeCl3、FeCl2、Cu、CuCl2发生的反应为2FeCl3+Cu2FeCl2+CuCl2。(1)反应中铜失电子而被氧化,应为原电池负极,负极反应式为Cu-2e-Cu2+。(2)正极材料为Pt(或活泼性比铜弱的金属或导电的非金属材料),该电池总的化学反应式为2FeCl3+Cu2FeCl2+CuCl2。(3)一段时间后负极质量减轻m g,反应的Cu的物质的量为 mol。1 mol Cu失去2 mol电子,所以m g铜反应,电路中通过的电子为×2 mol= mol,A正确;Fe3+在正极得到电子而被还原生成Fe2+,Fe3++e-Fe2+,所以正极质量不变,B错误;原电池是将化学能转化为电能的装置,C错误;原电池工作过程中阴离子向负极移动,则Cl-向负极移动,D正确。
答案:(1)Cu Cu-2e-Cu2+
(2)Pt(或活泼性比铜弱的金属或石墨等导电的非金属材料) 2FeCl3+Cu2FeCl2+CuCl2
(3)AD
5.航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置,它可直接将化学能转化为电能。甲烷燃料电池以KOH溶液为电解质溶液,其总反应的离子方程式为CH4+2O2+2OH-C+
3H2O。
(1)负极上的电极反应为 。
(2)正极上的电极反应为 。
(3)消耗标准状况下的5.6 L O2时,有 mol电子发生转移。
(4)开始放电时,正极附近溶液的pH (填“增大”“减小”或“不变”)。
解析:甲烷燃料电池中,甲烷在负极失电子,氧气在正极得电子,结合电解质溶液为KOH溶液分析解题。(1) 甲烷在负极失电子,则负极上的电极反应为CH4+10OH--8e-C+7H2O。(2)氧气在正极得电子,正极上的电极反应为2H2O+O2+4e-4OH-。(3)消耗标准状况下的5.6 L O2时,转移电子的物质的量为×4=1 mol。(4)开始放电时,正极上的电极反应为2H2O+O2+4e-4OH-,则正极附近溶液的pH增大。
答案:(1)CH4+10OH--8e-C+7H2O
(2)2H2O+O2+4e-4OH-
(3)1 (4)增大









