





高中化学鲁科版 (2019)必修 第一册第2章 元素与物质世界第1节 元素与物质分类集体备课ppt课件
展开存在:硅是亲氧元素,没有游离态,只有化合态(以氧化物和硅酸盐的形式存在)分布:自然界中分布广泛,是构成矿物和岩石的基本元素。
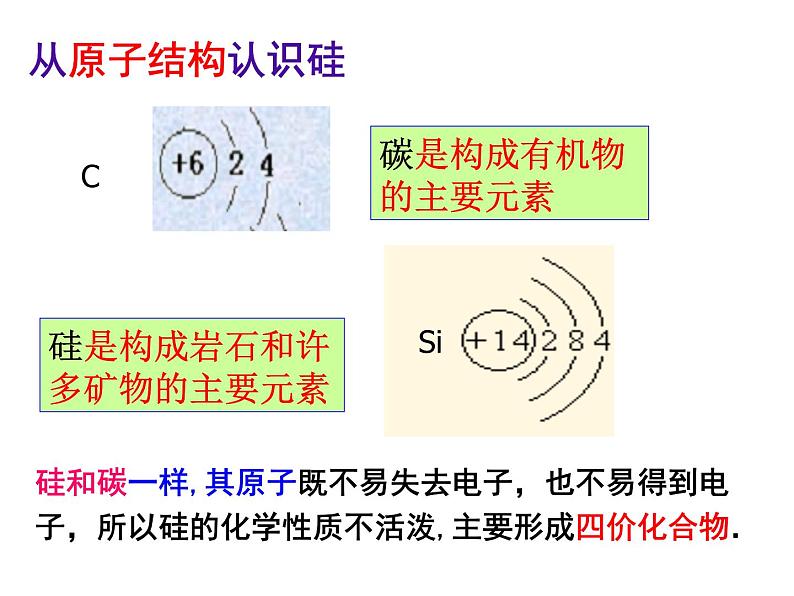
硅和碳一样,其原子既不易失去电子,也不易得到电子,所以硅的化学性质不活泼,主要形成四价化合物.
碳是构成有机物的主要元素
硅是构成岩石和许多矿物的主要元素
硅有晶体硅和无定形硅两种同素异形体
1、灰黑色,有金属光泽,硬而 脆的固体2、熔点高、硬度大
硅的化学性质不活泼,常温下,与氢氟酸、氟气、强碱反应。加热情况下,也能跟一些非金属(Cl2 O2)反应。
Si+2F2==SiF4
Si+4HF==SiF4↑+2H2 ↑
晶体硅的导电性介于导体和半导体之间,是良好的半导体材料,硅是信息技术的关键材料.
电脑的中央处理器(CPU)
结晶形(石英晶体)无定形——硅藻土
二、 二氧化硅( SiO2 )
SiO2是自然界中沙子、石英的主要成分。结晶的二氧化硅叫石英;天然二氧化硅叫硅石。
每1个Si原子周围结合4个O原子,Si在中心,O在四个顶角。 同时每1个O原子周围结合2个Si原子相结合。
二氧化硅中氧原子与硅原子个数比为2:1,用SiO2来表示二氧化硅的组成,表示O与Si的原子个数比,不是分子式是化学式。
[SiO4]四面体结构
立体网状结构决定了SiO2具有优良的物理和化学性质
3、二氧化硅的化学性质(通常很不活泼)
1、具有酸性氧化物的通性
(1)与强碱反应生成盐和水
(2)与碱性氧化物反应生成盐
(有粘性,其溶液俗称水玻璃)
实验室盛装NaOH溶液的试剂瓶用橡胶塞而不用玻璃塞
NaOH溶液能与玻璃中的SiO2反应生成Na2SiO3,使瓶塞部分粘结而无法打开。因此盛装NaOH溶液的试剂瓶不能用玻璃塞而要用橡胶塞。
思考:实验室为什么不用玻璃瓶盛装氢氟酸?
HF能腐蚀玻璃.因此,盛装氢氟酸不能用玻璃试剂瓶而要用塑料瓶。
CO2 + H2O = H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+Na2O=Na2CO3
SiO2+2NaOH=Na2SiO3+H2O
SiO2+ CaO =CaSiO3
二氧化硅和二氧化碳的性质比较
三、硅酸(H2SiO3 )
硅酸是一种白色粉末状的固体,它不溶于水;是一种弱酸,酸性比碳酸还弱,不能使指示剂变色。
二氧化硅难溶于水,又不与水反应,那么,如何制得硅酸呢?
实验4-1:向饱和Na2SiO3溶液中滴入酚酞,再滴入稀盐酸
① Na2SiO3溶液呈碱性
Na2SiO3+2HCl = H2SiO3 (胶体)+2NaCl
生成的硅酸逐渐聚合而形成硅酸溶胶(能流动),当硅酸的浓度较大时,就会形成硅酸凝胶(不能流动),硅酸凝胶经过干燥脱水就形成硅胶。硅胶的用途:干燥剂(吸水),吸附剂(多孔),催化剂的载体。
用H2CO3可制得H2SiO3 ,可证明H2SiO3 的酸性比H2CO3弱。
SiO32- + H2O + CO2= CO32- + H2SiO3↓
Na2SiO3 + H2O + CO2 = Na2CO3 + H2SiO3↓
向Na2SiO3溶液中通如CO2也可生成H2SiO3
结构复杂,一般不溶于水,化学性质很稳定。
硅酸钠(Na2SiO3), 其水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原料。
是由硅、氧和金属组成的化合物的总称。
活泼金属氧化物·较活泼金属氧化物·SiO2·H2O
CaO ·Al2O3 ·3SiO2·3H2O
K(Al3Si3O10)(OH)2
生产原料:黏土(Al2O3·2SiO2·2H2O )生产设备:陶瓷窑生产过程:混合-成型-干燥-烧结-冷却主要性质:抗氧化、抗酸碱腐蚀、耐高温、 绝缘、易成型
生产原料:纯碱、石灰石、石英 (Na2CO3、CaCO3、SiO2)生产设备:玻璃窑反应原理:主要成分:Na2SiO3、CaSiO3、SiO2
加入了不同的金属氧化物
普通玻璃加热接近熔化再急速冷却
生产原料:石灰石、黏土 (CaCO3、 Al2O3·2SiO2·2H2O )生产设备:水泥回转窑主要成分:3CaO·SiO2 2CaO·SiO2 3CaO·Al2O3
具有特殊功能的含硅物质
1、碳化硅(SiC俗称金刚砂),具有金刚石的结构。硬度很大,用作砂纸、砂轮的磨料。
2、硅 钢(铁合金) 导磁性良好,用作变压器铁芯
高温结构陶瓷、压电陶瓷
2022年高考总复习 化学 模块3 第八单元 第1节 无机非金属材料的主角——硅课件PPT: 这是一份2022年高考总复习 化学 模块3 第八单元 第1节 无机非金属材料的主角——硅课件PPT,共60页。PPT课件主要包含了化合态,立体网状,金刚石,半导体等内容,欢迎下载使用。
高中化学第一轮总复习4.10无机非金属材料的主角—硅完美课件PPT: 这是一份高中化学第一轮总复习4.10无机非金属材料的主角—硅完美课件PPT,共60页。
2022版高考化学一轮复习课件:第4章 第1节 无机非金属材料的主角——硅: 这是一份2022版高考化学一轮复习课件:第4章 第1节 无机非金属材料的主角——硅,共60页。PPT课件主要包含了栏目导航,必备知识关键能力,空间网状,半导体,橡胶或软木,NaHCO3,Na2O·SiO2,水玻璃,石灰石,真题体验领悟高考等内容,欢迎下载使用。













