
2023年高考化学一轮复习 考点18 原电池 化学电源 模拟测试
展开
这是一份2023年高考化学一轮复习 考点18 原电池 化学电源 模拟测试,文件包含2023年高考化学一轮复习考点18原电池化学电源模拟测试原卷版2023年高考化学一轮复习docx、2023年高考化学一轮复习考点18原电池化学电源模拟测试解析版2023年高考化学一轮复习docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
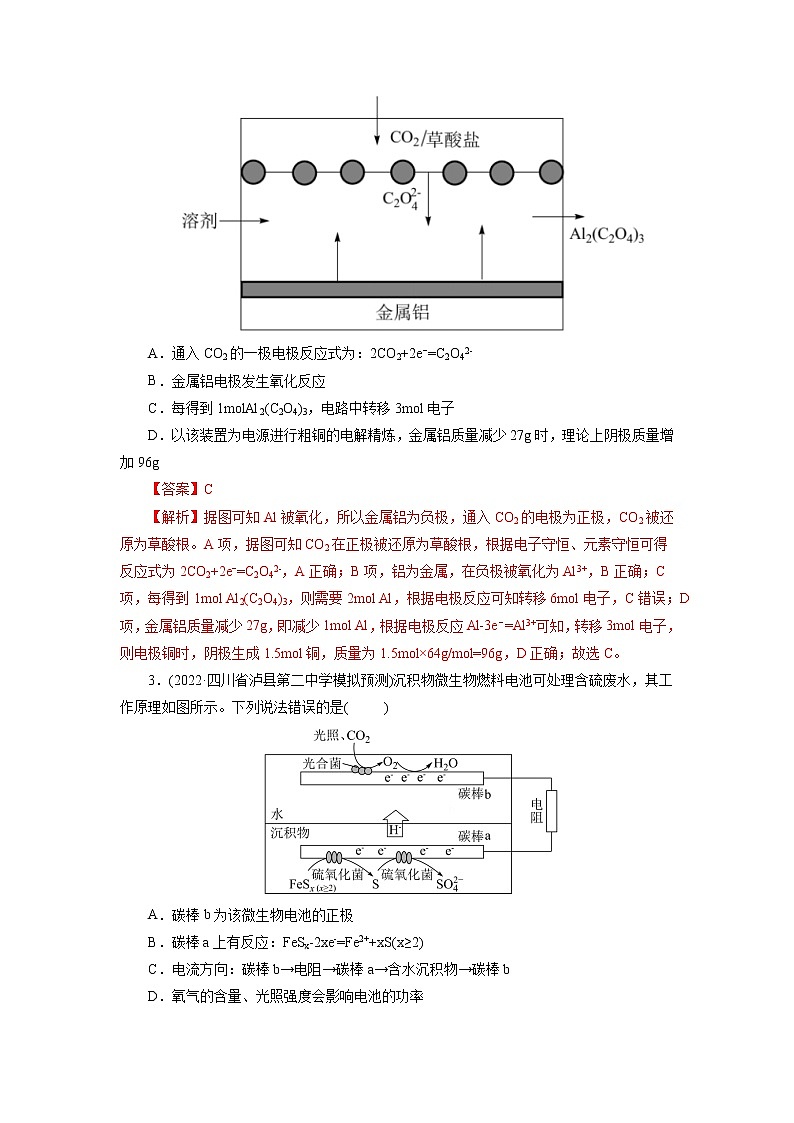
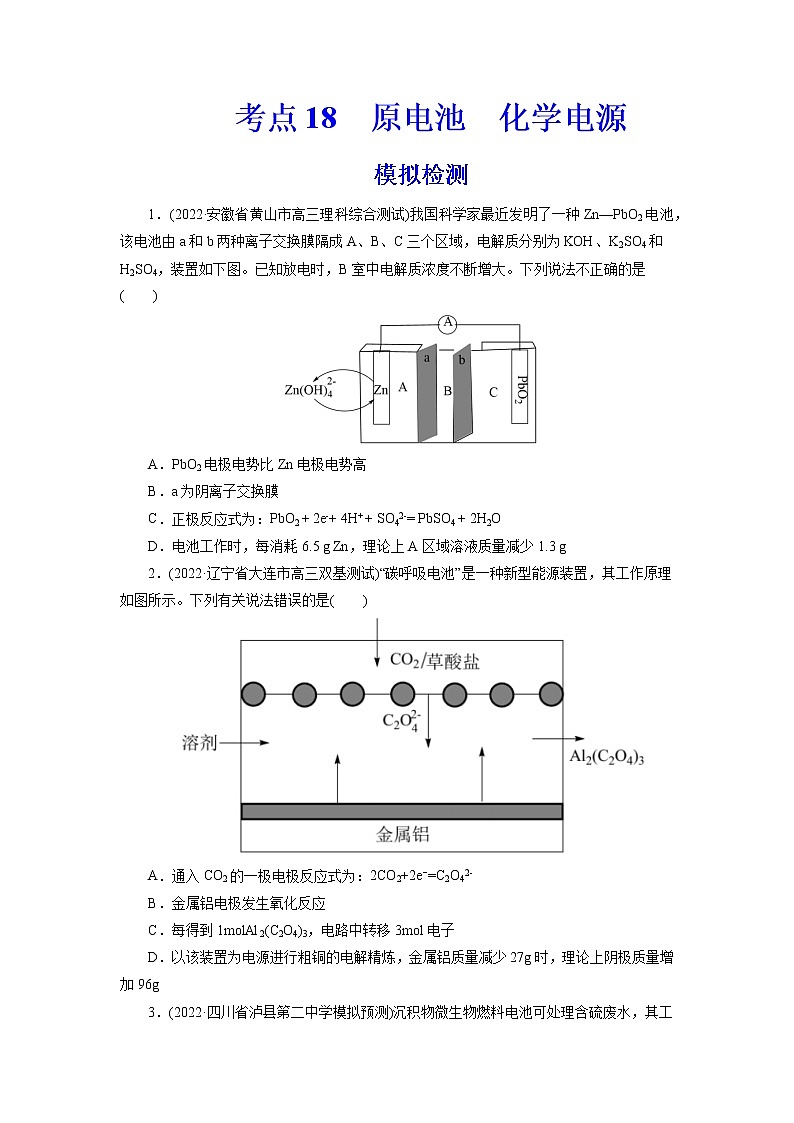
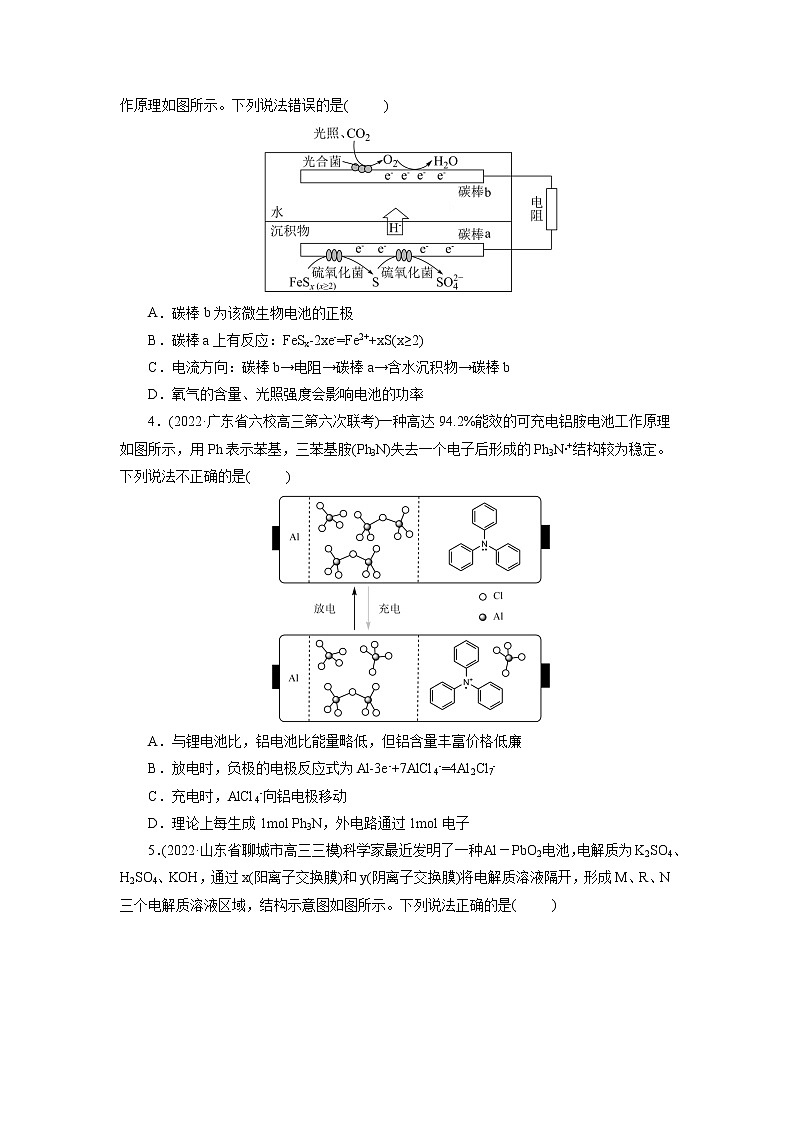
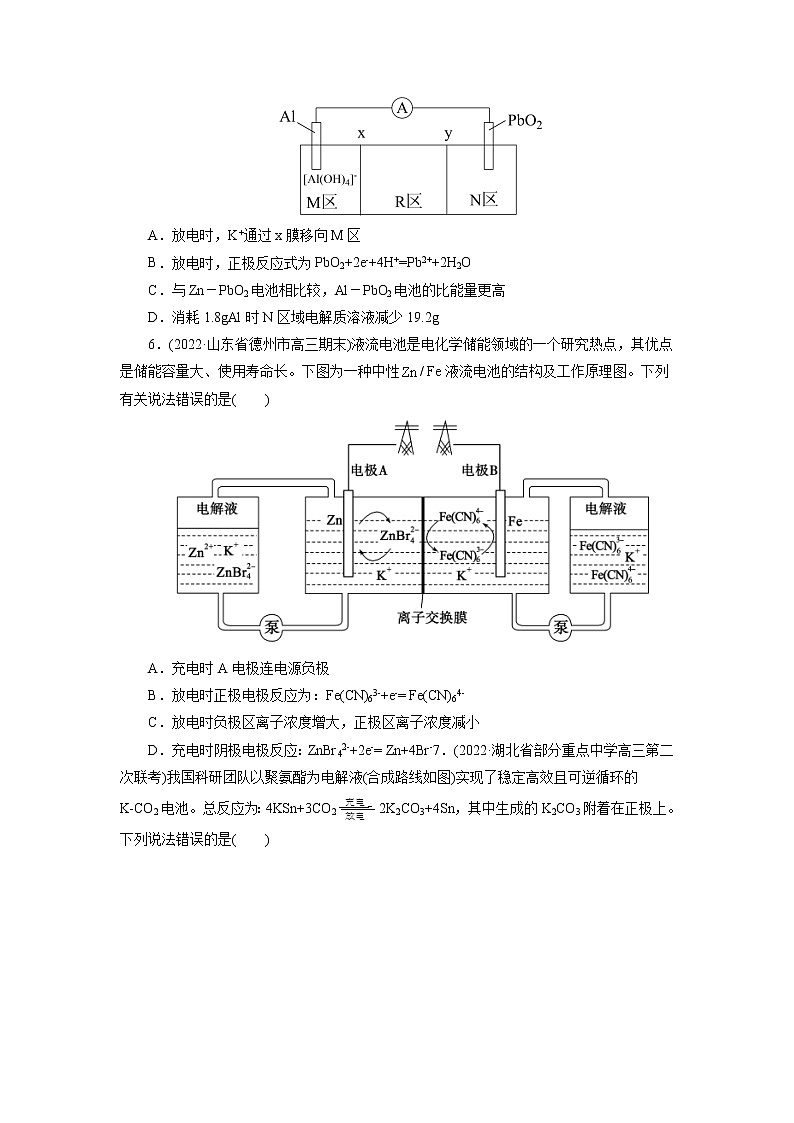
考点18 原电池 化学电源模拟检测1.(2022·安徽省黄山市高三理科综合测试)我国科学家最近发明了一种Zn—PbO2电池,该电池由a和b两种离子交换膜隔成A、B、C三个区域,电解质分别为KOH、K2SO4和H2SO4,装置如下图。已知放电时,B室中电解质浓度不断增大。下列说法不正确的是( )A.PbO2电极电势比Zn电极电势高B.a为阴离子交换膜C.正极反应式为:PbO2 + 2e-+ 4H+ + SO42-= PbSO4 + 2H2OD.电池工作时,每消耗6.5 g Zn,理论上A区域溶液质量减少1.3 g2.(2022·辽宁省大连市高三双基测试)“碳呼吸电池”是一种新型能源装置,其工作原理如图所示。下列有关说法错误的是( )A.通入CO2的一极电极反应式为:2CO2+2e−=C2O42-B.金属铝电极发生氧化反应C.每得到1molAl2(C2O4)3,电路中转移3mol电子D.以该装置为电源进行粗铜的电解精炼,金属铝质量减少27g时,理论上阴极质量增加96g3.(2022·四川省泸县第二中学模拟预测)沉积物微生物燃料电池可处理含硫废水,其工作原理如图所示。下列说法错误的是( )A.碳棒b为该微生物电池的正极B.碳棒a上有反应:FeSx-2xe-=Fe2++xS(x≥2)C.电流方向:碳棒b→电阻→碳棒a→含水沉积物→碳棒bD.氧气的含量、光照强度会影响电池的功率4.(2022·广东省六校高三第六次联考)一种高达94.2%能效的可充电铝胺电池工作原理如图所示,用Ph表示苯基,三苯基胺(Ph3N)失去一个电子后形成的Ph3N∙+结构较为稳定。下列说法不正确的是( )A.与锂电池比,铝电池比能量略低,但铝含量丰富价格低廉B.放电时,负极的电极反应式为Al-3e-+7AlCl4-=4Al2Cl7-C.充电时,AlCl4-向铝电极移动D.理论上每生成1mol Ph3N,外电路通过1mol电子5.(2022·山东省聊城市高三三模)科学家最近发明了一种Al-PbO2电池,电解质为K2SO4、H2SO4、KOH,通过x(阳离子交换膜)和y(阴离子交换膜)将电解质溶液隔开,形成M、R、N三个电解质溶液区域,结构示意图如图所示。下列说法正确的是( )A.放电时,K+通过x膜移向M区B.放电时,正极反应式为PbO2+2e-+4H+=Pb2++2H2OC.与Zn-PbO2电池相比较,Al-PbO2电池的比能量更高D.消耗1.8gAl时N区域电解质溶液减少19.2g6.(2022·山东省德州市高三期末)液流电池是电化学储能领域的一个研究热点,其优点是储能容量大、使用寿命长。下图为一种中性/ Fe液流电池的结构及工作原理图。下列有关说法错误的是( )A.充电时A电极连电源负极B.放电时正极电极反应为:Fe(CN)63-+e-= Fe(CN)64-C.放电时负极区离子浓度增大,正极区离子浓度减小D.充电时阴极电极反应:ZnBr42-+2e-= Zn+4Br-7.(2022·湖北省部分重点中学高三第二次联考)我国科研团队以聚氨酯为电解液(合成路线如图)实现了稳定高效且可逆循环的K-CO2电池。总反应为:4KSn+3CO22K2CO3+4Sn,其中生成的K2CO3附着在正极上。下列说法错误的是( )A.放电时,内电路中电流由KSn合金经酯基电解质流向羧基化碳纳米管B.电池的正极反应式为4K++3CO2+4e-=2K2CO3+CC.羧基化碳纳米管中引入的羧基可促进电子的转移D.充电时,电路中通过1mol电子,多壁碳纳米管减重36g8.(2022·广东省汕头市高三期末教学质量监测iPON薄膜锂离子电池是目前研究最广泛的全固态薄膜锂离子电池。下图为其工作示意图,LiPON薄膜只允许通过,电池反应为LixSi+Li1-xCoO2Si+LiCoO2。下列有关说法正确的是。( )A.LiPON薄膜在充放电过程中质量发生变化B.导电介质C可为Li 2SO4溶液C.放电时b极为正极,发生反应:Li1-xCoO2+xLi++xe-═LiCoO2D.充电时,当外电路通过0.2mol电子时,非晶硅薄膜上质量减少1.4g9.(2022·山东省日照市高三校际联考三模)盐酸羟胺NH3OHCl是一种常见的还原剂和显像剂,其化学性质与NH4Cl类似。工业上主要采用图1所示的方法制备。其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积的变化,下列说法正确的是( )A.电池工作时,含Fe的催化电极作负极B.图2中,M为H+和e- ,N为NH3OH+C.电池工作时,每消耗(标准状况),左室溶液质量增加3.3gD.电池工作一段时间后,正极区溶液的减小、负极区溶液的增大10.(2022·湖北省新高考高三质量检测)中科院福建物构所YaobingWang团队首次构建了一种可逆水性Zn—CO2电池,实现了CO2和HCOOH之间的高效可逆转换,其反应原理如图所示:已知双极膜可将水解离为H+和OH-,并实现其定向通过。下列说法中错误的是( )A.放电时,负极电极反应式为Zn+4OH--2e-=Zn(OH)42-B.CO2转化为HCOOH过程中,Zn电极的电势低于多孔Pd电极的C.充电过程中,甲酸在多孔Pd电极表面转化为CO2D.当外电路通过2mol电子时,双极膜中离解水的物质的量为1mol11.(2022·河北省石家庄市示范性高中高三调研考试)钾离子电池由于其低成本、电解液中快的离子传导性以及高的工作电压等优点;近年来引起了科研工作者极大的关注。吉林大学杨春成教授课题组基于钾离子电池特性,设计并合成了一种VN-NPs/N-CNFs复合材料,并将其应用于钾离子电池的电极,放电时该电极反应为VN+3K++3e-→V+K3N,下列有关说法中错误的是( )A.放电时,在Al电极区发生的是氧化反应B.该电池的溶剂不能为水溶液C.放电时,电解质中的K+向Cu电极区移动D.放电时,每转移1mole-,Cu电极区质量减少39g12.(2022·广东省普通高中高三联合质量测评)钠离子电池是极具潜力的下一代电化学储能电池。我国科学家研究出一种钠离子可充电电池的工作示意图如下,电池内部只允许Na+通过,电池反应为+ + ,(其中-R1代表没参与反应的-COONa,-R2代表没参与反应的-ONa),下列有关说法不正确的是( )A.钠离子电池相比于锂离子电池,具有原料储量丰富,价格低廉的优点B.放电时,a极为负极,发生氧化反应C.充电时,阴极发生反应为+2e-+2Na+=D.充电时,当电路中转移0.3mol电子时,Q极质量减少6.9g13.(2022·山东省济南市高三学情检测)酸性水系锌锰电池在放电时存在电极上MnO2的剥落,会造成电池效率“损失”。最新研究表明,向体系中加入少量KI固体后能使电池持续大电流放电,提高电池的工作效率,原理如图所示,下列说法错误的是( )A.加入KI降低了正极反应的活化能B.I-与剥落的MnO2反应生成的 I3-能恢复“损失”的能量C.放电时,正极区溶液的pH减小D.放电时,消耗1 mol Zn时,正极区电解质溶液增重87 g14.(2022·北京市西城区一模)氮掺杂的碳材料可以有效催化燃料电池中的还原反应,其催化机理如图。途径一:A→B→C→F途径二:A→B→C→D→E下列说法不正确的是( )A.途径一中存在极性共价键的断裂与形成B.途径一的电极反应是O2+2H++2e- =H2O2C.途径二,1mol O2得到4molD.氮掺杂的碳材料降低了反应的焓变15.(2022·四川省成都市一模)如图,甲、乙是两个完全相同的光伏并网发电模拟装置,利用它们对煤浆进行脱硫处理。下列叙述中错误的是( )A.光伏并网发电装置中b为正极B.石墨1电极上消耗1molMn2+,甲、乙中各转移0.5mol电子C.脱硫反应原理为:15Mn3++FeS2+8H2O=15Mn2++Fe3++2SO42-+16H+D.处理60gFeS2,石墨2电极上消耗7.5molH+16.(2022·安徽省新未来联盟高三模拟预测)我国科研人员以二硫化钼(MoS2)作为电极催化剂,研发出一种Zn-NO电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图所示(双极膜可将水解离成H+和OH-,并实现其定向通过)。下列说法正确的是( )A.外电路中电子从MoS2电极流向Zn/ZnO电极B.双极膜右侧为阴离子交换膜C.当电路中转移0.2 mol电子时负极质量减小6.5 gD.使用MoS2电极能加快合成氨的速率17.(2022·河北省省级联测高三第八次考试)水系钠离子二次电池由于资源丰富、绿色环保、生产成本低等优势备受关注。以无机盐为主体结合少量氟化有机盐为电解液,水系钠离子电池放电时的工作原理示意图如图。已知初始时两极质量相等,下列说法错误的是( )A.电池总反应可表示为2Na3V2(PO4)3Na5V2(PO4)3+NaV2(PO4)3B.充电时,阳极电极反应式为Na5V2(PO4)3-2e-=Na3V2(PO4)3+2Na+C.充电时,电子由M极经导线流向N极;放电时,M极为负极D.放电时,电路中通过0.005mol电子时,理论上两极质量差为0.23g18.(2022·河北省沧州市高三二模)火星大气约95%是CO2,Li-CO2电池在未来的火星探测领域有着重要的应用前景。科学家设计了一系列Ru/M-CPY@ CNT(碳纳米管)杂化材料(M = Co、Zn、Ni、Mn, CNTs碳纳米管是一种电导率高、比表面积大、通道和孔隙率丰富的导电基底)作为电极。已知该电池放电时的反应为4Li+3CO2=2Li2CO3+C,下列说法错误的是( )A.放电时,Li电极作电池负极,有电子经导线流出B.充电时,每转移1mol电子,两电极的质量变化差值为7gC.充电时,阳极的电极反应式为C-4e-+2Li2CO3 =3CO2↑+4Li+D.杂化材料中CNTs增多了CO2的吸附位点,可使该电池表现出优异的电化学性能19.(2022·湖北省黄冈中学三模)一种双阴极微生物燃料电池装置如图所示。该装置可以同时进行硝化和反硝化脱氮,下列叙述正确的是( )A.电池工作时,H+的迁移方向:左→右B.电池工作时,“缺氧阴极”电极附近的溶液pH减小C.“好氧阴极”存在反应:NH4+-6e-+ 8OH-=NO2-+ 6H2OD.“厌氧阳极”区质量减少28.8g时,该电极输出电子2.4mol
相关试卷
这是一份考点18 原电池 化学电源(核心考点精讲精练)-备战高考化学一轮复习(全国通用),文件包含考点18原电池化学电源好题冲关原卷版docx、考点18原电池化学电源好题冲关解析版docx、考点18原电池化学电源核心考点精讲docx等3份试卷配套教学资源,其中试卷共60页, 欢迎下载使用。
这是一份专题10 原电池与化学电源 -备战高考化学核心考点归纳与最新模拟测试 (全国通用),文件包含专题10原电池与化学电源-备战高考化学核心考点归纳与最新模拟测试全国通用解析版doc、专题10原电池与化学电源-备战高考化学核心考点归纳与最新模拟测试全国通用原卷版doc等2份试卷配套教学资源,其中试卷共42页, 欢迎下载使用。
这是一份高考化学考点全复习——考点18《原电池化学电源》精选题(含解析)(全国通用),文件包含高考化学考点全复习考点18《原电池化学电源》精选题解析版docx、高考化学考点全复习考点18《原电池化学电源》精选题原卷版docx等2份试卷配套教学资源,其中试卷共88页, 欢迎下载使用。