

所属成套资源:人教版(2024)初中化学九年级上册【知识清单】
第4单元 自然界的水-【知识清单】2022-2023学年九年级化学同步必备单元知识清单(人教版)
展开
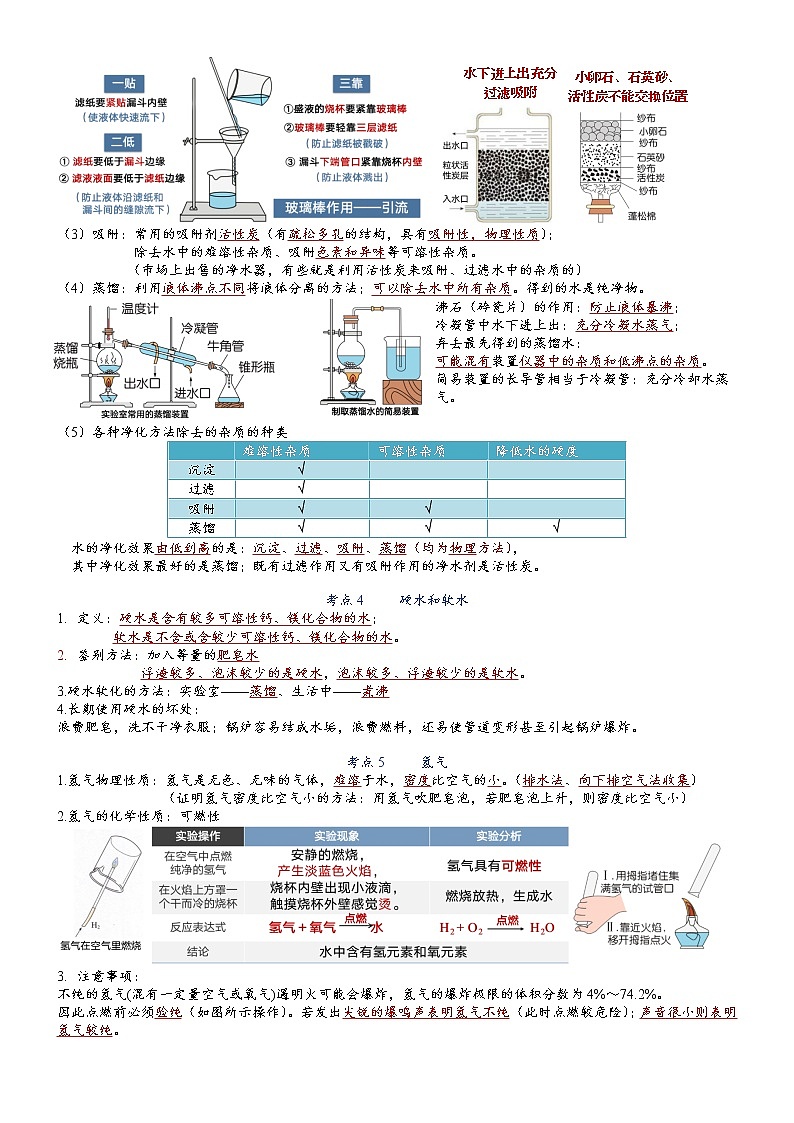
第4单元 自然界的水 考点1 水资源现状1.地球表面71%被水覆盖,各种形态的水总储量为1.39×1018m3,但供人类利用的淡水小于1% 。 全球海水、陆地水储量比 国家节水标志2.海洋是地球上最大的储水库,海水中含有80多种元素。海水中含量最多的物质是H2O,最多的金属元素是Na,最多的元素是O。3.我国水资源的状况分布不均,人均量少。4.当今世界上有80多个国家、约20多亿人口面临淡水危机,其中26个国家的3亿多人口生活在缺水状态中。 考点2 水资源保护1.爱护水资源的途径:节约用水,防止水体污染(1)节约用水 节约用水即提高水的利用效益。生活中提倡一水多用,使用节水型器具;农业中改大水漫灌为喷灌、滴灌;工业中应用新技术新工艺循环使用。(2)防止污染①水污染:指大量污染物质排入水体,超过水体的自净能力使水质恶化,水体及其周围的生态平衡遭到破坏,对人类健康、生活和生产活动等造成损失和威胁。②水污染物:工业“三废”(废渣、废水、废气);农药、化肥的不合理施用;生活垃圾、生活污水的任意排放。③防止水体污染:工业上:应用新技术、新工艺减少污染物的产生,对污染的水体处理达标后排放;农业上:合理施用农药、化肥,提倡使用农家肥;生活上:生活污水要集中处理达标排放,不使用含磷洗涤剂等。加强水质监测。 考点3 水的净化1.水 纯水是无色、无臭、清澈透明的液体。城市生活用水是经自来水厂净化处理过的。2.自来水厂净水过程 明矾的作用:明矾溶于水后生成的胶状物吸附水中悬浮杂质,使杂质沉降来达到净水的目的。3.净化水的常用方法 沉淀、过滤、吸附、蒸馏沉淀、过滤和吸附、蒸馏是工业中常用的方法,也是在化学实验中分离混合物的常用方法。(1)沉淀:①静置沉淀,让水中的不溶性固体颗粒下沉到底部;②吸附沉淀,加入明矾,溶于水生成胶状物吸附悬浮杂质,使之沉降。(2)过滤:①适用范围:用于分离难溶性固体与液体或者不溶性固体和可溶性固体②操作注意事项:“一贴二低三靠”③仪器和用品:玻璃仪器(烧杯、玻璃棒、漏斗)、 铁架台、用品(滤纸)④过滤后,如果滤液仍然浑浊,可能原因有:A承接滤液的烧杯不干净 B倾倒液体时液面高于滤纸边缘 C滤纸破损 ⑤过滤后仍然浑浊的处理方法,清洗仪器,更换滤纸,重新过滤。 (3)吸附:常用的吸附剂活性炭(有疏松多孔的结构,具有吸附性,物理性质);除去水中的难溶性杂质、吸附色素和异味等可溶性杂质。(市场上出售的净水器,有些就是利用活性炭来吸附、过滤水中的杂质的)(4)蒸馏:利用液体沸点不同将液体分离的方法;可以除去水中所有杂质。得到的水是纯净物。沸石(碎瓷片)的作用:防止液体暴沸;冷凝管中水下进上出:充分冷凝水蒸气;弃去最先得到的蒸馏水:可能混有装置仪器中的杂质和低沸点的杂质。简易装置的长导管相当于冷凝管:充分冷却水蒸气。 (5)各种净化方法除去的杂质的种类 难溶性杂质可溶性杂质降低水的硬度沉淀√ 过滤√ 吸附√√ 蒸馏√√√水的净化效果由低到高的是:沉淀、过滤、吸附、蒸馏(均为物理方法),其中净化效果最好的是蒸馏;既有过滤作用又有吸附作用的净水剂是活性炭。 考点4 硬水和软水 定义:硬水是含有较多可溶性钙、镁化合物的水;软水是不含或含较少可溶性钙、镁化合物的水。 鉴别方法:加入等量的肥皂水浮渣较多、泡沫较少的是硬水,泡沫较多、浮渣较少的是软水。3.硬水软化的方法:实验室——蒸馏、生活中——煮沸4.长期使用硬水的坏处:浪费肥皂,洗不干净衣服;锅炉容易结成水垢,浪费燃料,还易使管道变形甚至引起锅炉爆炸。 考点5 氢气1.氢气物理性质:氢气是无色、无味的气体,难溶于水,密度比空气的小。(排水法、向下排空气法收集)(证明氢气密度比空气小的方法:用氢气吹肥皂泡,若肥皂泡上升,则密度比空气小)2.氢气的化学性质:可燃性 注意事项:不纯的氢气(混有一定量空气或氧气)遇明火可能会爆炸,氢气的爆炸极限的体积分数为4%~74.2%。因此点燃前必须验纯(如图所示操作)。若发出尖锐的爆鸣声表明氢气不纯(此时点燃较危险);声音很小则表明氢气较纯。 考点6 水的电解水的电解实验分析 简记:正氧负氢,氢二氧一或者(负氢多二)实验装置实验步骤实验现象现象分析 1.接通电源两电极端均产生气泡,一段时间后,负极端气体体积约为正极端气体体积2倍相同条件下,负极产生气体较快较多2.用燃着的木条分别检验两极气体正极端气体让小木条燃烧更旺,负极端气体能燃烧,产生淡蓝色火焰正极端气体具有助燃性负极端气体具有可燃性实验结论反应表达式注意事项水通电生成氢气和氧气,说明水由氢元素和氧元素组成文字表达式: 符号表达式:电源选择直流电;水中加入硫酸钠或氢氧化钠的目的:增强水的导电性反思交流气体聚集在玻璃管上端,说明气体具有什么性质?气体密度小于水,且溶解性不大实验时正负极端产生的气体体积比小于1:2的原因?氧气不易溶于水,氢气难溶于水;且氧气可能和金属电极发生反应。3.本实验得到的气体体积比和质量比图像 氢气氧气的体积比约为2 : 1;质量比约为1 : 8 2.微观理解水的电解 化学反应前后原子种类不变,故反应前后元素种类不变考点7 物质的分类单 质:由同种元素组成的纯净物。化合物:由不同种元素组成的纯净物。(注意:单质、化合物前提必须是纯净物。)氧化物:由两种元素组成,且其中一种元素为氧元素的化合物。(注:含氧化合物包含氧化物。)物质的分类: 考点8 化学式1.概念:用元素符号和数字表示物质组成的式子2.表示的意义: 如H2O:①表示水这种物质;②表示水由氢元素和氧元素组成;③表示一个水分子;④表示一个水分子由一个氧原子和两个氢原子构成;⑤表示水由水分子构成。3.化学式的书写:单质化学式书写注意:1.除H2、N2、O2、F2、Cl2、Br2(溴)、I2(碘)七种由双原子分子构成的单质外,初中其他绝大多数单质的化学式直接用元素符号表示,此时的元素符号多了“单质”的意义。2.特殊化学式:臭氧O3。化合物化学式的书写注意:①当组成元素原子个数比是1时,“1”要省略不写;②化学式中右下方的数字一般为最简整数比(如P2O5、Fe3O4);③由两种元素组成的化合物,一般从右向左读作“某化某”。有时还要读出化学式中各种元素的原子个数。 考点9 化合价1.化合价:是用来表示元素在形成化合物时的原子个数比。化合价有正价与负价之分。2.表示方法:在元素符号正上方标出化合价。符号在前,数字在后。若数字为1时,不能省略。例如:标出物质中元素的化合价:氯化镁:2; 硫酸钠:2SO43.小结各种数字的含义:4.元素化合价与离子的关系:①元素(或原子团)的化合价的数值=离子带的电荷数②元素化合价的符号与离子带的电性一致 例:镁离子:Mg2+ 与 +2价的镁元素:5.化合价的规则:在化合物中,所有元素的化合价的代数和为零。6.常见元素、原子团的化合价钾钠银氢+1价; 钙镁钡锌+2价; 氟氯溴碘-1价; 通常氧硫-2价; 亚铜+1,铜+2; 亚铁+2,铁+3; 铝+3,硅+4,磷+5; 氯化物中氯-1; 硫化物中硫-2;还要记住根的价; -1氢氧硝酸根; -2碳酸磷酸根; 单质化合价为零。附:常见原子团的化合价(其化合价等于原子团中各元素的化合价的代数和)-1价:硝酸根:NO3 氢氧根:OH -2价: 碳酸根:CO3 硫酸根:SO4 -3价:磷酸根:PO4 +1价:铵根:NH4附:必须背熟的离子符号阳离子:K+ Ca2+ Na+ Mg2+ Zn2+ Al3+ Fe3+ Fe2+ Ag+ H+ NH4+ 阴离子:Cl- O2- S2- SO42- CO32- NO3- OH- PO43- 考点10 化学式的写法和读法 金属+非金属(1)写法:金属靠前,非金属靠后(2)读法:“某化某”,一般不读出角标,读出金属的不同价态(3)特殊:MnO2——二氧化锰 Fe3O4——四氧化三铁 非金属+非金属(1)写法:一般显正价元素在前,一般显负价的元素在后(2)读法:“某化某”,角标≥2才读,含氧元素角标为“1”也要读 (CO:一氧化碳)(3)特殊:H2O——水 H2O2——过氧化氢 NH3——氨气 CH4——甲烷 含原子团的化合物(1)写法:正价前,负价后,原子团超过1个时要打括号,在括号外右下角写上原子团的个数角标(2)读法:都不读角标(3)分类:①氢元素+酸根——读“某酸”HNO3——硝酸 H2CO3——碳酸 H2SO4——硫酸 H3PO4——磷酸特殊:盐酸的主要成分氯化氢——HCl②金属+酸根酸根/金属NaKMgCaFeAlNO3NaNO3KNO3Mg(NO3)2Ca(NO3)2Fe(NO3)2Fe(NO3)3Al(NO3)3硝酸钠硝酸钾硝酸镁硝酸钙硝酸亚铁硝酸铁硝酸铝CO3Na2CO3K2CO3MgCO3CaCO3FeCO3Fe2(CO3)3Al2(CO3)3碳酸钠碳酸钾碳酸镁碳酸钙碳酸亚铁碳酸铁碳酸铝SO4Na2SO4K2SO4MgSO4CaSO4FeSO4Fe2(SO4)3Al2(CO3)3硫酸钠硫酸钾硫酸镁硫酸钙硫酸亚铁硫酸铁硫酸铝读法:某酸某,+2价的铁元素读作亚铁,+3价的铁元素读作铁。③金属+氢氧根读作:“氢氧化某”NaOH——氢氧化钠 KOH——氢氧化钾 Fe(OH)2——氢氧化亚铁 Fe(OH)3——氢氧化铁 ④铵根+其他元素/原子团读作:某化铵或某酸铵NH4Cl——氯化铵 NH4NO3——硝酸铵 (NH4)2SO4——硫酸铵特殊:NH3·H2O——氨水 考点11 化学式计算(一)有关化学式的计算以AmBn为例1.相对分子质量(Ar)的计算 Mr(AmBn)=Ar(A)×m+Ar(B)×n2.各元素的质量比 A元素质量与B元素质量的比=[ Ar(A)×m] :[Ar(B)×n ] 3.元素质量分数 ①某元素的质量分数 = ×100% A%= ×100%②化合物中某元素的质量=化合物的质量×该元素的质量分数③化合物的质量=某元素的质量÷化合物中该元素的质量分数 例:以水为例计算 H-1 O-16①H2O的相对分子质量: 1×2+16×1=18; ②H2O中氢元素和氧元素的原子个数比: 2 : 1③H2O中氢元素和氧元素的质量比为: (1×2) : (16×1)=2 : 32=1 : 16 ④H2O中氢元素的质量分数: (1×2)÷18=11.1%⑤18g水中含有的氧元素质量: 18g×[(1×2)÷18]×100%=2g ⑥多少克水中含有2g氢元素: 2g÷[(1×2)÷18]×100%=18g






