















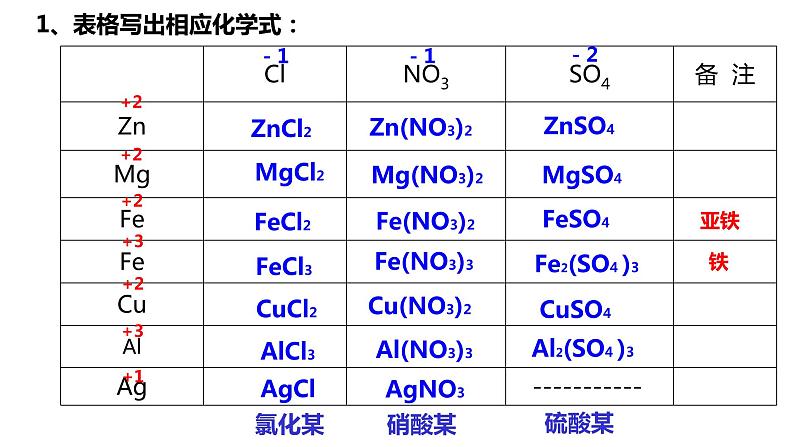








人教版九年级下册课题 2 金属的化学性质背景图ppt课件
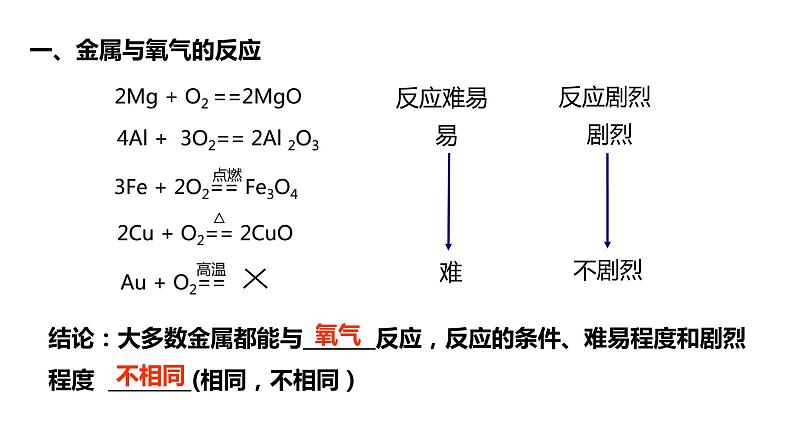
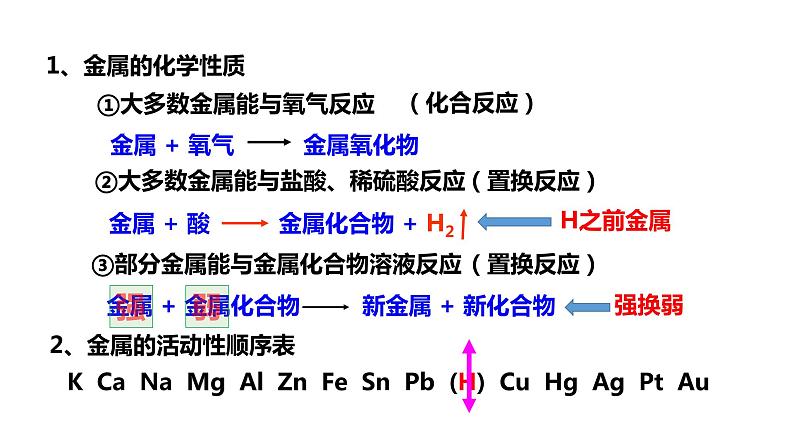
展开①大多数金属能与氧气反应
②大多数金属能与盐酸、稀硫酸反应
③部分金属能与金属化合物溶液反应
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
2、金属的活动性顺序表
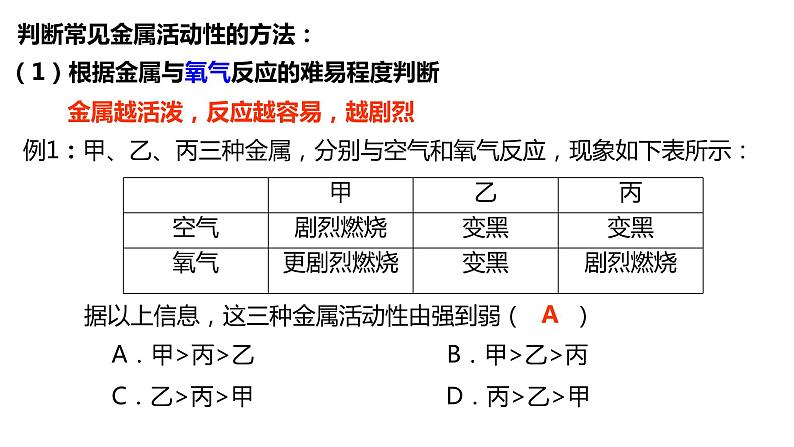
01 判断金属活动性强弱
金属的化学性质有3条,也就是说判断金属活动性强弱的方法也有3种
(2)根据金属与酸反应的剧烈程度判断
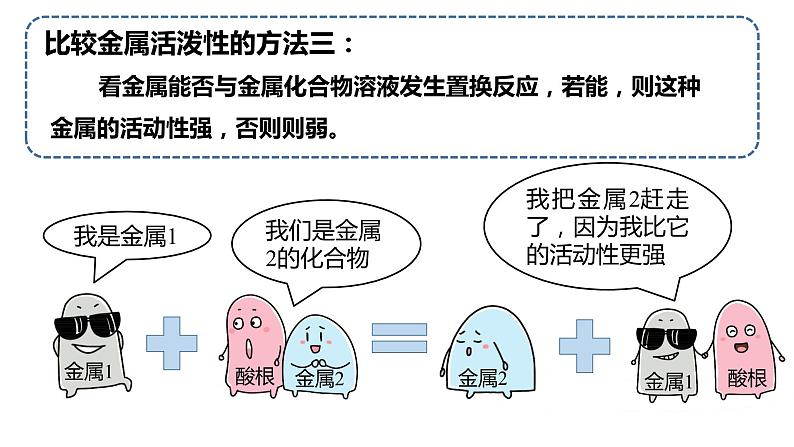
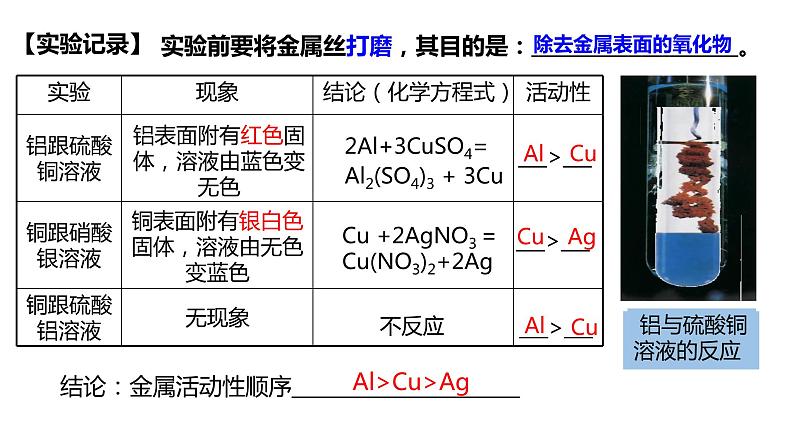
(3)根据金属能否与金属化合物的溶液反应判断
金属越活泼,反应越容易,越剧烈
氢前金属与能反应,且金属越活泼,反应越容易,越剧烈;氢后面金属与酸不能反应
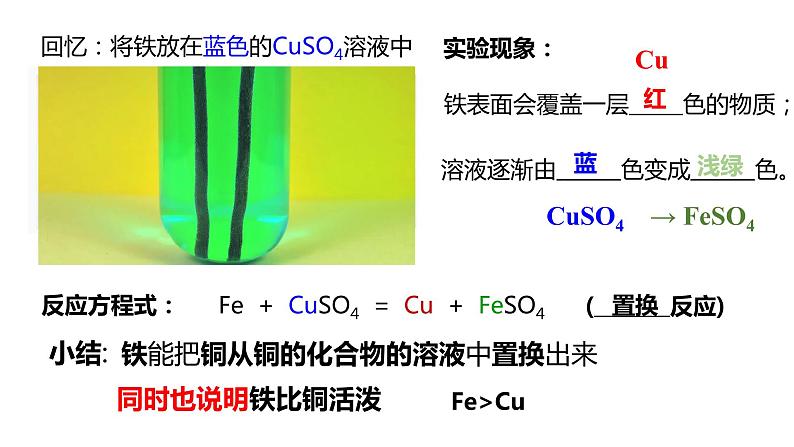
位于前面的金属把位于后面的金属从它的化合物的溶液中置换出来
例1:甲、乙、丙三种金属,分别与空气和氧气反应,现象如下表所示:
据以上信息,这三种金属活动性由强到弱( ) A.甲>丙>乙 B.甲>乙>丙 C.乙>丙>甲 D.丙>乙>甲
例2:金属单质钴(C)能与盐酸发生反应:C+2HCl=CCl2+H2↑,则说明 。
CCl2中C的化合价为+2价
例3:有甲、乙、丙三种颗粒大小相同的金属,分别投入等质量 、等浓度的稀硫酸中,乙、丙表面有气泡产生,且丙产生气泡较快,甲无现象;则这三种金属的活动性由强到弱的顺序为 。
例5:把金属X放人CuCl2溶液中有红色物质析出,放人MgCl2溶液中无现象。则X、Cu、Mg活动性由强到弱的顺序是 。
若金属1能将金属2从其化合物溶液中置换出来,则金属1 金属2; 若金属1不能将金属2从其化合物溶液中置换出来,则金属1 金属2
例4:金属R与CuCl2溶液反应的化学方程式为:R+CuCl2=RCl2+Cu,则说明 。
1.下列事实不能证明金属甲的金属活动性比金属乙强的是( ) A.自然界中甲元素只以化合物形式存在,乙元素存在单质形式 B.甲能与盐酸反应生成氢气而乙不能 C.甲能从乙的盐溶液中置换出乙 D.甲的抗腐蚀能力比乙强
2.已知X、Y、Z三种金属能发生下列反应: X+H2SO4=== XSO4+H2↑; Y+Z(NO3)2=== Y(NO3)2+Z; Z+X(NO3)2=== Z(NO3)2+X。则X、Y、Z三种金属与氢的活动性由强到弱的顺序为( ) A.X>H>Y>Z B.X>H>Z>Y C.Z>Y>X>H D.Y>Z>X>H
3、为比较X、Y、Z三种金属活动性大小,进行如图实验。(1)由图1可知金属X、Y的活泼性由强到弱顺序为 ;(2)由图2可知金属Y、Z、Ag的活泼性由强到弱顺序为 ; (3)由图1、图2可知金属X、Y、Z的活泼性由强到弱顺序为 ; (4)根据图1,下列判断错误的是 。 A.X>Cu B. Fe>Y C.X>Fe D.Cu>Y
02 验证金属活动性强弱
1.两种金属(Zn、Cu)
①Zn+CuSO4=Cu+ZnSO4
②Cu+ZnSO4≠(易错)
(1)Zn 、CuSO4溶液
(2)Cu 、ZnSO4溶液
(3)Zn 、Cu、稀盐酸/稀H2SO4溶液
(1)金属的外形;(2)酸的种类、浓度及用量
2.三种金属(Zn、Fe、Cu)
Zn、FeSO4、Cu
Zn+FeSO4=Fe+ZnSO4 → Zn > Fe
Cu+FeSO4≠ → Fe > Cu
ZnSO4、Fe、CuSO4
Fe+ZnSO4≠ → Zn > Fe
Fe+CuSO4=Cu+FeSO4 → Fe > Cu
ZnSO4、Fe、Cu、HCl
Zn、Fe、Cu、HCl可以吗?
Fe/Cu+ZnSO4≠ → Zn > Fe/Cu
Fe+2HCl=FeCl2+H2↑Cu+HCl≠
1、如何验证铜、银的活泼性?(药品自已选择)
2、如何验证铁、铜、银的活泼性?(药品自已选择)
思考: 铁、铜、银、稀盐酸能验证铁、铜、银的活泼性吗?为什么?
答:不能,只能验证出铁比铜、银活泼,而铜、银的活泼性没有验证
2、验证两种或三种金属活动性方法;
1、根据反应情况,判断金属的活泼性顺序
(1)金属与氧气反应的难易程度判断
(2)金属与酸反应的剧烈程度判断
(3)金属能否与金属化合物的溶液反应判断
1、有X 、Y 、Z 三种金属,如果把X 和Y 分别放入稀硫酸中,X 溶解并产生氢气,Y 不反应;如果把Y 和Z 分别放入硝酸银溶液中,过一会儿。在Y表面有银析出,而 Z没有变化。根据以上实验事实,判断X、 Y 和Z 的金属活动性顺序为 。
2、化学趣味小组在学习了金属的化学性质后,对金属R的活动性进行探究发现:将金属R放入稀盐酸中,观察到有气泡产生(该反应的化学方程式可表示为:R+2HCl RCl2+H2↑),将R放入ZnSO4溶液中无任何变化。下列化学方程式书写错误的是( ) A.R+MgSO4 RSO4+Mg B.R+CuSO4 RSO4+Cu C.R+H2SO4 RSO4+H2↑ D.2Al+3RSO4 Al2(SO4)3+3R
3.验证镁、铜的金属活动性顺序,下列试剂不能选用的是( )
A.MgSO4溶液 B.KCl溶液C.稀盐酸 D.ZnCl2溶液
解析:镁、铜均不能与KCl溶液反应,据此可知三种金属中钾最活泼,但无法比较镁、铜的活动性强弱。
3、验证Zn、Fe、Cu金属的活动性强弱,下列的试剂组合实验方案不能达到实验目的是( ) A. FeCl2 溶液、Zn、Cu B. ZnSO4溶液、稀盐酸溶液,Fe、Cu C. ZnSO4溶液、CuSO4溶液、Fe D. CuCl2溶液、Zn、Fe
初中化学人教版九年级下册第八单元 金属和金属材料课题 2 金属的化学性质示范课课件ppt: 这是一份初中化学人教版九年级下册第八单元 金属和金属材料课题 2 金属的化学性质示范课课件ppt,共26页。PPT课件主要包含了金属的化学性质,联系生活,金属与酸的反应,看图回答问题,能反应,难溶物,物理方法,化学方法等内容,欢迎下载使用。
人教版九年级下册课题 2 金属的化学性质教案配套课件ppt: 这是一份人教版九年级下册课题 2 金属的化学性质教案配套课件ppt,共27页。PPT课件主要包含了说教材分析,说课内容,说教法分析,教学方法,能力储备,心理特征,知识储备,探究合作自主,从生活中走向化学,从化学中走向生活等内容,欢迎下载使用。
化学九年级下册第八单元 金属和金属材料课题 2 金属的化学性质教案配套课件ppt: 这是一份化学九年级下册第八单元 金属和金属材料课题 2 金属的化学性质教案配套课件ppt,共18页。PPT课件主要包含了无变化,属于置换反应,由强到弱,想一想,化学方程式,拓展性问题,用磁铁吸引,能被磁铁吸引的是铁,分别在空气中灼烧,分别放入酸中等内容,欢迎下载使用。













