

2023河南省部分重点高中(青桐鸣)高二上学期9月联考试题化学含解析
展开化学
全卷满分100分,考试时间90分钟.
注意事项:
1.答卷前,考生务必将自己的姓名、班级、考场号、座位号、考生号填写在答题卡上.
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选涂其他答案标号.回答非选择题时,将答案写在答题卡上.写在本试卷上无效.
3.考试结束后,将本试卷和答题卡一并交回.
可能用到的相对原子质量:H-1 N-14 O-16 A1-27 Mn-55
一、选择题:本题共16小题,每小题3分,共48分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.我国很多珍贵文物都记载着中华文明的灿烂成就,下列文物主要由合金材料制成的是( )
选项 | A | B | C | D |
文物 | ||||
名称 | 西周青铜凤鸟纹爵 | 秦代竹简 | 唐代兽首玛瑙杯 | 宋代钧窑三足炉 |
A.A B.B C.C D.D
2.下列各项中的离子方程式书写正确的是( )
A.向溶液中加入过量盐酸:
B.向溶液中加入过量氨水:
C.向溶液中通入少量
D.向溶液中滴入少量新制氯水:
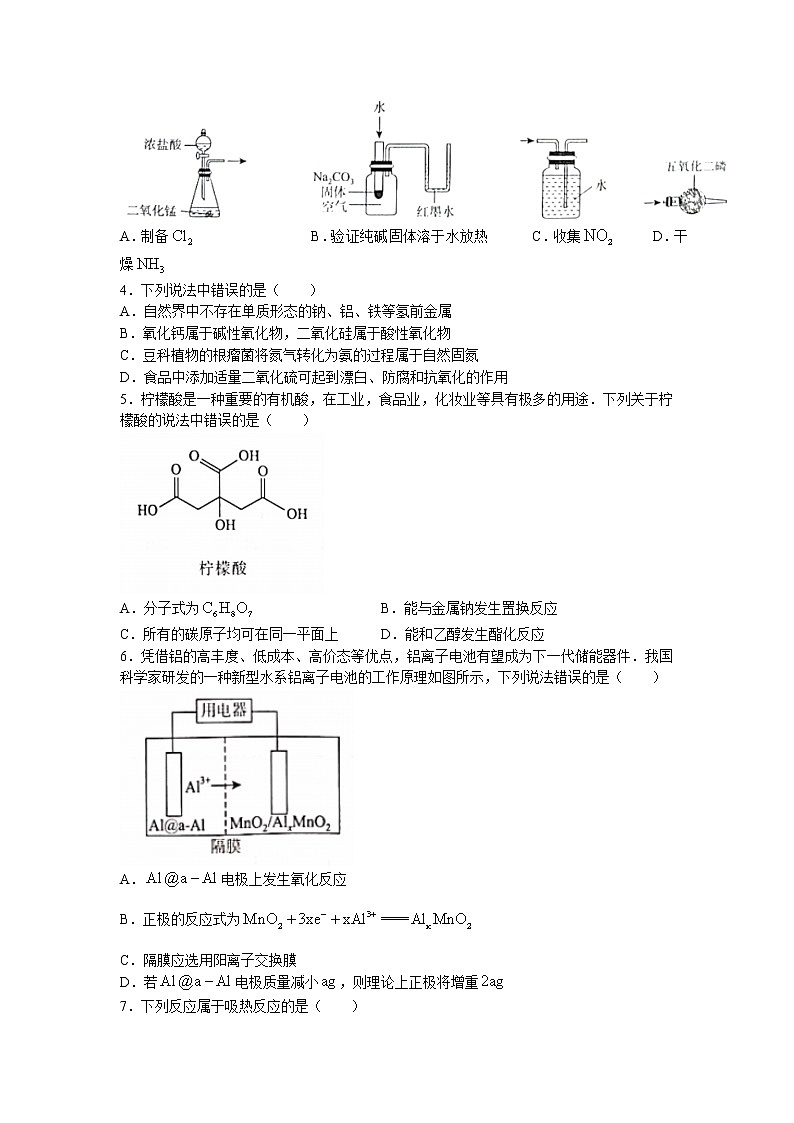
3.下列实验装置能达到对应实验目的的是( )
A.制备 B.验证纯碱固体溶于水放热 C.收集 D.干燥
4.下列说法中错误的是( )
A.自然界中不存在单质形态的钠、铝、铁等氢前金属
B.氧化钙属于碱性氧化物,二氧化硅属于酸性氧化物
C.豆科植物的根瘤菌将氮气转化为氨的过程属于自然固氮
D.食品中添加适量二氧化硫可起到漂白、防腐和抗氧化的作用
5.柠檬酸是一种重要的有机酸,在工业,食品业,化妆业等具有极多的用途.下列关于柠檬酸的说法中错误的是( )
A.分子式为 B.能与金属钠发生置换反应
C.所有的碳原子均可在同一平面上 D.能和乙醇发生酯化反应
6.凭借铝的高丰度、低成本、高价态等优点,铝离子电池有望成为下一代储能器件.我国科学家研发的一种新型水系铝离子电池的工作原理如图所示,下列说法错误的是( )
A.电极上发生氧化反应
B.正极的反应式为
C.隔膜应选用阳离子交换膜
D.若电极质量减小,则理论上正极将增重
7.下列反应属于吸热反应的是( )
A.镁与稀硫酸反应 B.碳与水反应 C.铝与五氧化二钒反应 D.铜与氯气反应
8.单质磷有多种同素异形体,白磷、赤磷、黑磷是常见的三种.已知: ;.下列说法错误的是( )
A.白磷转化为黑磷属于化学变化
B.在实验室中白磷可保存在冷水中
C.相同条件下,三种磷的同素异形体中赤磷最稳定
D.
9.甲苯(用表示)是一种挥发性的大气污染物.热催化氧化消除技术是指在作催化剂时,用将甲苯氧化分解为和.热催化氧化消除技术的装置及反应机理如图所示,下列说法中错误的是( )
A.反应Ⅱ的方程式为
B.反应Ⅰ中元素的化合价升高
C.反应Ⅱ中键的形成会释放能量
D.作催化剂可降低总反应的焓变
10.室温下,将的溶于水时吸热,将的溶于水时放热.受热分解的热化学方程式为.下列判断错误的是( )
A. B. C. D.
11.标准摩尔生成焓是指在时,最稳定的单质生成化合物时的熔变,而最稳定单质的为0,可根据计算反应的(随温度变化可忽略不计).时,相关物质的如图所示,下列各项中的热化学方程式表征错误的是( )
A.
B.
C.
D.
12.下列关于碰撞理论的说法中错误的是( )
A.反应物分子只有发生有效碰撞才能发生化学反应
B.催化剂能够降低反应的活化能,使得更多的分子成为活化分子
C.增大浓度能使单位时间内分子的有效碰撞次数增加,反应速率加快
D.增大压强能够提高活化分子的百分率,提高单位时间内分子有效碰撞次数
13.反应的速率方程.已知k为速率常数,温度不变,k不变,若在某温度下将密闭的反应容器的总体积压缩为原来的,此时该反应的速率变为原来的( )
A.4倍 B.8倍 C.16倍 D.64倍
14.利用二氧化碳催化加氢合成是一种制备的方法,反应的热化学方程式为.时,在某恒容密闭容器中充入一定量的和,下列各项能说明反应达到平衡状态的是( )
A.混合气体的密度保持不变
B.混合气体的平均相对分子质量保持不变
C.的物质的量浓度等于的物质的量浓度
D.的消耗速率与的消耗速率之比为
15.烷烃裂解是石油炼制中获取低碳烷烃和低碳烯烃等化工原料的重要途径.正丁烷催化裂解为乙烷和乙烯的反应历程如下(*号代表催化剂):
下列说法错误的是( )
A.反应①为正丁烷的吸附过程
B.过渡态中稳定性最强的是
C.正丁烷裂解生成乙烷和乙烯的反应为放热反应
D.正丁烷裂解生成乙烷和乙烯的决速步骤是反应②
16.高炉炼铁是重要的工业过程时,在某恒容密闭容器中同时发生如下反应:
反应Ⅰ.
反应Ⅱ.,
注:为用气体分压表示的平衡常数.
若反应达平衡时,体系总压强为,下列说法错误的是( )
A.平衡时,容器中和的分压相等
B.时,反应Ⅱ的
C.温度升高,减小增大
D.反应Ⅱ在较低温度下能自发进行
二、非选择题:本题共4小题,共52分.
17.(12分)X、Y、Z、P、Q是原子序数依次增大的短周期主族元素,其中X的一种核素中没有中子,Y的单质和Z的单质是空气的主要成分,Z和Q同主族.做焰色试验时P元素的焰色为黄色.回答下列问题:
(1)X、Y、Z、P、Q五种元素的原子半径从大到小的顺序为___________(用元素符号表示).
(2)M是由X、Y元素组成的含有10个电子的分子,M的空间构型为___________.
(3)可用作医药原料、照相乳剂的防腐剂.可由与反应制备,副产物为和M.
①中含有的化学键类型为_________,的电子式为_____________.
②上述制备的化学方程式为_______________________.
(4)Z和Q的简单气态氢化物中,热稳定性更好的是_____________(填化学式),从化学键的角度解释Z的简单气态氢化物的分解反应为吸热反应的原因:__________________.
18.(12分)某化学实验小组欲测定反应的热效应,设计如下实验.
实验装置:
实验步骤:在装有温度计和仪器X的烧杯中先加入已恒定为室温的溶液,使用仪器X搅拌,待温度计数字稳定读数后,迅速加入溶液.密切关注温度变化,将最高温度记为反应后体系的温度,计算出溶液上升的温度.重复上述操作3次,记录实验数据如表所示:
室温/ | 20.0 | 20.0 | 20.0 |
0.70 | 0.69 | 0.71 |
已知:①反应Ⅰ.
反应Ⅱ.
②本实验条件下,混合溶液的密度和比热容分别按照和进行计算.
回答下列问题:
(1)仪器X的名称为___________,本实验中作反应容器的烧杯的规格适宜选用_____________(填序号).
A. B. C.
(2)本实验重复进行三次的目的为_________________.
(3)由题给数据计算可知反应Ⅰ的________.
(4)反应的热效应_________ ;若其他条件不变,实验改用的溶液,则计算所得的将偏小,可能的原因为___________________.
19.(12分)水煤气转化反应是一个重要的化工过程.
已知:部分化学键的键能如表所示:
化学键 | ||||
键能 | 1072 | 799 | 436 | 463 |
回答下列问题:
(1)___________.
(2)时,向体积相同的恒容恒温的密闭容器甲和恒容绝热的密闭容器乙中分别充入和,只发生水煤气转化反应.
①甲容器中反应达到平衡时的物质的量分数为.则时甲容器中反应的平衡常数______(为用物质的分数表示的平衡常数).平衡后改变条件,下列措施能提高的平衡转化率的是__________(填序号).
A.加入催化剂 B.再充入 C.充入氩气 D.降低温度
②两容器均达到平衡后,压强更大的是_________(填“甲”或“乙”),原因为_____________.
(3)用途广泛,写出基于其物理性质的一种用途:________________.
20.(16分)氯气是重要的化工原料,随着氯气用量的日益增大,将涉氯行业产生的氯化氢转化为氯气具有重要的现实意义.工业上常采用的转化原理为.
回答下列问题:
(1)研究表明,在作催化剂时,氧化的反应分两步进行:
氯化反应::
氧化反应:.
①氧化反应的_________,该反应中正反应活化能____________逆反应活化能(填“>”或“<”).
②氯化反应在低温条件下进行的趋势很大,原因为__________________.
(2)在某刚性密闭容器中发生反应.测得初始投料比分别为时,温度对平衡转化率的影响如图甲所示:
①代表初始投料比分别为和时的曲线分别为__________、_________.
②初始投料比为时,升高温度导致的平衡转化率降低的原因为_________________________;在所对应的初始投料比条件下,P点对应的的正逆反应速率___________(填“>”“<”或“=”).
(3)我国科学家设计的一种将转化为的装置如图乙所示,该制备的方法具有占地面积小、原料利用率高等优点.
①该装置工作时,发生的能量变化除化学能→热能外,还有___________________.
②通入的电极为原电池的___________极,该电极的电极反应式为_____________________.
化学
1.A 【解析】青铜属于合金,A项正确;竹简是由主要成分为纤维素的竹片制成,B项错误;玛瑙由主要成分为二氧化硅的玛瑙石制成,C项错误;宋代钧窑三足炉是陶瓷,由黏土制成,D项错误;故选A.
2.C 【解析】向溶液中加入过量盐酸有生成,A项错误;不拆且产物为,B项错误;向溶液中通入少量,产物为,C项正确;向溶液中滴入少量新制氯水,不被氧化,D项错误;故选C.
3.B 【解析】二氧化锰与浓盐酸反应需要加热,A项错误;可通过红墨水左低右高的现象证明纯碱固体溶于水放热,B项正确;能与水反应,应选用排空气法收集,C项错误;为碱性气体,不能用五氧化二磷干燥,D项错误;故选B.
4.A 【解析】自然界中存在单质形态的陨铁,A项错误;氧化钙属于碱性氧化物,二氧化硅属于酸性氧化物,B项正确;豆科植物的根瘤菌将氮气转化为氨的过程属于自然固氮,C项正确;食品中添加适量二氧化硫可起到漂白、防腐和抗氧化的作用,D项正确;故选A.
5.C 【解析】由结构简式可知柠檬酸的分子式为,A项正确;柠檬酸分子中含有羟基和羧基,能和金属钠发生置换反应生成,B项正确;柠檬酸分子中连接羟基的碳原子和与其直接相连的3个碳原子不在同一平面上,C项错误;柠檬酸分子中含有羧基,能和乙醇发生酯化反应,D项正确;故选C.
6.D 【解析】由图示可知电极为负极,负极发生氧化反应,A项正确;电极为正极,正极发生还原反应,电极反应式为,B项正确;由图示可知隔膜通过的是,故应选用阳离子交换膜,C项正确;由两电极的电极反应式可知,电池工作过程中,理论上负极质量的减少量应等于正极质量的增加量,D项错误;故选D.
7.B 【解析】镁与稀硫酸的反应、铝与五氧化二钒的反应(铝热反应)、铜与氯气反应均为典型的放热反应,而碳与水的反应为吸热反应;故选B.
8.C 【解析】同素异形体之间的转化属于化学变化,A项正确;在实验室中白磷可保存在冷水中,B项正确;由热化学方程式可知相同条件下,黑磷的能量最低,最稳定,C项错误;由盖斯定律可知,D项正确;故选C.
9.D 【解析】由图可知,反应Ⅱ的方程式为,A项正确;反应Ⅰ中元素的价态由价升高到了价,B项正确;反应Ⅱ中键的形成会释放能量,C项正确;催化剂不改变反应的焓变,D项错误;故选D.
10.D 【解析】由溶于水吸热可得①.由溶于水放热可得②.由盖斯定律可知,则A项、B项、C项正确;D项错误;故选D.
11.C 【解析】生成物总-反应物总. ,A项正确; ,B项正确;
,C项错误; ,D项正确;故选C.
12.D 【解析】反应物分子只有发生有效碰撞才能发生化学反应,A项正确;催化剂能够降低反应的活化能,使得更多的分子成为活化分子,B项正确;增大浓度能使单位时间内分子的有效碰撞次数增加,反应速率加快,C项正确;增大压强不能提高活化分子的百分率,D项错误;故选D.
13.D 【解析】将密闭的反应容器的总体积压缩为原来的时,和的浓度均变为原来的4倍,由速率方程可知,该反应的速率变为原来的64倍;故选D.
14.B 【解析】容器的体积不变,混合气体总质量不变,在反应过程中混合气体的密度始终不变,A项错误;反应开始后,混合气体的总物质的量减小,总质量不变,若平均相对分子质量不变,则说明反应达到平衡状态,B项正确;在反应过程中的物质的量浓度恒等于的物质的量浓度,C项错误;在反应过程中的消耗速率与的消耗速率之比恒为,D项错误;故选B.
15.B【解析】反应①为正丁烷的吸附过程,A项正确;物质具有的能量越高,稳定性越差,过渡态能量最高,故其稳定性最差,B项错误;正丁烷裂解生成乙烷和乙烯的反应为放热反应,C项正确;各步反应中,活化能最大的是反应②,故决速步骤是反应②,D项正确;故选B.
16.D【解析】由可知,和的压强之比为,分压相等,A项正确;时,反应Ⅱ的,B项正确;反应Ⅰ为放热反应,温度升高,减小,反应Ⅱ为吸热反应,温度升高,增大,C项正确;反应Ⅱ为熵增的吸热反应,在较高温度下能自发进行,D项错误;故选D.
17.(12分)
(1) (2)三角锥形 (3)①离子键、(极性) 共价键
②
(4) 断裂键吸收的能量大于形成键和键释放的能量
【解析】由题给信息可推知X、Y、Z、P、Q五种元素分别为H、N、O、、S.
(1)H、N、O、、S五种元素的原子半径从大到小的顺序为.
(2)的空间构型为三角锥形.
(3)①中含有的化学键类型为离子键、极性共价键;为离子化合物,其电子式为.②由题给信息可知制备的化学方程式为.
(4)非金属性:,故热稳定性:;的分解反应为吸热反应的原因是断裂
键吸收的能量大于形成键和键释放的能量.
18.(1)(玻璃)搅拌器 B
(2)多次测量,求的平均值,减小实验误差
(3)
(4) 浓溶液与溶液混合时,除反应放热外,还有浓溶液稀释放热,会导致计算得到的偏小,最终导致偏小
【解析】(1)仪器X的名称为(玻璃)搅拌器;测定中和热选择烧杯时,为防止烧杯过大表面散热加快,一般使溶液体积与烧杯容积相近,故本实验中作反应容器的烧杯适宜选用的烧杯.
(2)本实验重复进行三次的目的为多次测量求的平均值,减小实验误差.
(3)反应生成,平均放出的热量,则生成(1)时放热,故.
(4)由盖斯定律可知,;若实验改用的溶液,由于浓溶液稀释时放热,则会导致计算得到的偏小,最终导致偏小.
19.(12分)
(1)36 (2)①2.25 D ②乙
平衡后,甲、乙两容器气体的物质的量相等,但由于反应放热,故乙容器中温度更高,压强更大
(3)作制冷剂、人工降雨、舞台上制造云雾效果
【解析】(1),故.
(2)①当甲容器中反应达到平衡时,和的物质的量分数均为,和的物质的量分数均为,则.催化剂不影响平衡转化率,A项错误;再充入,平衡正向移动,但的平衡转化率下降,B项错误;恒容充入惰性气体,平衡不移动,C项错误;水煤气转化反应为放热反应,降低温度,平衡正移,的平衡转化率升高,D项正确;故选D.②平衡后,甲、乙两容器气体的物质的量相等,但由于反应放热,故乙容器中温度更高,由可知,乙容器内压强更大.
(3)经加压、降温可转化为干冰,干冰常用作制冷剂、人工降雨、舞台上制造云雾效果等.
20.(1)① > ②氯化反应为放热反应,嫡减过程,但放热量很大,故在低温条件下,吉布斯自由能变小于零,反应趋势很大
(2)① ②该反应为放热反应,升高温度,平衡逆向移动,的平衡转化率降低 >
(3)①化学能→电能 ②负
【解析】(1)①由盖斯定律可知总反应氯化反应+氧化反应,故氧化反应的;吸热反应中,正反应活化能大于逆反应活化能.②氯化反应为放热反应,嫡减过程,但放热量很大,故在低温条件下,吉布斯自由能变小于零,反应趋势很大.
(2)①其他条件一定,越大,的平衡转化率越低,故分别代表为时的曲线.②反应放热,故升高温度,平衡逆向移动,的平衡转化率降低.在所对应的初始投料比条件下,P点应继续向正反应方向进行,此时的正反应速率大于的逆反应速率.
(3)①该装置为原电池装置,工作时发生的能量变化除化学能→热能外,还有化学能→电能.②通入的电极为负极,电极反应式为
2024河南省青桐鸣大联考高一上学期12月月考试题化学含解析: 这是一份2024河南省青桐鸣大联考高一上学期12月月考试题化学含解析,共11页。试卷主要包含了下列溶液中所含最大的是等内容,欢迎下载使用。
2024河南省青桐鸣大联考高三上学期12月月考试题化学含解析: 这是一份2024河南省青桐鸣大联考高三上学期12月月考试题化学含解析,文件包含河南省青桐鸣大联考2023-2024学年高三上学期12月月考化学答案docx、河南省青桐鸣大联考2023-2024学年高三上学期12月月考化学docx等2份试卷配套教学资源,其中试卷共32页, 欢迎下载使用。
河南省青桐鸣2023-2024学年高二上学期九月大联考化学试卷: 这是一份河南省青桐鸣2023-2024学年高二上学期九月大联考化学试卷,共8页。











