







初中化学人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应优质课教学课件ppt
展开HCl H2SO4 HNO3
NaOH Ca(OH)2 NH3·H2O
猜想一: 由于反应无明显现象,可 见氢氧化钠与盐酸不反应
猜想二: 氢氧化钠与盐酸发生了 反应,但现象不明显。
酸和碱之间能否发生反应呢?
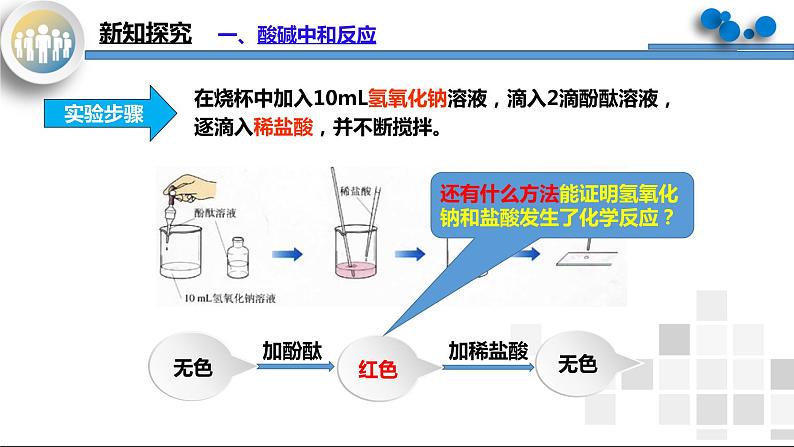
在烧杯中加入10mL氢氧化钠溶液,滴入2滴酚酞溶液,逐滴入稀盐酸,并不断搅拌。
还有什么方法能证明氢氧化钠和盐酸发生了化学反应?
证明氢氧化钠和盐酸发生了化学反应?
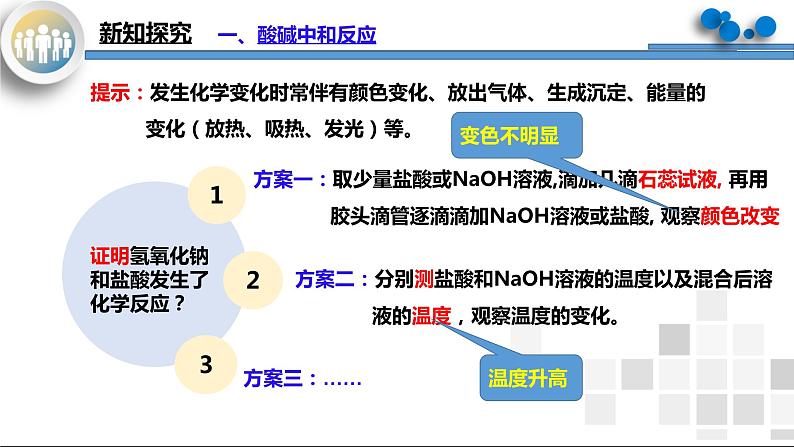
提示:发生化学变化时常伴有颜色变化、放出气体、生成沉定、能量的 变化(放热、吸热、发光)等。
方案一:取少量盐酸或NaOH溶液,滴加几滴石蕊试液, 再用 胶头滴管逐滴滴加NaOH溶液或盐酸, 观察颜色改变
方案二:分别测盐酸和NaOH溶液的温度以及混合后溶 液的温度,观察温度的变化。
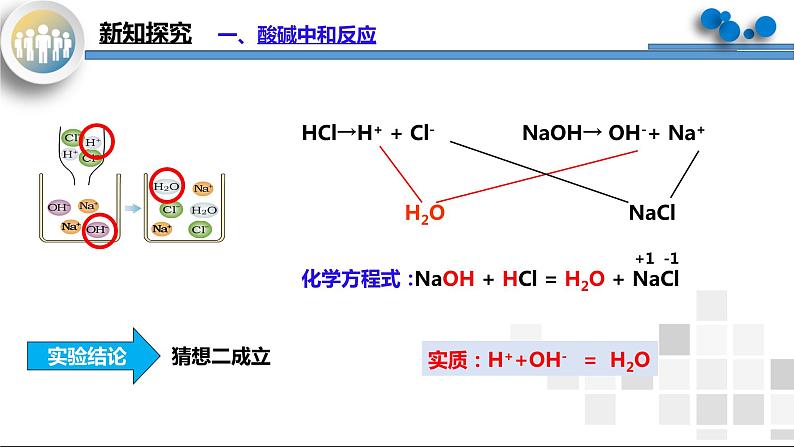
HCl→H+ + Cl-
NaOH→ OH-+ Na+
实质:H++OH- = H2O
其他的酸和碱也能发生类似的反应吗?
Ca(OH)2+ HCl = NaOH +H2SO4=
CaCl2 +2H2O
Na2SO4+2H2O
NaOH +HCl = NaCl + H2O
由金属离子和相应的酸根离子构成的化合物叫做盐。
酸与碱作用生成盐和水的反应,叫做中和反应。
碱 + 酸 → 盐 + 水
生成盐和水的反应一定是中和反应吗?
1. 有盐和水生成的反应不一定是中和反应,如CuO+2HCl=CuCl2+H2O中虽有盐和水生成,但反应物不是酸和碱,不属于中和反应。2.中和反应是放热反应。3.并不是所有的中和反应都没有明显现象。如硫酸与氢氧化钡溶液反应可产生白色沉淀:Ba(OH)2+H2SO4 = BaSO4↓+2H2O;难溶性的碱与酸反应,难溶性的碱会溶解等。
金属或非金属元素+氧元素
H+ + 酸根离子
铵根离子和酸根离子构成的化合物也是盐,如NH4Cl、(NH4)2SO4等。
胃酸过多的病人可服用含有碱性物质(如氢氧化铝)的药物。
二、中和反应在实际中的应用
胃乐说明书[药品名称] 胃乐胶囊[性状] 本品为胶囊剂,内容物为灰黄棕色,气味香,味微苦[主要成分] 氢氧化铝[Al(OH)3 ]、甘草提取物、白芨、木香等[药理作用] 中和胃酸过多、抗溃疡、镇痛、抗炎[功能与主治] 用于慢性胃炎胃酸和多酸胃痛。行气止痛,收敛生肌,促进溃疡愈合。用于胃胀闷疼痛,嗳气泛酸,恶心呕吐,气滞引起的胃腕疼痛。[用法与用量] 口服,一次2~3粒,一日3次,空腹服用[规格] 0.4g/粒[贮藏] 密封,置干燥阴凉处[包装] 20粒/盒[有效期] 两年
熟石灰中和硫酸厂的污水(含有硫酸等物质)。
被蚊虫叮咬后可涂稀氨水止痒,碱性物质能与蚊虫分泌的蚁酸中和。
食用松花蛋时加入食醋可以将其中的碱性物质中和,从而消除其涩味,使松花蛋变得可口。
三、溶液酸碱度的表示法—pH
表示溶液是酸性还是碱性的。(用酸碱指示剂检验)
表示溶液酸碱性的强弱程度。 (用pH试纸测定)
⑴pH 7,溶液显中性 。
⑶ pH 7,溶液显碱性,pH越大,碱性越强。
⑵ pH 7,溶液显酸性, pH越小,酸性越强。
在玻璃片上放一小片pH 试纸,用干净的玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。
①化工生产中许多反应必须在一定pH溶液里才能进行;
②在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
③测定雨水的pH,可以了解空气的污染情况(酸雨的pH小于5.6)
④测定人体内或排出的液体的pH,可以了解人体的健康状况。
一般情况下,我们使用的洗发用品是酸性的还是碱性的?
头发在PH值为4.5-5.5的弱酸环境下,最利于头发健康。
洗发液PH值:6.5-8.5 护发素PH值:2.8-3.5使头发在弱酸环境下更健康。
洗发时,在用过洗发剂后再使用护发剂,这样对头发有保护作用。你能解释这是为什么吗?
中和反应:酸+碱→盐+水
中和反应在生活和生产中有广泛的应用。
溶液的酸碱度可用pH表示,用pH试纸可以测定溶液的酸碱度。 pH 在0—14之间。
溶液的酸碱性与pH的关系:pH=7溶液呈中性,pH<7溶液呈酸性,pH>7溶液呈碱性
1.下列反应中属于中和反应的是( )A. MgO + 2HCl = MgCl2+H2O B. CO2+ Ca(OH)2 = CaCO3 ↓ +H2OC. Al(OH)3 + 3HCl = AlCl3+3H2OD. Fe + 2HCl = FeCl2+H2↑ 2.PH=0的溶液是 ( )A.不存在 B.酸性溶液 C.碱性溶液 D.中性溶液
3.中和反应在生活生产中有广泛的应用,下列做法不是利用中和反应原理的是( )A.用熟石灰改良酸性土壤B.用含氢氧化镁的药物治疗胃酸过多C.用盐酸除去铁锈D.用氨水(NH3·H2O)处理工厂的硫酸
4.下列方法可以解决生活中的一些问题。(1)服用含氢氧化铝的药物可以治疗胃酸过多症,反应的化学方程式为_________________________________________。(2)用熟石灰可以处理硫酸厂污水中含有的硫酸,反应的化学方程式为 ___________________________________________。
Al(OH)3+3HCl = AlCl3+3H2O
Ca(OH)2+H2SO4 = CaSO4+2H2O
初中化学人教版九年级上册课题2 水的净化公开课教学ppt课件: 这是一份初中化学人教版九年级上册课题2 水的净化公开课教学ppt课件,文件包含核心素养目标课题2《水的净化》课件PPTpptx、核心素养目标课题2《水的净化》教学设计docx、核心素养目标课题2《水的净化》同步练习docx等3份课件配套教学资源,其中PPT共31页, 欢迎下载使用。
初中化学人教版九年级下册课题2 化学肥料获奖教学课件ppt: 这是一份初中化学人教版九年级下册课题2 化学肥料获奖教学课件ppt,文件包含课题2《化学肥料》课件PPTpptx、课题2《化学肥料》教学设计docx、课题2《化学肥料》同步练习docx等3份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
初中化学人教版九年级上册课题2 燃料的合理利用与开发优质教学课件ppt: 这是一份初中化学人教版九年级上册课题2 燃料的合理利用与开发优质教学课件ppt,文件包含课题2《燃料的合理利用与开发》课件PPTpptx、课题2《燃料的合理利用与开发》同步练习docx、课题2《燃料的合理利用与开发》教学设计docx等3份课件配套教学资源,其中PPT共31页, 欢迎下载使用。















