



2023成都七中高三上学期10月阶段考试理综化学含解析
展开四川省成都市第七中学2022届高三10月阶段考试
理综测试化学试题
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Cl—35.5 Cr—52
第Ⅰ卷(选择题共126分)
一、选择题:每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 在2020年抗击新型冠状病毒疫情的过程中,大量防护和消毒用品投入使用。下列有关说法不正确的是
A. 免洗手消毒液的成分活性银离子能使蛋白质变性
B. 聚丙烯和聚四氟乙烯为生产防护服的主要材料,二者均属于有机高分子
C. 二氧化氯泡腾片杀菌消毒利用的是其强氧化性
D. 84消毒液的有效成分是NaClO,可以与医用酒精混合使用增强消毒效果
2. 新鲜水果和蔬菜中富含维生素,在作用下可转化为脱氢维生素,原理如图:
下列关于维生素的说法正确的是
A. 分子式为
B. 难溶于水,易溶于有机溶剂
C. 与脱氢维生素都可使酸性溶液褪色
D. 与脱氢维生素互为同分异构体
3. NA为阿伏加德罗常数的值,下列有关说法正确的是
A. 1molNa2O与1molNa2O2的固体中含有的阴离子数均为NA
B. 室温下pH=11的Na2CO3溶液,由水电离出的OHˉ数目为0.00lNA
C. 0.25molZn与一定量浓硫酸反应后完全溶解,生成气体的分子数小于0.25NA
D. 46g有机物C2H6O中含有极性共价键的数目一定为7NA
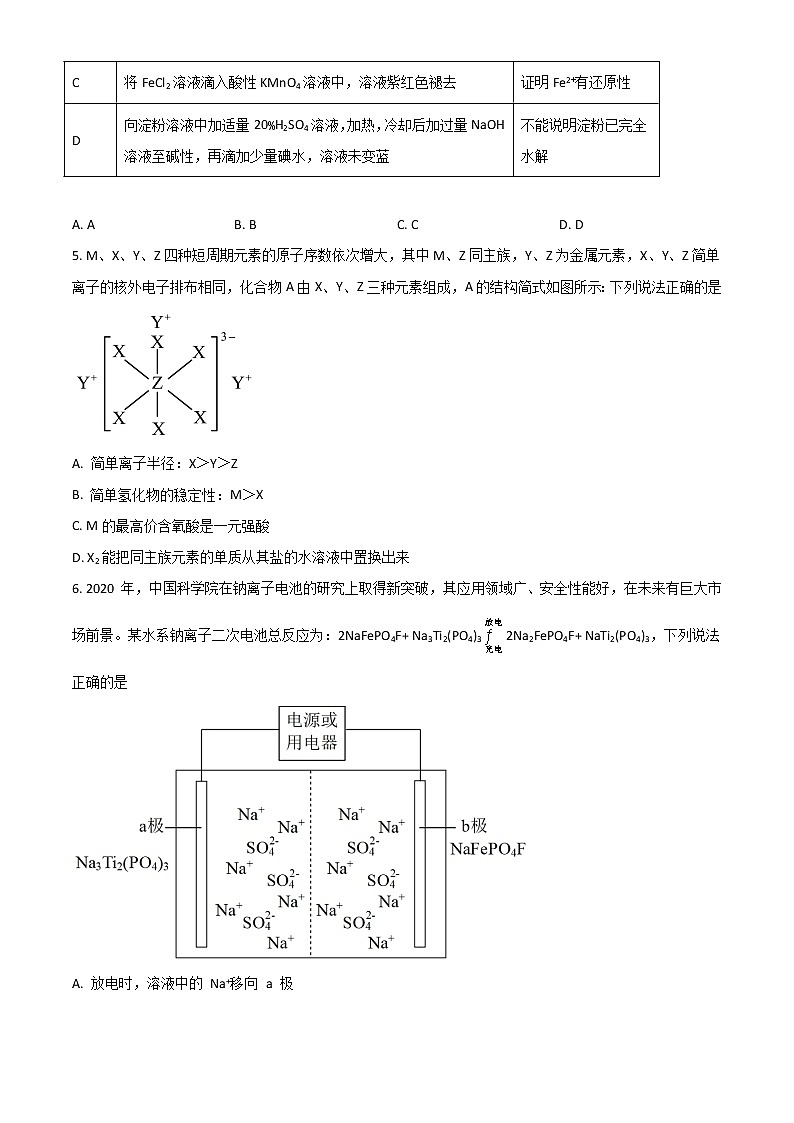
4. 根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 溴水中加入苯,充分振荡、静置后水层几乎呈无色 | 苯与溴发生了反应 |
B | 测定等浓度的Na2CO3和Na2SO3溶液的pH,前者pH比后者大 | 非金属性:S>C |
C | 将FeCl2溶液滴入酸性KMnO4溶液中,溶液紫红色褪去 | 证明Fe2+有还原性 |
D | 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加过量NaOH溶液至碱性,再滴加少量碘水,溶液未变蓝 | 不能说明淀粉已完全水解 |
A. A B. B C. C D. D
5. M、X、Y、Z四种短周期元素的原子序数依次增大,其中M、Z同主族,Y、Z为金属元素,X、Y、Z简单离子的核外电子排布相同,化合物A由X、Y、Z三种元素组成,A的结构简式如图所示:下列说法正确的是
A. 简单离子半径:X>Y>Z
B. 简单氢化物的稳定性:M>X
C. M的最高价含氧酸是一元强酸
D. X2能把同主族元素的单质从其盐的水溶液中置换出来
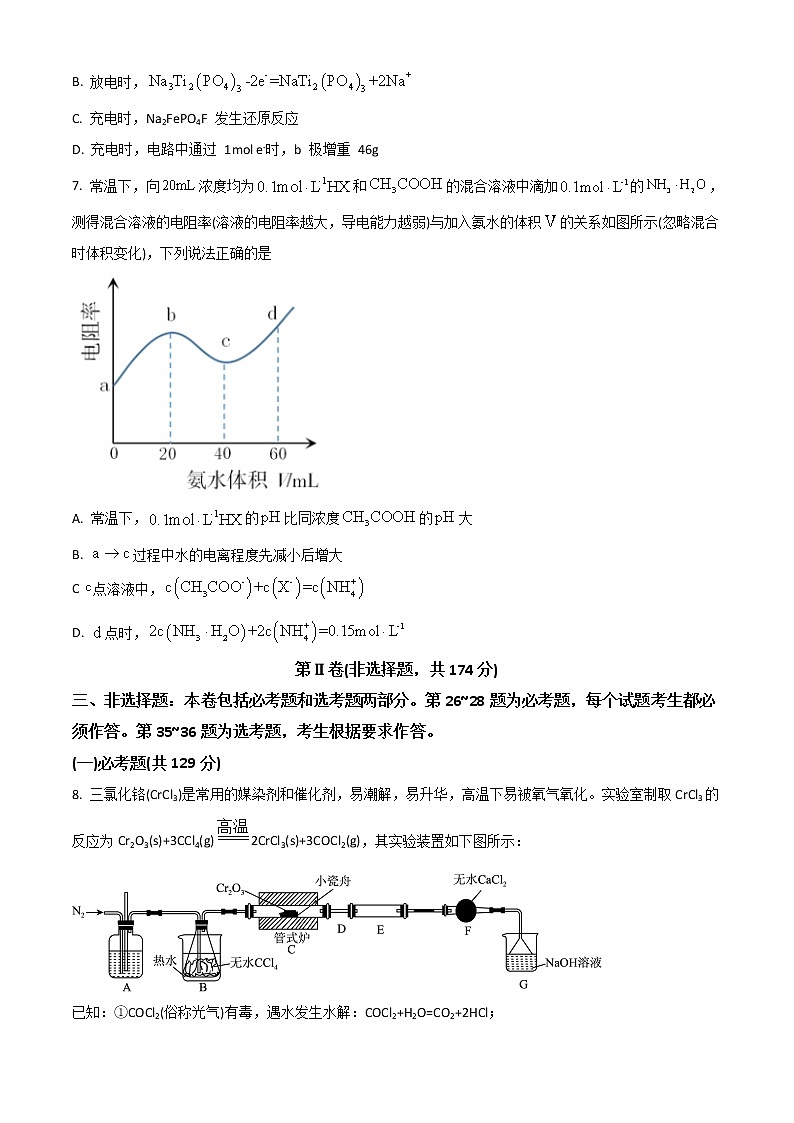
6. 2020 年,中国科学院在钠离子电池的研究上取得新突破,其应用领域广、安全性能好,在未来有巨大市场前景。某水系钠离子二次电池总反应为:2NaFePO4F+ Na3Ti2(PO4)32Na2FePO4F+ NaTi2(PO4)3,下列说法正确的是
A. 放电时,溶液中的 Na+移向 a 极
B. 放电时,
C. 充电时,Na2FePO4F 发生还原反应
D. 充电时,电路中通过 1mol e-时,b 极增重 46g
7. 常温下,向浓度均为和的混合溶液中滴加的,测得混合溶液的电阻率(溶液的电阻率越大,导电能力越弱)与加入氨水的体积的关系如图所示(忽略混合时体积变化),下列说法正确的是
A. 常温下,的比同浓度的大
B. 过程中水的电离程度先减小后增大
C点溶液中,
D. 点时,
第Ⅱ卷(非选择题,共174分)
三、非选择题:本卷包括必考题和选考题两部分。第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根据要求作答。
(一)必考题(共129分)
8. 三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取CrCl3的反应为Cr2O3(s)+3CCl4(g)2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
已知:①COCl2(俗称光气)有毒,遇水发生水解:COCl2+H2O=CO2+2HCl;
②碱性条件下,H2O2可将Cr3+氧化;酸性条件下,H2O2将还原为Cr3+。
请回答下列问题:
(1)A中的试剂为_______;无水CaCl2的作用是_______;反应结束后要继续通入一段时间氮气,主要目的是_______。
(2)装置E用来收集产物。实验过程中若D处出现堵塞,可观察到的现象是_______;可通过_______(填操作)使实验继续进行。
(3)装置G中发生反应的离子方程式为_______。
(4)测定产品中CrCl3质量分数的实验步骤如下:
I.取mgCrCl3产品,在强碱性条件下,加入过量的30%H2O2溶液,小火加热使CrCl3完全转化为,继续加热一段时间;
II.冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸(加浓磷酸的目的是为了防止指示剂提前变色),使转化为;
III.用新配制的cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液VmL(已知被Fe2+还原为Cr3+)。
①产品中CrCl3质量分数表达式为_______%。
②下列操作将导致产品中CrCl3质量分数测定值偏低的是_______(填字母标号)。
A.步骤I中未继续加热一段时间
B.步骤III中所用(NH4)2Fe(SO4)2溶液已变质
C.步骤II中未加浓磷酸
D.步骤III中读数时,滴定前俯视,滴定后平视
9. 铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:
已知:Ⅰ.铍、铝元素的化学性质相似,单质铍与氢氧化钠溶液反应生成可溶于水的Na2BeO2
Ⅱ.常温下部分难溶物的溶度积常数如表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH外,还有___________(填化学式),写出反应Ⅰ中含铍化合物与过量盐酸反应的离子方程式:___________。
(2)①滤液C中含NaCl、BeCl2和少量盐酸,为提纯BeCl2,最合理的实验步骤顺序为___________(填字母)。
a.加入过量的氨水b.通入过量的CO2c.加入少量的NaOH d.加入适量的盐酸e.洗涤 f.过滤
②从BeCl2溶液中得到BeCl2固体的操作是___________。
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:___________。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀是___________(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于___________。
(5)电解NaCl•BeCl2混合熔盐可制备金属铍,如图是电解装置图。
①石墨电极上的电极反应式为___________。
②电解得到的Be蒸气中约含1%的Na蒸气,除去Be中少量Na的方法为___________。
已知部分物质熔、沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
10. 氨是最重要的氮肥,也是产量最大的化工产品之一
Ⅰ.合成氨工艺是人工固氮的重要途径。
(1)可用作合成氨的催化剂有很多,如Os、Fe、Pt、Mn、Co等金属及相应的合金或化合物。该反应在LaCoSi催化作用的化学吸附及初步表面反应历程如下:
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字单位:eV)其中,TS表示过渡态,*表示吸附态。
①请写出N2参与化学吸附的反应方程式:___________;
②以上历程须克服的最大势垒为___________eV。
(2)在使用同一催化剂时,将2.0molN2和6.0molH2通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2时n(H2)的变化(a点恰好达到平衡),曲线B表示T1时n(NH3)的变化。
①T2温度下反应进行到某时刻,测得容器内气体的压强为起始时的80%,则此时v(正)___________v(逆)(填“>”、“<”或“=”)。
②能否由图中数据得出温度T1>T2,并说明理由___________。
Ⅱ.氨也可以用电化学法合成
(3)如图是用低温固体质子导体作为电解质,用Pt-C3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:
①Pt-C3N4电极反应产生NH3的电极反应式为___________;
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因___________。
Ⅲ.
(4)25℃时用氨水吸收甲酸可得到HCOONH4溶液,已知25℃时甲酸的电离常数Ka=1.8×10-4,NH3•H2O的电离常数Kb=1.8×10-5。计算反应NH3•H2O+HCOOHHCOO-+NH+H2O的平衡常数K=___________。
(二)选考题:共45分。请考生从2道化学题中每科任选一题做答。并用2B铅笔在答题卡上把所选题目的题号涂黑。注意所做题目的题号必须与所涂题目的题号一致,在答题卡选答区域指定位置答题。如果多做,则每学科按所做的第一题计分。
11. Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+价电子排布图为___________。
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是___________。I1(Be)>I1(B)>I1(Li),原因是___________。熔点Li2O___________Na2O(填“>”或“<”)。
I1/(kJ/mol) | ||
Li:520 | Be:900 | B:801 |
Na:496 | Mg:738 | Al:578 |
(3)磷酸根离子的空间构型为___________,其中P的杂化轨道类型为___________;与PO互为等电子体的阴离子有___________(写出一种离子符号)。
(4)金刚石与石墨都是碳的同素异形体。金刚石属于___________晶体。若碳原子半径为rnm,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________(用含π的代数式表示)。
四川省成都列五中学2023-2024学年高三上学期阶段性考试(一)理综化学试题(Word版附解析): 这是一份四川省成都列五中学2023-2024学年高三上学期阶段性考试(一)理综化学试题(Word版附解析),共15页。试卷主要包含了5 Mn, 为阿伏伽德罗常数的值, 离子方程式正确的是等内容,欢迎下载使用。
2024成都七中高二上学期10月月考理综化学试题含解析: 这是一份2024成都七中高二上学期10月月考理综化学试题含解析,文件包含四川省成都市第七中学2023-2024学年高三上学期10月阶段性考试理科综合化学试题含解析docx、四川省成都市第七中学2023-2024学年高三上学期10月阶段性考试理科综合化学试题无答案docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。
2022芜湖高三上学期期末考试理综化学含解析: 这是一份2022芜湖高三上学期期末考试理综化学含解析,文件包含安徽省芜湖市2021-2022学年高三上学期期末质量监控理综化学试题含解析docx、安徽省芜湖市2021-2022学年高三上学期期末质量监控理综化学试题无答案docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。











