

所属成套资源:人教版初中化学九年级 上学期课后培优分级练
人教版九年级上册课题2 原子的结构课后测评
展开
这是一份人教版九年级上册课题2 原子的结构课后测评,共10页。试卷主要包含了原子构成,核外电子的分层排布,离子等内容,欢迎下载使用。
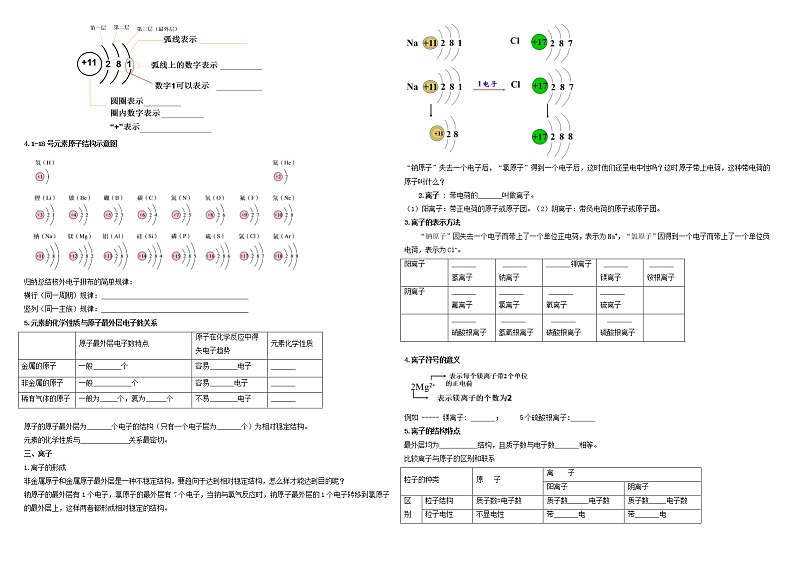
课题2原子的结构一、原子构成1、原子是由带正电荷的 和 构成的。 原子核(带 电) (带正电)2、原子( 电性) 中子( ) 核外电子(带 电)3、原子的质量几乎全部集中在 上, 的质量可忽略不计。4、在原子中,质子数= = = 。5、相对原子质量(1)以一种碳原子质量的1/12作为基准,是一个比值,单位是“1”常省略不写;(2)原子的质量主要集中在 上,相对原子质量约等于 + 相对分子质量= 。6、注意事项原子核内质子数与中子数 相等不是所有原子都有中子,例如氢原子不同种类的原子, (不同种类原子间的本质区别)二、核外电子的分层排布原子核外的电子是如何运动的?(1)高速运动(2)无规则运动(3)分层运动把电子在不同的区域内运动的现象叫做核外电子的分层排布。 核外电子的分层排布在含有多个电子的原子里,电子的能量并不相同。能量低的通常在离核 的区域运动;能量高的通常在离核 的区域运动。离核最近的叫第一层,依次向外类推,分别叫做二、三、四、五、六、七层,即在含有多个电子的原子里,核外电子是在能量不同的电子层上运动的。电子层:1 2 3 4 5 6 7离核由近到远,能量由低到高。 核外电子分层排布的规律(仅限前3层)(1)第一电子层最多容纳 个电子,第二电子层最多容纳 个电子)(2)最外层电子数不超过 个(只有一个电子层的,电子不超过 个)(3)电子总是先排在能量低的电子层里,排满后,再排布在能量高的电子层里。电子先排满第 层,再排第 层,排满第 层,再排第 层。(按照能量由低到高的顺序分层排布)3.原子结构示意图画法 :画圆圈,标核电,弧线呈扇面,数字一条线。 4.1-18号元素原子结构示意图归纳总结核外电子排布的简单规律:横行(同一周期)规律: 竖列(同一主族)规律: 5.元素的化学性质与原子最外层电子数关系 原子最外层电子数特点原子在化学反应中得失电子趋势元素化学性质金属的原子一般 个容易 电子 非金属的原子一般 个容易 电子 稀有气体的原子一般为 个,氦为 个不易 电子 原子的原子最外层为 个电子的结构(只有一个电子层为 个)为相对稳定结构。元素的化学性质与 关系最密切。三、离子 1.离子的形成非金属原子和金属原子最外层是一种不稳定结构,要趋向于达到相对稳定结构,怎么样才能达到目的呢? 钠原子的最外层有1个电子,氯原子的最外层有7个电子,当钠与氯气反应时,钠原子最外层的1个电子转移到氯原子的最外层上,这样两者都形成相对稳定的结构。“钠原子”失去一个电子后,“氯原子”得到一个电子后,这时他们还呈电中性吗?这时原子带上电荷,这种带电荷的原子叫什么?2.离子 : 带电荷的 叫做离子。(1)阳离子:带正电荷的原子或原子团。(2)阴离子:带负电荷的原子或原子团。3.离子的表示方法“钠原子”因失去一个电子而带上了一个单位正电荷,表示为Na+,“氯原子”因得到一个电子而带上了一个单位负电荷,表示为Cl-。阳离子 氢离子 钠离子 钾离子 镁离子 铵根离子阴离子 氟离子 氯离子 氧离子 硫离子 硝酸根离子 氢氧根离子 碳酸根离子 硫酸根离子 4.离子符号的意义例如 ----- 镁离子: ; 5个硫酸根离子: 5.离子的结构特点最外层均为 结构,且质子数与电子数 相等。比较离子与原子的区别和联系粒子的种类原 子离 子阳离子阴离子区别粒子结构质子数=电子数质子数 电子数质子数 电子数粒子电性不显电性带 电带 电符 号用元素符号表示如:O、H、Fe用阳离子符号表示如:Na+、Mg2+用阴离子符号表示如:Cl-、O2-原子与离子相互转化关系 阳离子 原子 阴离子 6.原子、离子、分子的关系 世界是由物质组成的,物质都是由微粒构成的,分别写出构成下列物质的微粒(用“分子”、“原子”、“离子”填空),金刚石、铁、氦气等物质是由 构成的;食盐等物质是由 构成的;氧气、二氧化碳、水等物质是由 构成的。 一、1、原子核;带负电荷的核外电子 原子核(带正电) 质子(带正电)2、原子(不显电性) 中子(不带电) 核外电子(带负电)3、原子核,电子4、核外电子数=核电荷数=原子序数。5、(2)原子核;质子数;中子数组成该分子的所有原子的相对原子质量加和。6、不一定;质子数不同二、1.近;远2.(1) 2 ; 8 ;(2) 8 ; 2 ;(3)低;1;2;2;3;由低到高;3. 4.每个横行的原子电子层数相同,从左到右最外层电子数依次递增。每个竖列的原子最外层电子数相同,从上到下电子层数依次递增。5. 原子最外层电子数特点原子在化学反应中得失电子趋势元素化学性质金属的原子一般 少于4 个容易 失去 电子比较活泼非金属的原子一般 多于等于4 个容易 得到 电子比较活泼稀有气体的原子一般为 8 个,氦为 2 个不易 得失 电子很不活泼 8 ; 2 ;原子的最外层电子数三、2.原子或原子团3.阳离子H+ 氢离子 Na+ 钠离子K+ 钾离子 Mg2+ 镁离子 NH4+铵根离子阴离子F-氟离子Cl- 氯离子 O2-氧离子S2- 硫离子 NO3- 硝酸根离子 OH- 氢氧根离子 CO32- 碳酸根离子 SO42-硫酸根离子 4. Mg2 +; 5SO42-5. 相对稳定 ; 不 ; >;< ;正; 负6. 原子 ; 离子 ; 分子 培优第一阶——基础过关练1.原子核( )A.由电子和质子构成 B.由质子和中子构成 C.由电子和中子构成 D.由质子、中子、和电子构成2.下列对原子的认识正确的是( )A.原子是构成物质的最小微粒 B.原子是构成一切物质的基本微粒C.原子是化学变化中的最小微粒 D.原子是可分割成更小微粒的空心小球3.原子中,一定含有的粒子是( )A. 质子、中子、电子 B. 质子、中子 C. 中子、电子 D. 质子、电子4.金属钛广泛用于人造骨骼,被誉为“亲生物金属”。钛的相对原子质量为 48,质子数为 22,则钛原子的电子数是( ) A. 70 B. 48 C. 26 D. 225.下列关于分子、原子和离子的叙述,正确的是( ) A. 分子是化学变化中最小的粒子 B. 分子可分,原子不可分
C. 分子都是由原子构成的,物质都是由分子构成的 D. 分子、原子和离子都能构成物质6.不久前,某国决定将核废水排放入海引发国际争论。核废水中含有氚、锶、铯等放射性元素。已知氚原子的核内质子数为1,中子数为2。下列关于氚、氢两种原子的说法正确的是( ) A. 属于不同种元素 B. 都有中子,但数目不同 C. 最外层电子数相同 D. 相对原子质量相同7.下列关于原子核的说法中,错误的是( )A. 原子核位于原子的中心,带正电荷 B. 原子核位于原子的中心,带负电荷
C. 原子核在原子中所占的体积非常小 D. 原子的质量主要集中在原子核上8.已知核内有6个质子和6个中子的碳原子的质量为mkg,一个钼原子的质量为8mkg,则钼的相对原子质量为( )A. 96 B. 72 C. 48 D. 369.氧原子的相对原子质量为( ) A.16g B.16 C.2.657×10-26kg D.16kg10.某原子的实际质量是一种碳原子(6个质子和6个中子)实际质量的2倍,该原子的相对原子质量是( )A.2 B.12 C.24 D.3611.据美国《纽约时报》报道,俄美科学家成功合成了一种拥有117个质子的新元素.使用粒子回旋加速器,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,另一个原子有177个中子.以下说法不正确的是( )A.该元素的核电荷数为117 B.这6个新原子其中有176个中子的5个原子与另一个原子是同位素原子 C.这6个新原子其中有176个中子的原子的相对原子质量为293 D.这6个新原子其中有177个中子的原子的核外电子数也为177个12、在测定锌、铟等元素的相对原子质量方面做出卓越贡献的中国科学家是( )A.杨振宁 B.屠呦呦 C.侯德榜 D.张青莲13.能保持物质的化学性质的最小粒子是____;化学变化中的最小粒子是_____;原子中带正电荷的粒子是_________;不显电性的粒子有 、 、 。14.联合国把2019年定为“元素周期表年”。俄国科学家门捷列夫对元素周期表的编制做出了巨大贡献, 人们将101号元素命名为“钔”来纪念他。钔原子的核电荷数为101, 相对原子质量为258,则钔原子的中子数为( )A. 101 B. 157 C. 258 D. 35915.填写下表中的空格。原子种类核电荷数质子数原子序数核外电子数氧8 8 硫 1616 镁 1212 培优第二阶——拓展培优练1.如图为原子变化的示意图,其中①②③表示三种原子,“●”、“〇”、“。”表示原子中的不同微粒,①②③中属于同种元素的原子是( ) A.①②③ B.①② C.②③ D.①③2.元素铅的质子数为82,相对原子质量为207,求该元素原子核内中子数与核外电子数之差( )A.42 B.43 C.82 D.833.重水的主要用途是作为核反应堆的减速剂.一个重水分子是由2个重氢原子和1个氧原子构成的,重氢原子的核电荷数是1,相对原子质量为2,下列说法正确的是( )A.重氢原子核外有两个电子 B.重氢离子核内有一个质子 C.重水分子的相对分子质量为18 D.氢原子和重氢原子在化学性质上是不一样的4.一个碳-12原子的实际质量是mg,钙的相对原子质量是40,则一个钙原子的实际质量是A.10g B. C.10 m g D.5.以一种碳原子的质量的1/12作为基准,其他原子的质量与这一基准的比,称为这种原子的相对原子质量。如改为以一种氧原子质量的1/12作为基准,则以下量会发生改变的是A.一个氢原子的实际质量 B.一滴水中所含水分子的个数C.氨气的相对分子质量 D.一个氧分子和一个氢分子的质量比6.已知一个碳12原子的质量为akg,一个R原子的质量为bkg,则R原子的相对原子质量为A. B. C. D.7.科学家们发现,月壤含有大量的氦-3,每百吨氦-3释放的能量,相当于全世界一年消耗的能量总和。下列说法正确的是A.一个氦-3原子中有3个质子B.一个氦-3原子中有2个质子和1个中子C.氦的相对原子质量是3gD.卢瑟福实验中的α粒子就是氦的原子核,其符号为He+8.英国科学家道尔顿于19世纪初提出了近代原子学说。他认为物质是由原子构成的,这些原子是微小的、不可分割的实心球体。请你指出道尔顿原子学说中与现代科学实验证明的事实不相符的地方:(1)__________________________________ (2)___________________________________ (3)________________________________ 9.人们为了揭示原子结构的奥秘,经历了漫长的探究过程。1911年物理学家卢瑟福用带正电的α粒子轰击金属箔。实验发现:多数α粒子穿过金属箔后仍保持原来的运动方向,绝少数α粒子发生了较大角度的偏转。(1)卢瑟福提出了原子的核式结构模型,认为原子的中心有一个很小的 ;(2)当α粒子轰击金属箔时,图中四条运动轨迹不可能出现的是 (填字母)。 10.科学理论的建立与发展是一代代科学家不懈努力的结果。人们对物质构成的认识,经历了漫长的探索过程。原子的构成:汤姆森、卢瑟福等科学家都是根据实验证据进行推理,再用原子模型来表征原子的内部结构。①1897年,汤姆森在实验中发现所有原子都能释放出一种带负电的粒子,这种粒子就是_______。如果你在当时的实验现场,根据这一实验结果,你推理获得的结论是___________。②原子、分子质量很小,为计算和使用方便引入相对原子质量,关于相对原子质量,下列叙述正确的是___________(填字母序号)。A.相对原子质量是采用以小比小使数值变大的计量原理B.相对原子质量是一个原子质量与一个碳12原子质量1/12的比值C.相对原子质量就是原子质量D.采用相对原子质量后,就增大了原子的质量 培优第三阶——中考沙场点兵1.(2022年江西省中考)原子中质子数一定等于_____A.中子数 B.核电荷数 C.相对原子质量 D._____________2.(2021浙江温州)2021年4月,我国科学家首次合成的铀﹣214,是目前已知质量最小的铀原子。其相对原子质量为214,质子数是92。则铀﹣214原子的核外电子数为( )A.92 B.122 C.214 D.3063.(2021浙江衢州)2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子( )A.含有2个质子 B.核电荷数为1 C.相对原子质量为4 D.质子数和中子数相等4.(2021四川自贡中考)不久前,某国决定将核废水排放入海引发国际争论。核废水中含有氚、锶、铯等放射性元素。已知氚原子的核内质子数为1,中子数为2。下列关于氚、氢两种原子的说法正确的是( )A.属于不同种元素 B.都有中子,但数目不同 C.最外层电子数相同 D.相对原子质量相同5.(2020桂林中考)某原子的核电荷数为6,中子数为8,则该原子的核内质子数是( )A.2 B.6 C.8 D.146.(2021山东东营)1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验(如图),根据这个实验获得的正确结论是( )A.金原子核带正电荷 B.金原子是实心球体,紧密排列 C.金原子中有带负电的电子 D.金原子核的质量与α粒子质量相当7.(2022年江苏省扬州市中考)下列物质由离子构成的是( )A.氮气 B.硝酸钠 C.二氧化碳 D.金刚石8.(2022年四川省泸州市中考)“结构决定性质”是化学的核心观念。下列有关钠原子结构与性质的说法错误的是( )A.钠原子次外层有8个电子 B.一个钠原子变成钠离子失去1个电子C.钠离子的结构示意图为 D.钠呈+1价与钠原子的最外层电子有关9.(2022年云南省昆明市中考)如图是某粒子结构示意图,下列有关该粒子的说法错误的是( ) A.最外层有8个电子 B.该粒子是阴离子C.核外有3个电子层 D.核电荷数为1810.(2022年云南省中考)浩瀚的大海美丽而富饶,钠元素是其中含量较高的元素。下图为钠的原子结构示意图,有关钠原子的说法不正确的是( ) A.核外有3个电子层 B.质子数为11C.易失电子形成阳离子 D.“+”表示钠原子带正电11.(2022年陕西省中考B卷)化学符号具有独特的学科内涵。下列各项对相关符号含义的说法正确的是( )A.2H2O2:只能表示2个过氧化氢分子B.:只能表示硫酸根离子C.只能表示氩原子的结构示意图:D.Ag:只能表示金属银12.(2022年甘肃省武威市中考)化学用语是学习化学的重要工具。请用适当的化学符号填空。(1)保持氦气化学性质的最小粒子______。(2)地壳中含量最多的金属元素______。(3)标出H2O中氢元素的化合价______。(4)写出如图所示粒子的符号______。 (5)高铁酸钠由Na+和构成,则高铁酸钠的化学式为______。
相关试卷
这是一份人教版九年级上册课题2 原子的结构课时训练,文件包含培优分级练人教版化学九年级第1次月考月考测评卷解析版docx、培优分级练人教版化学九年级第1次月考月考测评卷原卷版docx等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。
这是一份九年级上册第七单元 燃料及其利用课题2 燃料的合理利用与开发复习练习题,共13页。试卷主要包含了化学反应中的能量变化,化石燃料的利用,使用燃料对环境的影响,能源的利用和开发等内容,欢迎下载使用。
这是一份人教版九年级上册课题 1 燃烧和灭火课堂检测,共4页。试卷主要包含了燃烧,灭火的原理,火场逃生,易燃易爆物安全知识等内容,欢迎下载使用。










