

高中化学鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构学案及答案
展开一、杂化轨道理论
1.轨道杂化和杂化轨道
2.甲烷分子的空间结构
(1)甲烷的分子组成和结构
(2)甲烷中碳原子的杂化类型
(1)有多少个原子轨道发生杂化就形成多少个杂化轨道。( )
(2)杂化轨道用于形成π键。( )
[答案] (1)√ (2)×
3.苯分子的空间结构
(1)苯的空间结构
(2)苯分子中的大π键:六个碳原子上各有一个未参与杂化的垂直于碳环平面的2p轨道,这六个轨道以“肩并肩”的方式形成含有六个电子、属于六个碳原子的大π键。
硼氮苯,硼与氮形成的类似苯的化合物,分子式为B3N3H6,俗称无机苯,又称环硼氮六烷。无机苯遇水会发生水解反应,水解产物为氨气与硼酸。硼氮苯液体密度0.81 g·cm-3(55 ℃时),固体密度1.00 g·cm-3 (-55 ℃时),熔点-58 ℃,沸点55 ℃,液体折射率1.382 1,临界温度为252 ℃。如图是硼氮苯的结构式。
根据硼氮苯的结构式,回答以下几个问题:
(1)已知硼氮苯的结构与苯的结构相似,均是平面正六边形结构,则硼氮苯中N原子和B原子的轨道杂化方式是什么?
提示:由于B原子和N原子均为平面结构,故二者的杂化方式均是sp2杂化。
(2)硼氮苯中,主要有哪几种类型的共价键?
提示:主要有B与H之间sp2s σ键、N与H之间sp2s σ键、B和N之间的sp2sp2 σ键和一个大π键。
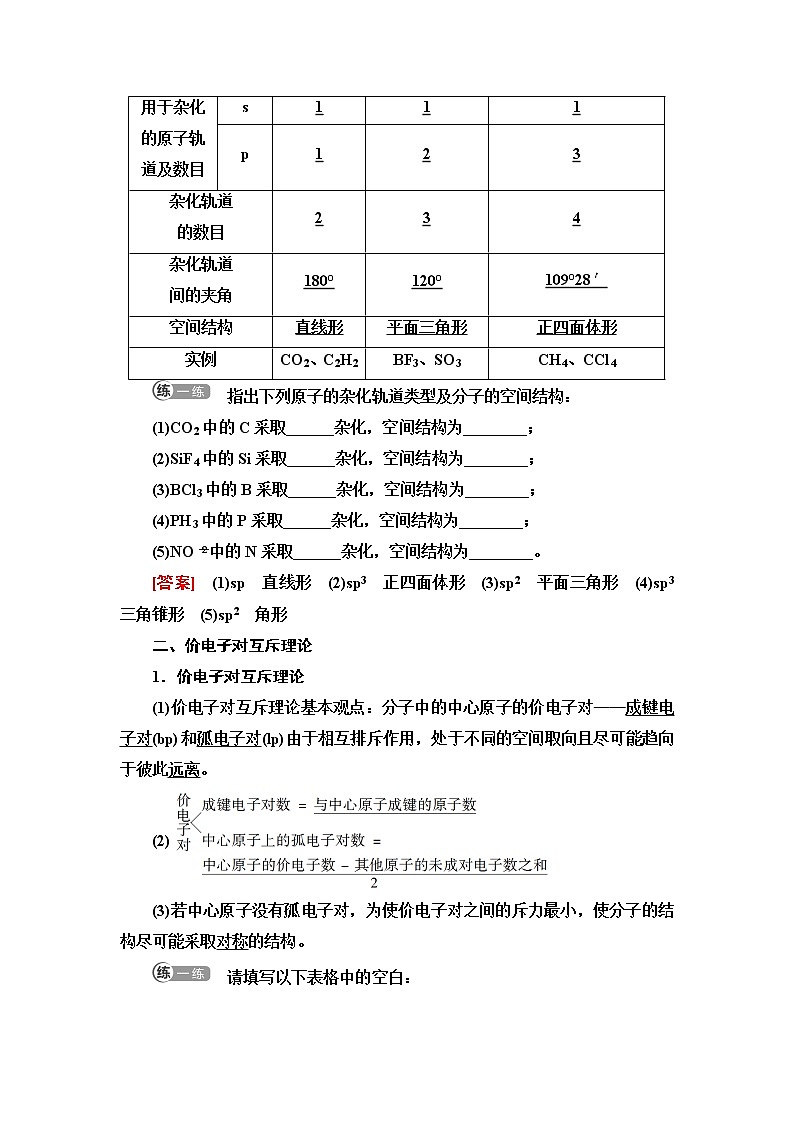
4.杂化轨道的类型
指出下列原子的杂化轨道类型及分子的空间结构:
(1)CO2中的C采取______杂化,空间结构为________;
(2)SiF4中的Si采取______杂化,空间结构为________;
(3)BCl3中的B采取______杂化,空间结构为________;
(4)PH3中的P采取______杂化,空间结构为________;
(5)NOeq \\al(-,2)中的N采取______杂化,空间结构为________。
[答案] (1)sp 直线形 (2)sp3 正四面体形 (3)sp2 平面三角形 (4)sp3 三角锥形 (5)sp2 角形
二、价电子对互斥理论
1.价电子对互斥理论
(1)价电子对互斥理论基本观点:分子中的中心原子的价电子对——成键电子对(bp)和孤电子对(lp)由于相互排斥作用,处于不同的空间取向且尽可能趋向于彼此远离。
(2)
(3)若中心原子没有孤电子对,为使价电子对之间的斥力最小,使分子的结构尽可能采取对称的结构。
请填写以下表格中的空白:
2.等电子原理
(1)内容:化学通式相同且价电子总数相等的分子或离子具有相同的空间结构和相同的化学键类型等结构特征。
(2)应用
①判断一些简单分子或原子团的空间结构。
a.SOeq \\al(2-,4)、POeq \\al(3-,4)等离子具有AX4通式,价电子总数为32,中心原子采取sp3杂化,呈四面体形空间结构。
b.SOeq \\al(2-,3)、ClOeq \\al(-,3)等离子具有AX3通式,价电子总数为26,中心原子采取sp3杂化,由于存在孤电子对,分子呈三角锥形空间结构。
②利用等电子体在性质上的相似性制造新材料。
③利用等电子原理针对某物质找等电子体。
NH3和H3O+两种微粒是等电子体吗?为什么?若是,微粒的空间结构是什么?
提示:NH3和H3O+两种微粒的原子和价电子总数都相等,是等电子体,其空间结构相似(三角锥形)。
有机化合物是自然界中存在最多的一类化合物,了解有机物分子中化学键特征以及成键方式是研究有机物性质的基础。有机化合物的一些空间结构示意图如图。
1.烷烃分子中碳原子杂化方式是否相同?采用的杂化轨道类型有哪些?
提示:由于碳原子的成键方式均是与其他原子形成单键,所以杂化方式相同,均采用sp3杂化成键。
2.甲苯分子中所有碳原子的杂化方式是否相同?采用何种杂化方式?
提示:甲苯分子中碳原子的杂化方式不全相同。其中甲基上的碳原子采用sp3杂化成键,苯环上的所有碳原子均是sp2杂化成键。
3.烯烃的碳碳双键和炔烃的碳碳三键上的碳原子的杂化方式是否相同?若不相同,则各是什么杂化方式(若相同,此问不回答)?
提示:不相同。碳碳双键上的碳原子采用的杂化方式是sp2杂化,碳碳三键上碳原子是sp杂化成键。
1.杂化轨道的特点
(1)形成分子时,通常存在激发、杂化和轨道重叠等过程。
(2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的。
(3)杂化前后轨道数目不变。
(4)杂化后轨道伸展方向、形状发生改变。
(5)只有能量相近的轨道才能杂化(ns、np)。
2.分子空间结构的确定
(1)杂化轨道用于形成σ键或容纳孤电子对。
(2)未参与杂化的p轨道用于形成π键。
1.(2021·天津大学附属中学高二检测)下列分子的空间结构可用sp2杂化轨道来解释的是( )
①BF3 ②CH2===CH2 ③Cl2C===CCl2 ④CH≡CH ⑤NH3 ⑥CH4
A.①②③ B.①⑤⑥ C.②③④ D.③⑤⑥
A [sp2杂化轨道形成夹角为120°的平面三角形,①BF3为平面三角形且B—F键之间的夹角为120°;②C2H4中碳原子发生sp2杂化,且未杂化的2p轨道形成π键;③与②相似;④乙炔中的碳原子发生sp杂化;⑤NH3中的氮原子发生sp3杂化;⑥CH4中的碳原子发生sp3杂化。]
2.(2021·海口实验中学高二检测)形成下列分子时,一个原子用sp3杂化轨道和另一个原子的p轨道成键的是( )
①PF3 ②CCl4 ③NH3 ④H2O
A.①② B.②③ C.③④ D.①④
A [PF3分子中,磷原子的最外层电子排布为3s23p3,中心磷原子采用sp3杂化,形成4个杂化轨道,一个杂化轨道被一对孤电子对占据,另外3个杂化轨道分别与氟原子的2p轨道形成3个σ键;CCl4为正四面体形结构,碳原子采用sp3杂化,4个杂化轨道分别与4个氯原子的3p轨道形成4个σ键;由于氢原子核外p轨道没有电子,因此NH3和H2O不符合题意。]
3.下列说法正确的是( )
A.中心原子为sp3杂化的分子一定是四面体形结构
B.中心原子为sp2杂化的分子不一定是平面形结构
C.通过sp3杂化轨道形成的化合物分子中含有σ键
D.通过sp2或sp杂化轨道形成的化合物分子中一定含有π键
C [有孤电子对的中心原子采用sp3杂化形成的化合物可能是角形或三角锥形,A项错误;中心原子为sp2杂化的分子一定是平面结构,B项错误;sp3杂化轨道只能形成σ键,C项正确;BF3中的B原子为sp2杂化,BeF2中Be原子为sp杂化,但二者中均没有π键,D项错误。]
如图所示为水分子的结构模型。
1.成键电子对与孤电子对之间斥力大小顺序是什么?
提示:lp—lp≫lp—bp>bp—bp。
2.氧原子的价电子排布式为2s22p4,两个2p轨道各有一个未成对电子,可分别与一个H原子的1s电子形成一个σ键,不须杂化。但事实是:氧原子形成了四个sp3杂化轨道,且键角是104.5°,空间结构为角形,怎么解释?
提示:在形成水分子时,O的2s轨道和2p轨道发生了sp3杂化,形成四个sp3杂化轨道,呈正四面体形。其中两个sp3杂化轨道中各有一个未成对电子,另外两个sp3杂化轨道已有两对孤电子对,不再成键。氧原子与氢原子化合时,O的sp3杂化轨道与H的1s轨道重叠,形成两个σ键。由于两对孤电子对的电子云密集在O的周围,对两个成键的电子对有更大的排斥作用,使O—H键之间的键角被压缩,因此H2O分子的空间结构为角形。
1.价电子对互斥理论(VSEPR理论)在确定分子空间结构中的应用
(1)确定中心原子A的杂化轨道数
①对于ABm型分子,中心原子的杂化轨道数可以这样计算。
n=eq \f(1,2)(中心原子的价电子数+配位原子的成键电子数)
例如:
②离子的杂化轨道计算
n=eq \f(1,2)(中心原子的价电子数+配位原子的成键电子数±电荷数)。
(2)确定价电子对的空间结构
由于价电子对之间的相互排斥作用,它们趋向于尽可能地相互远离。价电子对的空间结构与价电子对数目的关系如表:
(3)分子空间结构确定
根据分子中成键电子对数和孤电子对数,可以确定相应的较稳定的分子空间结构,如表:
中心原子上的孤电子对数=
eq \f(中心原子的价电子数-其他原子的未成对电子数之和,2)
例如,H2O中的中心原子为氧原子,其价电子数为6,氢原子未成对电子数为1,可知:
氧原子上的孤电子对数=eq \f(6-1×2,2)=2。
电子对间的排斥力大小比较
多重键、成键电子对与孤电子对的斥力大小顺序为三键—三键>三键—双键>双键—双键>双键—单键>单键—单键,lp—lp≫lp—bp>bp—bp。
2.等电子原理在确定分子结构中的应用
(1)互为等电子体应满足的条件
①化学通式相同。
②价电子总数相等。
(2)等电子原理的应用
①利用等电子原理可以判断一些简单分子或原子团的空间结构。如NH3和H3O+的空间结构相似(三角锥形);SiCl4、SOeq \\al(2-,4)、POeq \\al(3-,4)都呈四面体形空间结构。
②等电子体不仅有相似的空间结构,且有相似的性质。
等电子体的换算方法
(1)将微粒中的两个原子换成原子序数分别增加n和减少n(n=1,2等)的原子,如N2和CO、Neq \\al(-,3)和CNO-互为等电子体。
(2)将微粒中一个或几个原子换成原子序数增加(或减少)n的元素对应的带n个单位电荷的阳离子(或阴离子),如N2O和Neq \\al(-,3)互为等电子体。
(3)同主族元素最外层电子数相等,故可将微粒中的原子换成同主族元素原子,如O3和SO2互为等电子体。
1.下列微粒中,中心原子含有两对孤电子对的是( )
A.SiH4 B.H2O C.CH4 D.NH3
BD [SiH4、H2O、CH4、NH3的电子式分别为、、、,H2O分子中的O原子上有两对孤电子对,NH3有一对孤电子对。]
2.若ABn的中心原子A上没有未用于形成共价键的孤电子对,下列说法正确的是( )
A.若n=2,则分子的空间结构为角形
B.若n=3,则分子的空间结构为三角锥形
C.若n=4,则分子的空间结构为正四面体形
D.以上说法都不正确
C [若中心原子A上没有未用于成键的孤电子对,则根据斥力最小的原则,当n=2时,分子的空间结构为直线形;n=3时,分子的空间结构为平面三角形;n=4时,分子的空间结构为正四面体形。]
3.通常把原子总数和价电子总数相同的分子或原子团称为等电子体,人们发现等电子体的空间结构相同。已知B3N3H6分子的结构与苯相似,则下列有关说法中正确的是( )
A.CH4和NHeq \\al(+,4)互为等电子体,键角均为60°
B.NOeq \\al(-,3)和COeq \\al(2-,3)互为等电子体,均为平面三角形结构
C.H3O+和PCl3互为等电子体,均为三角锥形结构
D.B3N3H6和苯互为等电子体,B3N3H6分子中不存在“肩并肩”的方式重叠的轨道
B [CH4和NHeq \\al(+,4)的原子数都是5,价电子总数都是8,互为等电子体,空间结构为正四面体结构,键角为109°28′,故A错误;NOeq \\al(-,3)和COeq \\al(2-,3)的原子数都是4,价电子总数都是24,互为等电子体,均为平面三角形结构,故B正确;H3O+价电子总数是8,PCl3价电子总数是26,二者价电子总数不同,不互为等电子体,故C错误;B3N3H6分子的结构类似苯,存在π键,π键是p轨道以“肩并肩”的方式重叠形成的,所以B3N3H6分子中存在“肩并肩”的方式重叠的轨道,故D错误。]
1.下列图形表示sp2杂化轨道的电子云轮廓图的是( )
A B C D
D [A项,杂化轨道的空间结构为直线形,夹角为180°,共有2个杂化轨道,为sp杂化,错误;B项,未形成杂化轨道,错误;C项,杂化轨道的空间结构为正四面体形,共有4个杂化轨道,为sp3杂化,错误;D项,杂化轨道的空间结构为平面三角形,夹角为120°,共有3个杂化轨道,为sp2杂化,正确。]
2.下列有关键角与分子空间结构的说法不正确的是( )
A.键角为180°的分子,空间结构是直线形
B.键角为120°的分子,空间结构是平面三角形
C.键角为60°的分子,空间结构可能是正四面体形
D.键角为90°~109°28′之间的分子,空间结构可能是角形
B [键角为180°的分子,空间结构是直线形,例如CO2分子是直线形分子,A正确;苯分子的键角为120°,但其空间结构是平面正六边形,B错误;白磷分子的键角为60°,空间结构为正四面体形,C正确;水分子的键角为104.5°,空间结构为角形,D正确。]
3.下列各物质中的中心原子不是采用sp3杂化的是( )
A.NH3 B.H2O C.CO2 D.CCl4
C [NH3为三角锥形,但中心原子氮原子采用sp3杂化,形成4个等同的轨道,其中一个由一对孤电子对占据,余下的3个未成对电子各占一个。H2O为角形,但其中的氧原子也是采用sp3杂化形成4个等同的轨道,其中两对孤电子对分别占据两个轨道,剩余的2个未成对电子各占一个。CCl4分子中C原子也采用sp3杂化,但CO2分子中C原子为sp杂化,CO2为直线形分子。]
4.关于原子轨道的说法正确的是( )
A.凡是中心原子采取sp3杂化轨道成键的分子其空间结构都是正四面体形
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相同的新轨道
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
C [中心原子采取sp3杂化,分子的空间结构可能为正四面体形,但如果中心原子还有孤电子对,分子的空间结构不是正四面体形。CH4分子中的sp3杂化轨道是C原子的一个2s轨道与三个2p轨道杂化而成的。AB3型的共价化合物,A原子可能采取sp2杂化或sp3杂化。]
5.(1)SeO3的空间结构为______________,SeOeq \\al(2-,3)的VSEPR模型为______________。
(2)与SeO3互为等电子体的一种阴离子为________(填化学式)。
(3)SCleq \\al(+,3)和PCl3互为等电子体,SCleq \\al(+,3)的空间结构是______________。S—Cl键的键长________P—Cl键的键长(填“>”“=”或“<”),原因是________
___________________________________________________________________。
(4)碳负离子(CHeq \\al(-,3))的空间结构为________________________,与CHeq \\al(-,3)互为等电子体的一种分子是________(填化学式)。
[解析] (1)SeO3的中心原子Se原子的价电子对数是3,且不存在孤电子对,所以其空间结构为平面三角形;SeOeq \\al(2-,3)的中心原子Se原子的价电子对数是3+eq \f(6+2-3×2,2)=4,所以其VSEPR模型为四面体形。
(2)等电子体的原子总数相同、价电子总数相同,故与SeO3互为等电子体的阴离子为COeq \\al(2-,3)、NOeq \\al(-,3)或SiOeq \\al(2-,3)。
(3)SCleq \\al(+,3)中中心原子S原子的价电子对数=σ键个数+孤电子对数=3+eq \f(1,2)×(6-1-3×1)=4,且含1对孤电子对,所以其空间结构为三角锥形;键长与形成键的原子半径有关,S原子半径小于P原子半径,故S—Cl键键长比P—Cl键键长短。
(4)CHeq \\al(-,3)中中心原子C原子的价电子对数=3+eq \f(1,2)×(4+1-3×1)=4,且含1对孤电子对,故其空间结构为三角锥形;等电子体的原子总数相等、价电子总数相等,因此与CHeq \\al(-,3)互为等电子体的分子可以为NH3或PH3。
[答案] (1)平面三角形 四面体形
(2)COeq \\al(2-,3)(或NOeq \\al(-,3)、SiOeq \\al(2-,3))
(3)三角锥形 < S原子半径小于P原子半径,故S—Cl键要比P—Cl键短
(4)三角锥形 NH3(或PH3)
学 习 任 务
1.能用杂化轨道理论解释或预测某些分子或离子的空间结构。建立杂化理论模型。 2.理解价电子对互斥理论和等电子原理,能根据有关理论、原理判断简单分子或离子的空间结构。培养宏观辨识与微观探析的核心素养。 3.通过分析常见分子或离子的空间结构,构建利用杂化轨道理论、电子对互斥理论的认知模型。培养证据推理与模型认知的核心素养。
分子式
空间结构
空间填充模型
球棍模型
CH4
杂化类型
sp
sp2
sp3
用于杂化的原子轨道及数目
s
1
1
1
p
1
2
3
杂化轨道
的数目
2
3
4
杂化轨道
间的夹角
180°
120°
109°28′
空间结构
直线形
平面三角形
正四面体形
实例
CO2、C2H2
BF3、SO3
CH4、CCl4
分子
成键电子对数
孤电子对数
H2O
2
2
NH3
3
1
H2S
2
2
CH4
4
0
正确认识杂化轨道理论
杂化
轨道
类型
杂化
理论
模型
成键
电子
对数
孤电
子对
数
电子对的排
列方式
分子的
空间结
构
实例
sp
直线形
2
0
直线形
HC≡CH、
BeCl2、
CO2
sp2
平面
三角形
3
0
平面
三角形
BF3、
BCl3
2
1
角形
SnBr2、
PbCl2
sp3
四面
体形
4
0
正四
面体
形
CH4、
CCl4
3
1
三角
锥形
NH3、
NF3
2
2
角形
H2O
确定分子空间结构的简易方法
代表物
杂化轨道数(n)
杂化轨道类型
CO2
eq \f(1,2)(4+0)=2
sp
CH2O
eq \f(1,2)(4+2+0)=3
sp2
CH4
eq \f(1,2)(4+4)=4
sp3
SO2
eq \f(1,2)(6+0)=3
sp2
NH3
eq \f(1,2)(5+3)=4
sp3
H2O
eq \f(1,2)(6+2)=4
sp3
代表物
杂化轨道数(n)
杂化轨道类型
NOeq \\al(-,3)
eq \f(1,2)(5+1)=3
sp2
NHeq \\al(+,4)
eq \f(1,2)(5-1+4)=4
sp3
价电子对数目
2
3
4
5
6
价电子对结构
直线形
三角形
正四面体形
三角双锥形
正八面体形
价电子对数
成键电子对数
孤电子对数
VSEPR模型
分子空间结构
实例
2
2
0
直线形
直线形
BeCl2
3
3
0
三角形
三角形
BF3
2
1
角形
SnBr2
4
4
0
四面体形
四面体形
CH4
3
1
三角锥形
NH3
2
2
角形
H2O
鲁科版 (2019)选择性必修2第2章 微粒间相互作用与物质性质第2节 共价键与分子的空间结构第3课时导学案: 这是一份鲁科版 (2019)选择性必修2第2章 微粒间相互作用与物质性质第2节 共价键与分子的空间结构第3课时导学案,共7页。
高中化学鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构第2课时学案设计: 这是一份高中化学鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构第2课时学案设计,共13页。
高中化学第2节 共价键与分子的空间结构第1课时导学案: 这是一份高中化学第2节 共价键与分子的空间结构第1课时导学案,共16页。学案主要包含了选择题,非选择题等内容,欢迎下载使用。













