


高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体优秀课件ppt
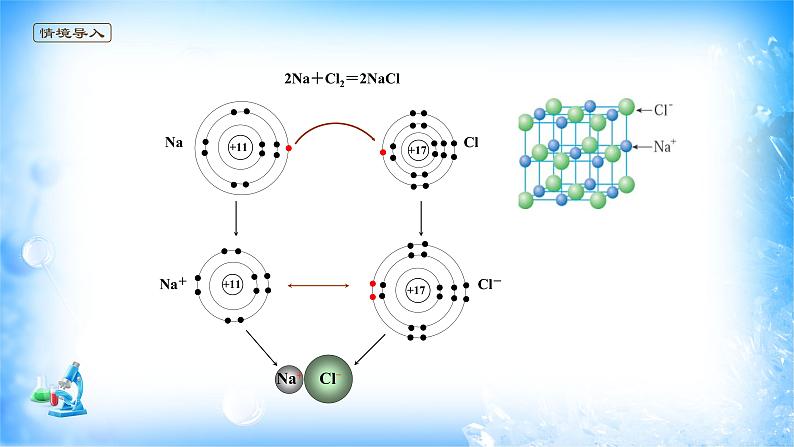
展开2Na+Cl2=2NaCl
【思考】(1)如果把阴、阳离子看成是球形对称的,阴阳离子的电荷分布是均匀的,则它们在空间的各个方向上的静电作用是否相同?
【提示】它们在空间的各个方向上的静电作用是相同。
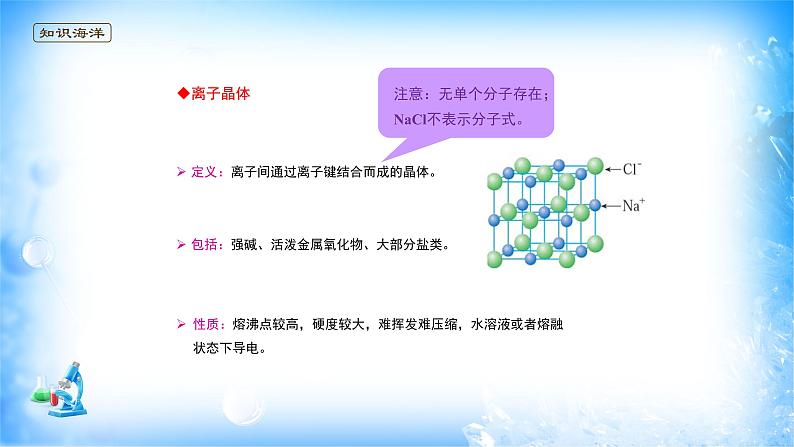
包括:强碱、活泼金属氧化物、大部分盐类。
定义:离子间通过离子键结合而成的晶体。
性质:熔沸点较高,硬度较大,难挥发难压缩,水溶液或者熔融状态下导电。
【例】下列物质中,含有共价键的离子晶体是( )A.NaClD.I2
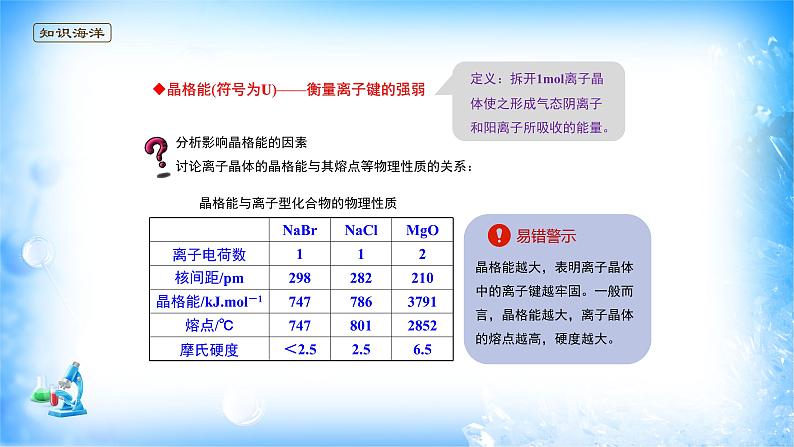
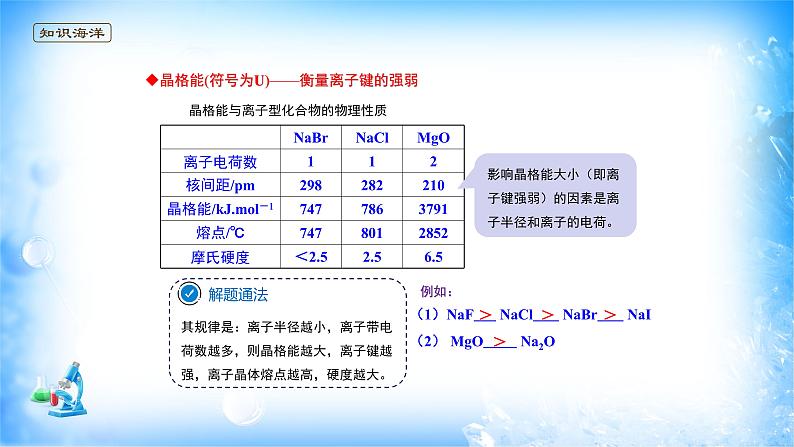
晶格能与离子型化合物的物理性质
分析影响晶格能的因素讨论离子晶体的晶格能与其熔点等物理性质的关系:
晶格能(符号为U)——衡量离子键的强弱
(1)NaF NaCl NaBr NaI(2) MgO Na2O
【例】离子晶体不可能具有的性质是( )A.具有较高的熔点和沸点B.易溶于水,难溶于非极性溶剂C.具有良好的导电性D.坚硬而易粉碎
【例】 下列大小关系正确的是( )A.熔点:NaI>NaBr B.硬度:MgO>CaOC.晶格能:NaCl<NaBr D.熔点:CO2>NaCl
【解析】二者均为离子晶体,离子半径:I->Br-,离子半径越小,晶格能越大,离子晶体的熔点越高,A错误;二者均为离子晶体,离子半径:Mg2+<Ca2+,离子半径越小,晶格能越大,硬度越大,B正确;二者均为离子晶体,离子半径:Cl-<Br-,离子半径越小,晶格能越大,C错误;CO2为分子晶体,NaCl为离子晶体,离子晶体的熔点高于分子晶体的熔点,D错误。
比较以下离子晶体的熔点,分析这些离子晶体熔点差异很大的原因。
熔点低于室温,离子液体
大多数离子液体含有体积很大的阴、阳离子。常见的阴离子如四氯铝酸根(AlCl4-)、六氟磷酸根(PF6-)、四氟硼酸根(BF4-)等,常见的阳离子如季铵离子(R4N+,即NH4+的—H被烃基—R取代)、带烃基侧链的咪唑、嘧啶等有环状含氮结构的有机胺阳离子等。
传统的有机溶剂大多易挥发,它们的蒸气大多有毒,而离子液体却有难挥发的优点,这是由于离子液体的粒子全都是带电荷的离子。
1-丁基-3-甲基咪唑六氟磷酸盐
离子液体可用作溶剂。例如,有一种叫天丝的织物纤维,是将树木的纤维素分子溶于一种离子液体,滤去不溶的木质素后,加水析出纤维素分子组装成的再生植物纤维。离子液体有良好的导电性,用作电化学研究的电解质,并被开发为原电池的电解质。许多离子液体被用于有机合成的溶剂和催化剂,如合成药物。离子液体在生物化学等科研领域也有广泛应用。
离子液体用途有哪些呢?
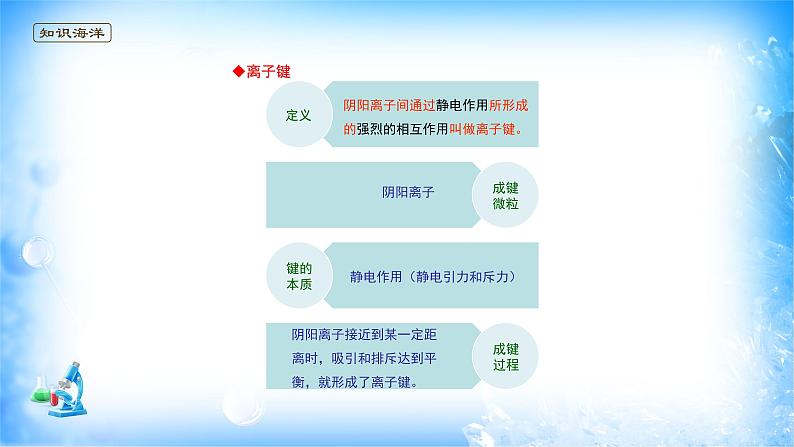
定义:阴阳离子间通过静电作用所形成的强烈的相互作用叫做离子键。
键的本质:静电作用(静电引力和斥力)
成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
定义:离子间通过离子键结合而成的晶体。注意:无单个分子存在;NaCl不表示分子式。
离子键的特征:无方向性和饱和性
高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体试讲课ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体试讲课ppt课件,共19页。PPT课件主要包含了你知道吗,学科网原创,石墨的晶体结构模型,混合晶体,LiC2,六元环,硅酸盐,纳米晶体等内容,欢迎下载使用。
化学第三节 金属晶体与离子晶体精品ppt课件: 这是一份化学第三节 金属晶体与离子晶体精品ppt课件,共20页。PPT课件主要包含了你知道吗,氯化钠型晶胞,Cl-,Na+,CsCl型晶胞,CaF2型晶胞,ZnS型晶胞等内容,欢迎下载使用。
高中人教版 (2019)第三节 金属晶体与离子晶体评优课课件ppt: 这是一份高中人教版 (2019)第三节 金属晶体与离子晶体评优课课件ppt,共27页。PPT课件主要包含了密置层,二维平面堆积方式,非密置层,Ⅰ简单立方堆积,三维空间堆积方式,Ⅱ体心立方堆积,第一层,Ⅲ六方堆积,Ⅳ面心立方堆积,堆积方式及性质小结等内容,欢迎下载使用。













