
2021南阳高三上期期终质量评估理科综合化学试题含答案
展开
这是一份2021南阳高三上期期终质量评估理科综合化学试题含答案,共9页。试卷主要包含了本试卷分第Ⅰ卷两部分,本试卷共16页,可能用到的相对原子质量,设NA为阿伏加德罗常数的值等内容,欢迎下载使用。
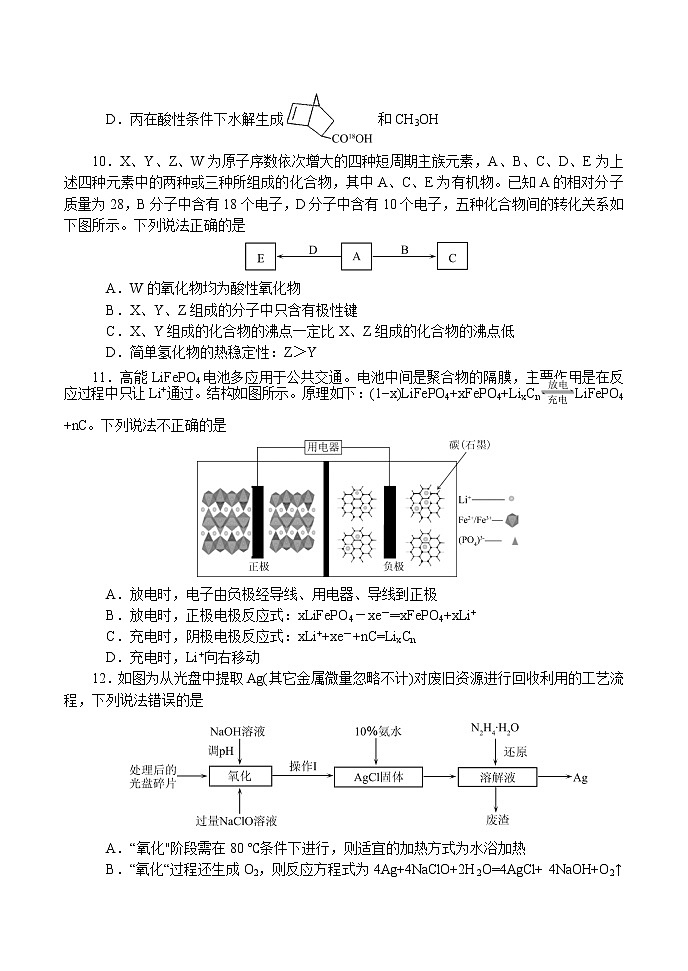
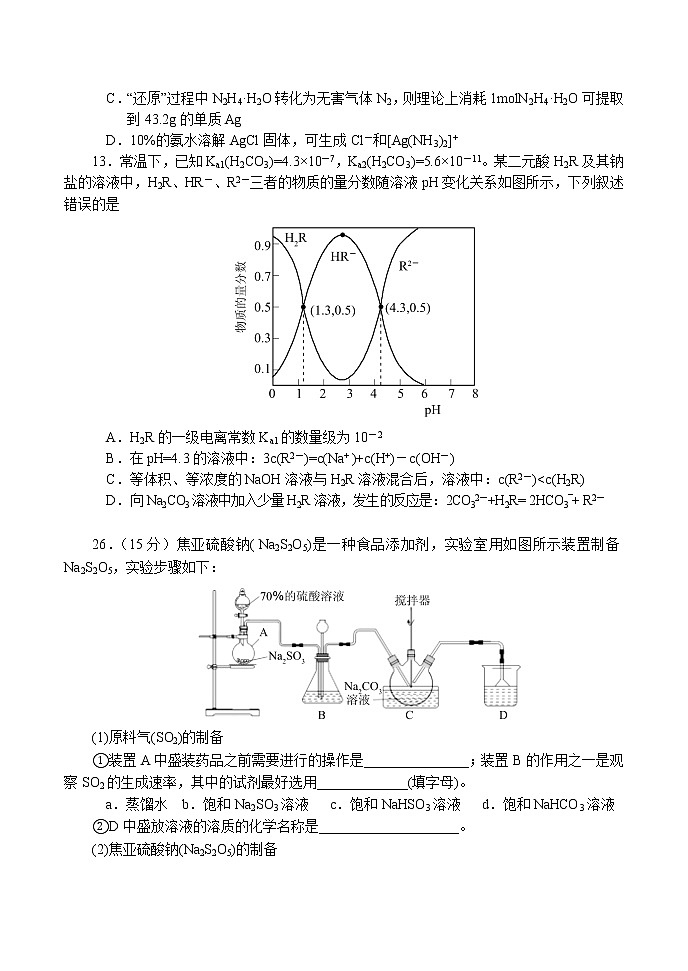
南阳市2020年秋期高中三年级期终质量评估理科综合能力测试 化学注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证号填写在试卷和答题卡上。2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号框涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号框。写在本试卷上无效。 3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷和草稿纸上无效。 4.考试结束,务必将试题卷和答题卡一并交回。5.本试卷共16页。如遇缺页、漏页、字迹不清等情况,考生须及时报告监考老师。 6.可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 Ag 108第Ι卷 选择题一、选择题。本题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。7.化学是现代生产、生活与科技的中心学科之一,下列与化学有关的说法,正确的是A.“嫦娥五号”着陆器在月面展示的国旗主要材料为国产高性能芳纶纤维,属于新型无机非金属材料B.石墨烯是由单层碳原子构成的平面结构新型碳材料,属于烯烃C.泡沫灭火器可用于一般的起火,也适用于电器起火D.绿色化学的核心是利用化学原理从源头上减少或消除工业生产对环境的污染8.设NA为阿伏加德罗常数的值。下列叙述中正确的是A.1molFe与高温水蒸气完全反应,转移电子的数目为3NAB.28g C5H10的烃分子中,含有的碳碳双键的数目为0.4NAC.常温常压下,7.0g由丁烯与丙烯组成的混合气体中含有的氢原子数目为NAD.5mL0.1mol/LCH3 COOH 溶液和10mL 0.5mol/L CH3COOH溶液中所含CH3COOH分子数相等9.有机化合物甲与乙在一定条件下可反应生成丙:下列说法正确的是A.甲与乙生成丙的反应属于取代反应B.甲分子中所有原子共平面C.乙的一氯代物有3种D.丙在酸性条件下水解生成和CH3OH 10.X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种或三种所组成的化合物,其中A、C、E为有机物。已知A的相对分子质量为28,B分子中含有18个电子,D分子中含有10个电子,五种化合物间的转化关系如下图所示。下列说法正确的是A.W的氧化物均为酸性氧化物B.X、Y、Z组成的分子中只含有极性键C.X、Y组成的化合物的沸点一定比X、Z组成的化合物的沸点低D.简单氢化物的热稳定性:Z>Y11.高能LiFePO4电池多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。原理如下:(1−x)LiFePO4+xFePO4+LixCnLiFePO4+nC。下列说法不正确的是A.放电时,电子由负极经导线、用电器、导线到正极B.放电时,正极电极反应式:xLiFePO4-xe-═xFePO4+xLi+C.充电时,阴极电极反应式:xLi++xe-+nC=LixCn D.充电时,Li+向右移动12.如图为从光盘中提取Ag(其它金属微量忽略不计)对废旧资源进行回收利用的工艺流程,下列说法错误的是A.“氧化"阶段需在80 ℃条件下进行,则适宜的加热方式为水浴加热B.“氧化“过程还生成O2,则反应方程式为4Ag+4NaClO+2H2O=4AgCl+ 4NaOH+O2↑C.“还原”过程中N2H4·H2O转化为无害气体N2,则理论上消耗1molN2H4·H2O可提取到43.2g的单质Ag D.10%的氨水溶解AgCl固体,可生成Cl-和[Ag(NH3)2]+13.常温下,已知Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述错误的是A.H2R的一级电离常数Ka1的数量级为10-2B.在pH=4.3的溶液中:3c(R2-)=c(Na+ )+c(H+)-c(OH-)C.等体积、等浓度的NaOH溶液与H2R溶液混合后,溶液中:c(R2-)<c(H2R) D.向Na2CO3溶液中加入少量H2R溶液,发生的反应是:2CO32-+H2R= 2HCO3¯+ R2- 26.(15分)焦亚硫酸钠( Na2S2O5)是一种食品添加剂,实验室用如图所示装置制备Na2S2O5,实验步骤如下:(1)原料气(SO2)的制备①装置A中盛装药品之前需要进行的操作是_______________;装置B的作用之一是观察SO2的生成速率,其中的试剂最好选用_____________(填字母)。a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液②D中盛放溶液的溶质的化学名称是____________________。(2)焦亚硫酸钠(Na2S2O5)的制备①Na2S2O5溶于水且与水能反应,所得溶液显酸性,其原因是_________________,步骤III中测定溶液的pH的方法是_____________________;pH>4.1时,则产品中会有副产物,其化学式是_____________。 ②结晶脱水生成产品的化学方程式为________________________________。 (3)产品含量的测定测定产品中焦亚硫酸钠的质量分数,已知S2O52-+2I2 +3H2O=2SO42-+4I-+6H+;2S2O32-+ I2 =S4O62-+2I-。请补充实验步骤(可提供的试剂有焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水)。①精确称量0.2000g焦亚硫酸钠样品放入碘量瓶(带磨口塞的锥形瓶)中;②向碘量瓶中准确移取V1 mL浓度为c1 mol·L-1的标准碘溶液(过量),在暗处放置5min,然后加入5mL冰醋酸及适量蒸馏水;③加入淀粉溶液,用c2mol·L-1标准Na2S2O3溶液滴定至溶液___________,读数;④重复步骤①~③;根据相关记录数据计算出平均值:标准Na2S2O3溶液为V2 mL。⑤产品中焦亚硫酸钠的质量分数为______________(用含有c1、c2、V1、V2的式子表示)。27.(14分)从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是____(填字母序号)。a.Fe b.FeO c.Fe3O4 d.Fe2O3(2)从硫酸工业废渣(主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%)中提取红氧化铁(Fe2O3)的工艺流程如图(部分操作和条件略):回答下列问题:①在步骤i焙烧的目的是_______________________________。步骤ii的滤渣为_________。②在步骤iii操作中,滴加氨水除Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5 mol·L-1,则溶液的pH为_______。③在步骤iv中发生的反应中有一种气态产物,它是_________(写化学式)。④步骤v中,发生反应的化学方程式为______________________________________。(3)工业上,利用硫酸亚铁为原料,通过铁黄(FeOOH,一种不溶于水的黄色固体)制备高铁酸钾(K2FeO4),可降低生产成本且产品质量优。工艺流程如下:①由图知需先制得高铁酸钠溶液,然后加入饱和KCl溶液转化为高铁酸钾,说明相同温度下溶解度:高铁酸钾______高铁酸钠(填“>”或“<”)。②写出由铁黄制备高铁酸钠的离子方程式_____________________________________。③高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH放电时电池的正极反应式为___________________________________。28.(14分)南阳市创建“全国文明城市”,对氮的氧化物、碳的氧化物做了广泛深入的研究并妥善处理具有重要意义。I.已知2NO(g)+O2(g)2NO2(g)的反应历程分两步:第一步:2NO(g)N2O2(g)(快)∆H1<0;v1正=k1正c2(NO);v1逆=k1逆c(N2O2)第二步:N2O2(g)+O2(g)2NO2(g)(慢) ∆H2<0;v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)①2NO(g)+O2(g)2NO2(g)的反应速率主要是由________(填“第一步”或“第二步”)反应决定。②一定温度下,反应2NO(g)+O2(g)2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ;II.利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放。(1)已知重整过程中部分反应的热化方程式为:①CH4(g)=C(s)+2H2(g) ΔH>0②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH>0③CO(g)+H2(g)=C(s)+H2O(g) ΔH<0固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。同温度下CO2的平衡转化率 (填“大于”“小于”或“等于”)CH4的平衡转化率。(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g)+CH4(g)2CO(g)+2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。III.利用铜基配合物1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段,其装置原理如图所示。①电池工作过程中,图中Pt电极附近溶液的pH_______(填“变大”或“变小”)。 ②每转移2mol电子,阴极室溶液质量增加______g。35.【化学——物质结构与性质】(15分)秋冬季我国北方大部分地区出现严重雾霾天气,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,城市雾霾中还含有铜等重金属元素。(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、等二次污染物。①基态N原子的电子排布式___________;C、N和O的第一电离能由大到小的顺序为___________。②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是________,写出一种与氨硼烷互为等电子体的分子________(填化学式)。(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。①(NH4)2SO4晶体中各种微粒间存在的作用力有________(填序号)。a.离子键 b.共价键 c.配位键 d.范德华力 ②NH4NO3中阴离子的空间构型为________,阳离子的中心原子轨道采用________杂化。(3)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为a nm,该合金的化学式为 ,晶体中每个镁原子周围距离最近的铝原子数目为 ,该晶体的密度为 g/cm3(阿伏伽德罗常数的数值用NA表示)。36.【化学——有机化学基础】(15分)乙酰氧基胡椒酚乙酸酯(F)具有抗氧化性、抗肿瘤作用,其合成路线如下图所示。已知:(1)A→B的反应类型为__________。(2)化合物C的名称是__________。(3)化合物E中所含官能团的名称__________。(4)写出化合物F与足量NaOH溶液反应的化学方程式___________。(5)写出同时满足下列条件的E的一种同分异构体的结构简式:_________。①能与FeCl3溶液发生显色反应;②能发生银镜反应;③核磁共振氢谱显示有4种不同化学环境的氢,其峰面积比为6∶2∶1∶1。(6)请以乙醛和甲苯为原料制,写出相应的合成路线流程图__________。(无机试剂任用,合成路线流程图如题示例) 2020秋期期末高三化学参考答案 D 8.C 9.C 10.D 11.B 12.C 13.C(15分)(1)①检查装置气密性(1分) c (1分)②氢氧化钠(或其他合理答案)(1分)(2)①Na2S2O5与水反应生成NaHSO3,NaHSO3在水中电离程度大于水解程度,使溶液显酸性 (2分)用 pH 计测定(或精密PH试纸)(2分) Na2SO3(2分)②2NaHSO3=Na2S2O5 + H2O (2分)(3)由蓝色恰好变为无色,且半分钟内不变色(2分) 47.5(c1V1-c 2 V2)% (2分)27. (14分)(1)c(1 分) (2 )①还原 Fe2O3(2 分) SiO2(1 分)② 5(2 分) ③CO2(1 分) ④4FeCO3+O2=2Fe2O3+4CO2 (2 分) (3) ①<(1 分)②2FeOOH+3ClO- +4OH-═2FeO42- +3Cl- +3H2O(2 分) ③FeO42- +3e- +4H2O=Fe(OH)3↓+5OH-(2 分)28.(14分)I. ① 第二步(2分) ② (2分) II.(1)大于(2分) (2) 大于(2分) Pa2(单位可不写)(2分) III.①变小(2分)②46(2分)35.(15分)(1)①1s22s22p3 (1分) N>O>C(1分)②N(1分) C2H6(1分)(2)①abc (2分)②平面三角形(2分) sp3(1分)(3)Mg2Al(2分) 4(2分) (2分)36.(15分)(1)加成反应(2分)(2)对羟基苯甲醛(或4—羟基苯甲醛)(2分)(3)羟基、碳碳双键(2分)(4)+3NaOH→+2CH3COONa+H2O(3分)(5)或(2分)(6)
相关试卷
这是一份河南省南阳市2023-2024学年高二上学期1月期终质量评估化学试题,文件包含河南省南阳市2023-2024学年高二上学期1月期末化学试题pdf、高二化学答案pdf等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
这是一份河南省南阳市2022-2023学年高二上学期期终质量评估化学试题 Word版,共13页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份2020南阳高一上学期期终质量评估化学试卷扫描版含答案,共10页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。










