

2021厦门湖滨中学高三10月月考化学试题含答案
展开厦门市湖滨中学高三上学期10月考化学试卷
可能用到的相对原子质量:N 14 O 16 Cu 64
一、选择题(只有一个正确答案,每小题3分,16题共48分)
1.下列化学与生活知识中叙述正确的是( )
A.汽车尾气导致白色污染 B.甲醛是某些劣质装饰板材释放的常见污染物之一
C.酸雨是指pH<7的雨水,主要由于空气中SO2含量偏高引起
D.臭氧空洞的形成与二氧化碳的过量排放有关
2.下列不存在丁达尔效应的分散系是①有尘埃的空气、②溴水、③蒸馏水、④沸水中加几滴FeCl3浓溶液、⑤淀粉溶液 ( )
A.② B.②③⑤ C.②③ D.①②③⑤
3.下列有关无机非金属材料的说法中,不正确的是( )
A、高纯硅可用于制造半导体材料
B、SiO2 制成玻璃纤维,由于导电能力强而被用于制造光缆
C、玻璃、水泥、陶瓷其成分均含有硅酸盐
D、Si3N4是一种新型无机非金属材料,可用于制造发动机
4.氯气是一种化学性质很活泼的单质,它具有较强的氧化性,下列叙述中不正确的是( )
A.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟
B.氯气通入品红溶液中,溶液会褪色;氯气通入紫色石蕊试液,溶液变红不褪色
C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰
D.氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸
5.有三个氧化还原反应:①2FeCl3+2KI2FeCl2+2KCl+I2;
②2FeCl2+Cl22FeCl3;③2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O。
若某溶液中有 Fe2+和I-共存,要除去I-而不影响Fe2+,可以加入的试剂是( )
A.Cl2 B.FeCl3 C.HCl D.KMnO4
6.下列各组物质作用时,反应条件(温度、反应物用量比)改变,不引起产物种类改变的是( )
A.Na和O2 B.NaOH溶液和CO2
C.Na2O2和CO2 D.NaOH溶液和Ca(HCO3)2溶液
7.实验中常将溶液或试剂进行酸化,下列试剂选择和酸化处理正确的是( )
A.检验SO42-,将BaCl2溶液用HNO3酸化
B.为了提高KMnO4溶液的氧化能力,用盐酸将其酸化
C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液
D.配制FeCl2溶液时通常加少量HNO3酸化,以避免其变质
8.在实验室用MnO2与浓盐酸混合加热制Cl2,可以代替MnO2的物质为( )
) A.酸性比MnO2更强的P2O5或SO3 B.碱性比MnO2更强的Na2O或MgO
C.氧化性比MnO2更强的KMnO4或K2Cr2O7 D.还原性比MnO2更强的H2S或HI
9.用下面的方案进行某些离子的检验,其中方案设计得最严密的是( )
A.检验试液中的SO42-:试液无沉淀白色沉淀
B.检验试液中的Fe2+:试液无明显现象红色溶液
C.检验试液中的I_:试液 棕黄色溶液 蓝色溶液
D.检验试液中的CO32-:试液白色沉淀沉淀溶解
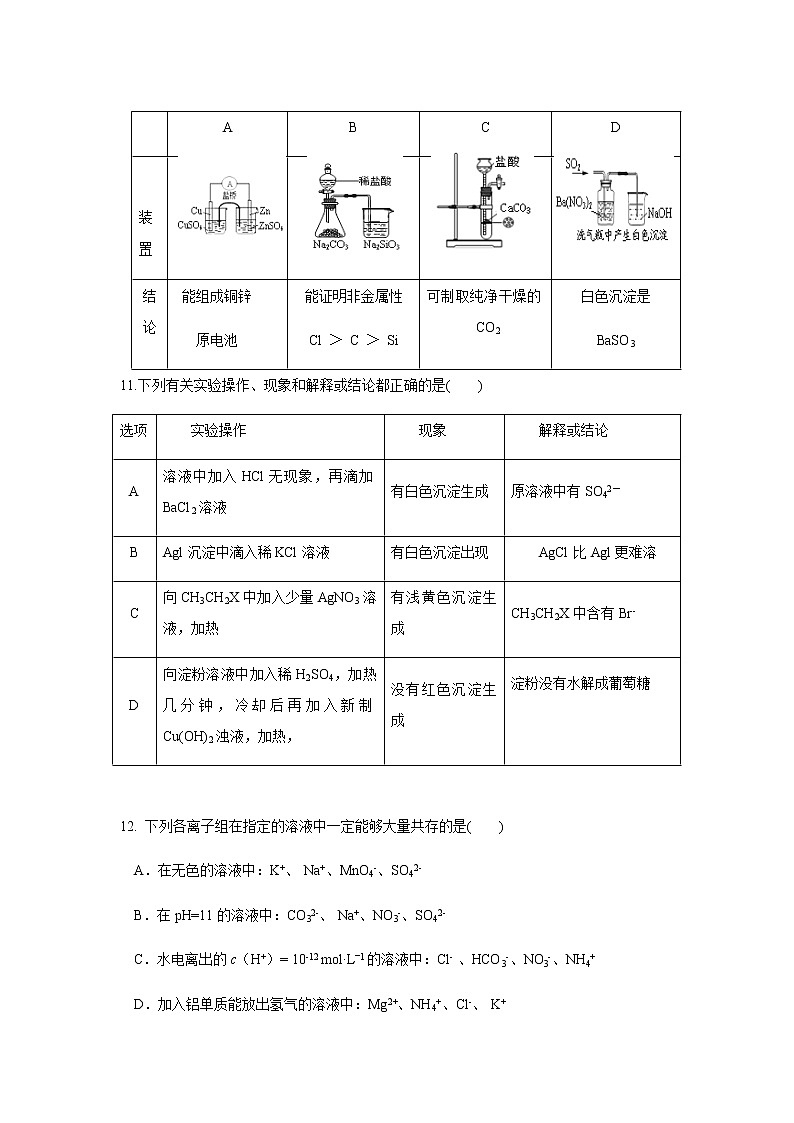
10.下列装置及实验与结论对应正确的是( )
A
B
C
D
装置
结论
能组成铜锌
原电池
能证明非金属性
Cl > C > Si
可制取纯净干燥的CO2
白色沉淀是
BaSO3
11.下列有关实验操作、现象和解释或结论都正确的是( )
选项
实验操作
现象
解释或结论
A
溶液中加入HCl无现象,再滴加BaCl2溶液
有白色沉淀生成
原溶液中有SO42-
B
Agl沉淀中滴入稀KCl溶液
有白色沉淀出现
AgCl比Agl更难溶
C
向CH3CH2X中加入少量AgNO3溶液,加热
有浅黄色沉淀生成
CH3CH2X中含有Br-
D
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,
没有红色沉淀生成
淀粉没有水解成葡萄糖
12. 下列各离子组在指定的溶液中一定能够大量共存的是( )
A.在无色的溶液中:K+、 Na+、MnO4-、SO42-
B.在pH=11的溶液中:CO32-、 Na+、NO3-、SO42-
C.水电离出的c(H+)= 10-12 mol·L‾1的溶液中:Cl- 、HCO3-、NO3-、NH4+
D.加入铝单质能放出氢气的溶液中:Mg2+、NH4+、Cl-、 K+
13.下列实验测量数据记录正确的是( )
A.用pH试纸测得0.100 mol/L醋酸的pH为3.02
B.用量筒测得排水法收集的氢气体积为50.28 mL
C.用滴定管测得中和滴定所消耗的标准溶液体积为20.32 mL
D.用托盘天平称得2.50 g胆矾,受热充分失水后固体质量减轻0.90 g
14.高铁酸钠(Na2FeO4)可以对饮用水进行净化处理,可由下列方法制得:
Fe2O3+3Na2O2 2Na2FeO4+Na2O,关于该反应说法正确的是( )
A.Na2FeO4属于共价化合物 B.反应中Na2O2是氧化剂
C.生成1 mol Na2FeO4,有6 mol 电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
15. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.1L 1mol·L‾1 的硫酸铝溶液中含有的Al3+为2NA
B.1 L pH=1的硫酸溶液中含有的H+为0.2NA
C.标准状况下,22.4L 的乙烷中含极性共价键的数目为7NA
D.常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子
16.三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3+3F2===NF3+3NH4F。在潮湿的空气中,NF3能与水蒸气发生氧化还原反应,其反应的产物有HF、NO和HNO3。下列说法正确的是( )
A.在NF3与H2O的反应中,H2O作还原剂 B.NF3在空气中一旦泄漏,不易于发现
C.若在制取NF3的反应中有0.5 mol NH3参加反应,转移电子的物质的量为3 mol
D.制取NF3的反应中,氧化剂与还原剂的物质的量之比为3∶1
二、非选择题(本大题共4小题,共52分)
17.(19分)(1)SO2使橙色溴水褪色的化学方程式:
(2)铜与浓硫酸加热制SO2的化学方程式:
(3)草酸(弱酸H2C2O4)使酸性高锰酸钾褪色放出CO2气体的离子方程式:
(4)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
①______+________→________+________+________+H2O
②反应物中发生氧化反应的物质是________,被还原的元素是________。
③反应中1 mol氧化剂________(填“得到”或“失去”)________mol电子。
④请将反应物的化学式及配平后的系数填入下列相应的位置中:
________+________―→
(5)四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是
3Fe2++2S2O+O2+xOH-===Fe3O4+S4O+2H2O。请回答下列问题。
①水热法制备Fe3O4纳米颗粒的反应中,还原剂是____。
②反应的化学方程式中x=________。
③每生成1 mol Fe3O4,反应转移的电子为________mol,被Fe2+还原的O2的物质的量为________mol。
18.(15分)下图是氯碱工业的流程及产物的部分转化关系,其中A、B、C、D、E分别表示一种或多种物质。
请回答下列问题:
(1)离子膜电解槽中发生反应的化学方程式为: 。
(2)C产生在离子膜电解槽的 (填“阴极室”或“阳极室”),写出A的化学式
(3)反应④的离子方程式为: 。
(4)粗盐水中含有泥沙、Ca2+、Mg2+、SO42—等杂质,必须除去杂质后使用。已知:KSP[Mg(OH)2]=5.6110-12; KSP[MgCO3]=6.8210-6,为了尽可能除去Mg2+,你选用纯碱还是烧碱: ; 粗盐水精制的过程中可能用到①盐酸、②烧碱、③纯碱、④氯化钡、⑤过滤,添加试剂及操作的合理顺序是 (填序号)。
(5)氯碱工业的产品都有广泛的用途。下图是从海水中提取镁的流程,其中步骤③的操作是 ,步骤④需要用到D,原因是 。
19.(10分)A、B、C均为中学化学常见的单质,其中一种是金属,通常状况下,A为固体,B为黄绿色气体,C为空气中主要气体之一,其余均为化合物,X是一种常用的具有挥发性的无氧强酸,E为黑色固体,H为无色液体,它们之间的转化关系如图(其中某些反应条件和产物已略去)。
+B
⑤
+A
④
A 加热 ⑦
X
③
①
点燃
②
B
A
C
E
G
D
H
F
⑥
血红色
液体
(1)写出:A的化学式 ,F的化学式 。
(2)在反应①~⑦中,不属于氧化还原反应的是 (填序号)。
(3)完成:E和X反应的离子方程式: ;
(4)完成H和某种化合物快速制C的化学方程式
(5)B蒸气与过量氨气混合有白烟及另一种气体单质产生,该反应的化学方程式为:
。
20.(8分)(1)自来水厂用ClO2处理后的水,可用碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入过量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。(已知:2ClO2+2I-=2ClO2-+I2)
Ⅱ.Na2S2O3溶液滴定到终点。(已知:2S2O+I2===S4O+2I-)
问题:①滴定终点时的现象:
②若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液15 mL,则水样中ClO2的浓度是________mol·L-1。
(2)24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2R2O7溶液反应,则元素R在还原产物中的化合价是________。
(3)将0.64 g Cu全部溶于一定量的浓硝酸中,测得生成气体0.009 mol(含NO、NO2和N2O4),共消耗硝酸0.032 mol。将生成的气体与空气混合,再通入NaOH溶液中,氮氧化物被完全吸收,产物只有NaNO3和H2O。计算空气中参加反应的O2在标准状况下的体积为________mL。
2020-2021学年湖滨10月考化学试卷答题卡
班级 姓名 考号 成绩
一、选择题(只有一个正确答案,每小题3分,16题共48分)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
二、非选择题(本大题共4小题,共52分)
17.(19分)
(1)(2分)
(2)(2分)
(3)(2分)
(4)①(2分)
② (共2 分) ③ (共2 分)
④(2分)________+________―→
(5)① 、 ② ③ (每空各1分共5分)
18.(15分)
(1)(2分)
(2)(1分) (1分) (2分)
(3)(2分)
(4) (2分) (2分)
(5) (2分) (2分)
19.(10分)
(1) (1分) (1分) (2) (2分)
(3)(2分)
(4)(2分)
(5)(2分)
20.(8分)
(1)① (2分) ② (2分)
(2) (2分) (3) (2分)
厦门市湖滨中学高三上学期10月考化学试卷
参考答案
一、 选择题(只有一个正确答案,每小题3分,16题共48分)
1
2
3
4
5
6
7
8
B
A
A
B
B
C
C
C
9
10
11
12
13
14
15
16
C
A
A
B
C
B
D
D
二、非选择题(本大题共4小题,共52分)
17.(19分)
(1)SO2 + Br2 + 2H2O=H2SO4+2HBr(2分)
(2)Cu + 2H2SO4(浓)CuSO4 +SO2↑+2H2O(2分)
(3)2MnO4- +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O(2分)
(4)①FeSO4+HNO3―→Fe(NO3)3+Fe2(SO4)3+N2O+H2O(2分)
② FeSO4 (各1分共2 分) ③得到 4 (各1分共2 分)
④24FeSO4+30 HNO3―→(2分)
(5)①Fe2+、S2O ②4 ③4 0.5(每空各1分共5分)
18.(15分)
(1)2NaCl+2H2OCl2↑+ H2↑+2NaOH (2分)
(2)阴极室(1分) 做燃料(或者合成氨、做还原剂等其它合理答案)(2分)
(3)Cl2+2OH—=Cl—+ClO—+H2O (2分)
(4)烧碱(2分) ④②③⑤①或④③②⑤①或②④③⑤①(2分)
(5)蒸发结晶(2分) 防止MgCl2•H2O水解,无法得到无水MgCl2 (2分)
19.(10分)
(1)Fe(1分) KSCN(或NH4SCN)(1分) (2)③⑥(2分)
(3)Fe3O4+8H+=Fe2++2Fe3++4H2O(2分)
(4)2Na2O2+2H2O=4NaOH+O2↑(2分) (5)3Cl2+8NH3=6NH4Cl+N2(2分)
20.(8分)
(1)①蓝色消失,且半分钟内不变色(2分) ②1.5×10-5(2分)
(2)+3价(2分) (3)112(2分)
2024厦门湖滨中学高二上学期期中化学试卷含答案: 这是一份2024厦门湖滨中学高二上学期期中化学试卷含答案,共7页。试卷主要包含了选择题等内容,欢迎下载使用。
福建省厦门市湖滨中学2023-2024学年高三上学期期中化学试题(Word版附答案): 这是一份福建省厦门市湖滨中学2023-2024学年高三上学期期中化学试题(Word版附答案),共9页。试卷主要包含了 下列反应的离子方程式正确的是, 下列说法正确的是等内容,欢迎下载使用。
2024厦门湖滨中学高三上学期期中考试化学含答案: 这是一份2024厦门湖滨中学高三上学期期中考试化学含答案,文件包含福建省厦门市湖滨中学2023-2024学年高三上学期期中考试化学docx、福建省厦门市湖滨中学2023-2024学年高三上学期期中考试化学答案docx等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。












