




2020扬州中学高三下学期5月质量检测化学含答案
展开
这是一份2020扬州中学高三下学期5月质量检测化学含答案
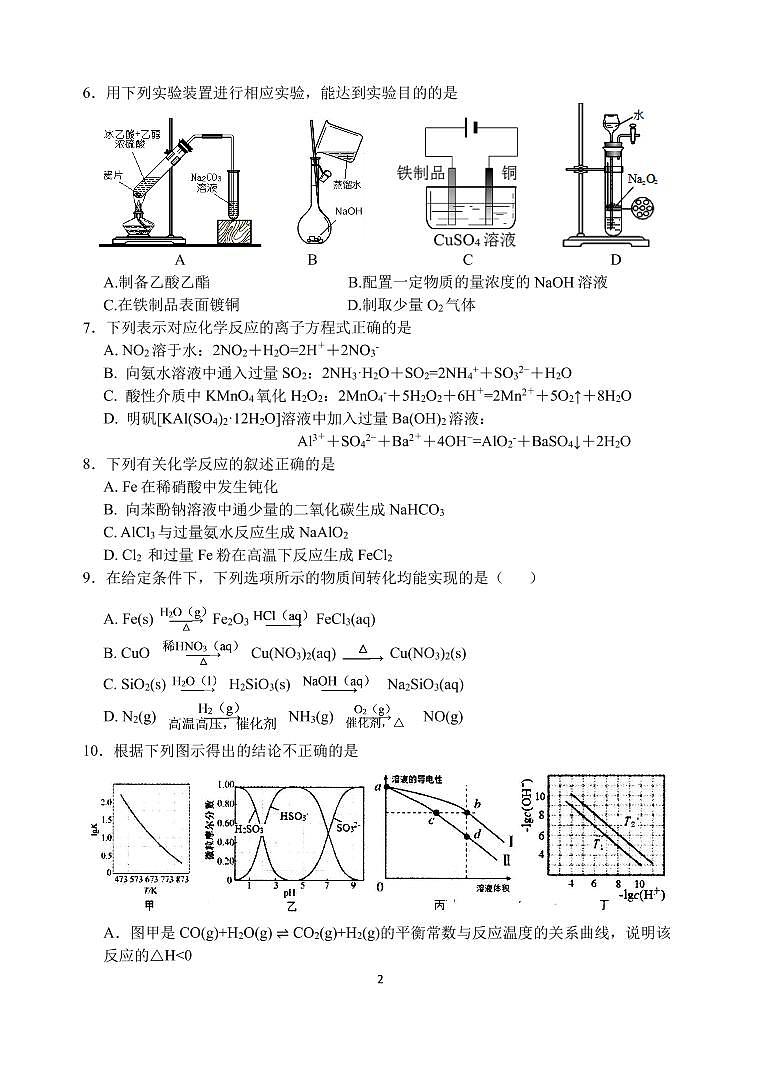
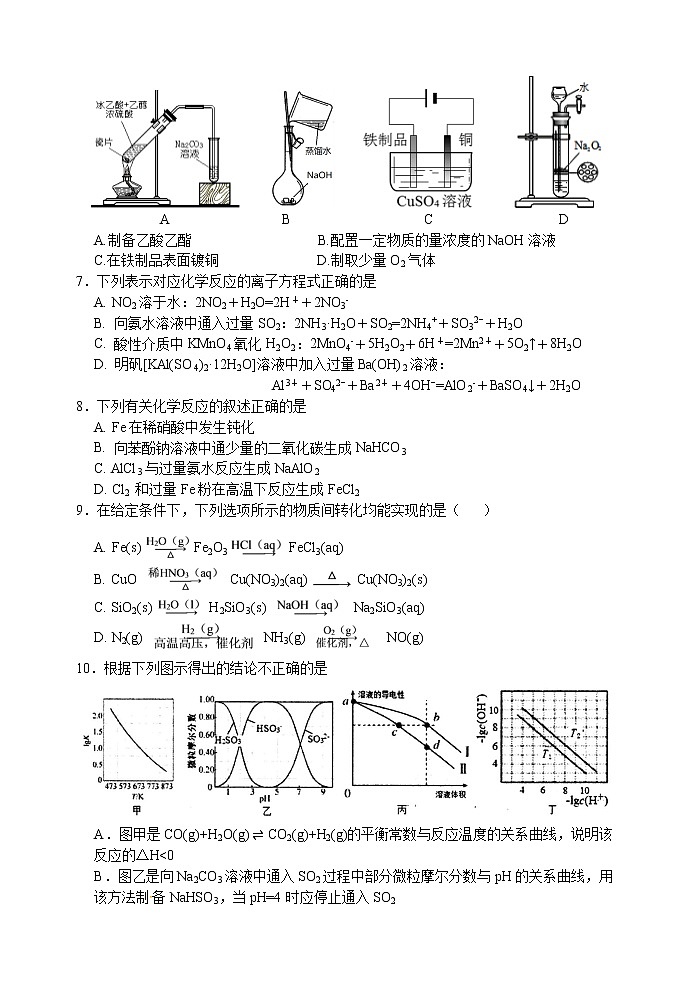
江苏省扬州中学高三阶段考试 化 学 2020.5.23可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na-23 S-32 Mn-55 Fe-56 选择题(共40分)单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。1.下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是2.下列化学用语不正确的是A. 中子数为10的氧原子:O B. Al原子的结构示意图:C. CCl4分子的比例模型: D. Na2O2的电子式:3.下列有关物质性质与用途具有对应关系的是A.NH4HCO3受热易分解,可用作氮肥B.SiO2熔点高硬度大,可用于制光导纤维C.乙醇能使蛋白质变性,75%乙醇可消杀病毒、细菌D.Na2S具有还原性,可作废水中Cu2+和Hg2+的沉淀剂4.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层电子数是次外层的3倍,Y是迄今发现的非金属性最强的元素,在周期表中Z位于ⅠA族,W与X属于同一主族。下列说法正确的是A.原子半径:r(X)<r(Y)<r(Z)<r(W) B.由X、Z两种元素组成的化合物一定没有共价键C.W的最高价氧化物对应水化物为弱酸D.Y的简单气态氢化物的热稳定性比W的强 5.室温下,下列各组离子在指定溶液中能大量共存的是A. 使甲基橙呈红色的溶液:Fe2+、Mg2+、SO42-、Cl-B. 使KSCN呈红色的溶液:Al3+、NH4+、S2−、I-C. 使酚酞呈红色的溶液:Mg2+、Cu2+、NO3−、SO42−D. 由水电离出的c(H+)=10-12mol·L-1的溶液:Na+、K+、NO3−、HCO3−6.用下列实验装置进行相应实验,能达到实验目的的是 A B C DA.制备乙酸乙酯 B.配置一定物质的量浓度的NaOH溶液C.在铁制品表面镀铜 D.制取少量O2气体7.下列表示对应化学反应的离子方程式正确的是A. NO2溶于水:2NO2+H2O=2H++2NO3-B. 向氨水溶液中通入过量SO2:2NH3·H2O+SO2=2NH4++SO32−+H2OC. 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2OD. 明矾[KAl(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液:Al3++SO42−+Ba2++4OH−=AlO2-+BaSO4↓+2H2O8.下列有关化学反应的叙述正确的是A. Fe在稀硝酸中发生钝化B. 向苯酚钠溶液中通少量的二氧化碳生成NaHCO3C. AlCl3与过量氨水反应生成NaAlO2D. Cl2 和过量Fe粉在高温下反应生成FeCl29.在给定条件下,下列选项所示的物质间转化均能实现的是( )A. Fe(s) Fe2O3 FeCl3(aq)B. CuO Cu(NO3)2(aq) Cu(NO3)2(s)C. SiO2(s) H2SiO3(s) Na2SiO3(aq)D. N2(g) NH3(g) NO(g)10.根据下列图示得出的结论不正确的是A.图甲是CO(g)+H2O(g) ⇌ CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△Hb>dD.图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。11.下列说法正确的是A.CH3Cl(g)+Cl2(g)CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0B.室温下,稀释0.1 mol·L−1 NH4Cl溶液,溶液中增大C.反应N2(g)+3H2(g)2NH3(g) ΔH0B. 图中P点所示条件下,延长反应时间能提高CH3OH的产率C. 图中Q点所示条件下,增加CO2浓度可提高H2的转化率D. 520K时,反应CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g)的平衡常数K=非选择题(共80分)16.(12分)工业上由MnS矿(还含少量FeCO3、MgO等)制备高纯硫酸锰,工艺如图所示:已知相关金属离子(浓度为0.1mol·L-1)形成氢氧化物沉淀的pH范围如下:(1)“酸浸”过程中,MnS(难溶)发生反应的离子方程式为______▲_____。(2)“酸浸”时MnO2应过量,目的是_____▲_______和将Fe2+氧化为Fe3+。(3)已知Ksp[Fe(OH)3]=4×10−38。常温下,当溶液的pH=2时,c(Fe3+)=______▲_____mol·L−1。(4)“除杂”时若溶液pH过低,Mg2+沉淀不完全,原因是__________▲_____________。(5)“沉锰”反应的化学方程式为_____▲______。(6)用MnO2悬浊液吸收SO2也可以制取MnSO4。将SO2和空气的混合气通入MnO2悬浊液,测得吸收液中Mn2+、SO42-的浓度随反应时间t变化如图。导致Mn2+、SO42-浓度变化产生明显差异的原因是_____▲______。17.(15分)化合物H是一种治疗失眠症的药物,其一种合成路线如图:已知:(1)化合物G中所含官能团的名称为__▲___和___▲___。(2)G→H的化学反应类型为___▲____反应。(3)化合物B的结构简式为_____▲________________。(4)E的一种同分异构体满足下列条件,写出该同分异构体的结构简式:____▲_____。①含有萘环();②能发生水解反应,水解所得两种产物中碳原子数之比为3∶10。(5)写出以和(EtO)2POCH2CN为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线例见本题题干) ▲ 18.(12分)用MnO2为原料可制取电极材料锰酸锂(LiMnxOy),工业上利用菱锰矿粉(MnCO3)制备MnO2的流程如图:(1)“酸溶”过程中加入过量的硫酸目的是________▲__________。(2)写出“电解”反应的离子反应方程式:________▲__________。(3)为测定LiMnxOy中Mn元素的平均化合价(高于+2价),现进行如下实验:步骤1:取少量LiMnxOy,分成两等份,分别置于两只锥形瓶中;步骤2:向一只锥形瓶中加入稀硝酸和双氧水,完全反应后,LiMnxOy中Mn元素转化为Mn2+,除去过量的双氧水。调节pH,滴加指示剂,用浓度为0.400mol·L-1的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(已知:Mn2+与EDTA反应的化学计量数之比为1∶1);步骤3:向另一锥形瓶中加入1.340gNa2C2O4和足量硫酸,充分反应后,用0.100mol·L-1KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液16.00mL。步骤3实验过程中物质发生的转化如下,其中C2O42-均转化为CO2:①步骤3滴定终点时的实验现象是_________▲__________。②计算LiMnxOy中Mn元素的平均化合价(写出计算过程)。_________▲_________19.(15分)以铜片(含少量杂质铁)为原料制取Cu(NO3)2溶液的实验流程如图:(1)“酸洗”的目的是除去铜片表面难溶的Cu2(OH)2SO4,写出“酸洗”时反应的离子方程式: ________________▲__________________。(2)“水洗”后检验铜片表面是否洗涤干净的方法是_________▲_________。(3)“酸溶”时的装置如图所示,烧杯内所发生的反应为:NO+NO2+2OH-=2NO2-+H2O2NO2+2OH-=NO2-+NO3-+H2O①“酸溶”时为防止反应过于剧烈,可以采取的方法有_____▲_____和_______▲______。②通入空气的作用是__________▲_____________、________▲___________。(4)“调节pH=3~4,并保温3个小时”的目的是___________▲________________。 (5)烧杯中所得溶液经多步处理得到NaNO3固体。设计以烧杯中所得溶液为原料,制取NaNO3固体的实验方案:____________________________________________________ ___________________________________▲______________________________________________________________________________________________________________。[已知3NaNO2+2HNO3=3NaNO3+2NO↑+H2O;NaNO3的溶解度随温度变化如图所示。实验中必须使用的试剂:硝酸和NaOH溶液]。20.(14分)随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:(1)制取甲胺的反应为CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:则该反应的ΔH=___▲____kJ·mol-1。(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) ⇌CH3OH(g) ΔH
相关试卷
这是一份2020武汉高三下学期3月质量检测化学含答案,共10页。试卷主要包含了非选择题的作答,选考题的作答等内容,欢迎下载使用。
这是一份2020杭州高三下学期教学质量检测化学试题PDF版含答案
这是一份2020扬州中学高三下学期6月阶段性检测化学含答案








