

2021林州一中高二下学期第二次月考化学试题含答案
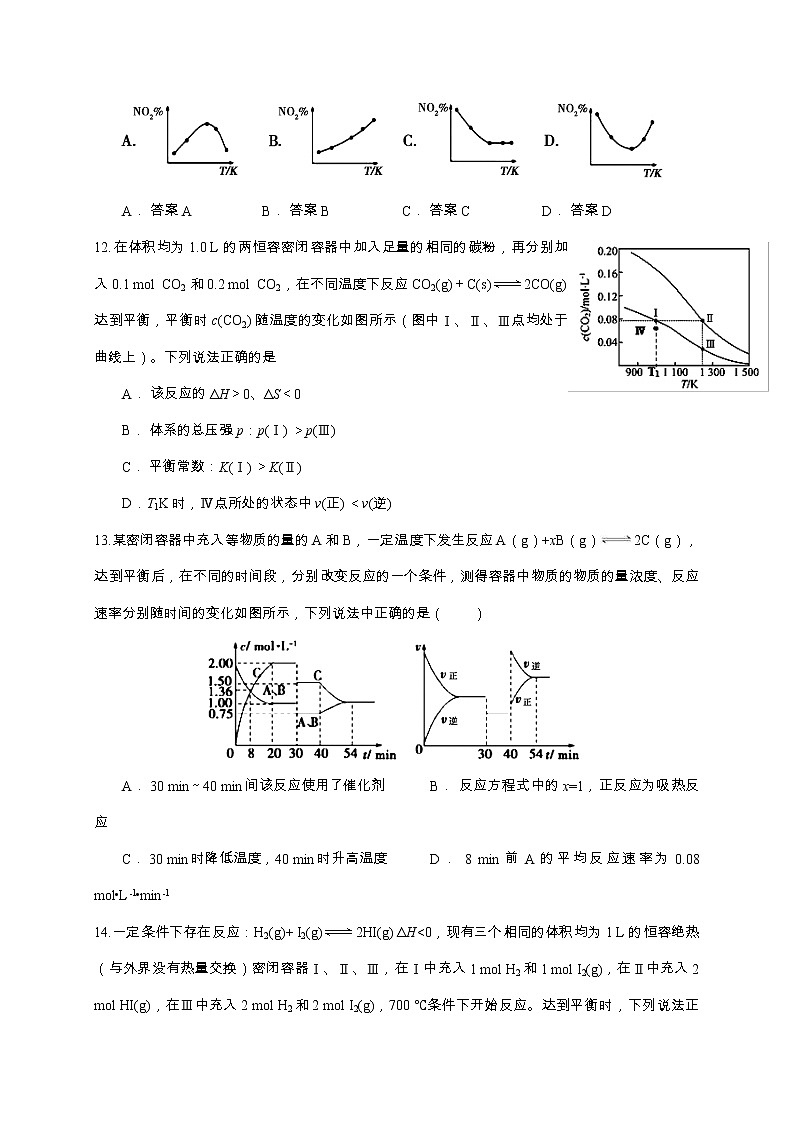
展开2019级高二4月调研考试化学试题一、选择题(共20小题,每小题3分,共60分) 1.在常温下,某无色溶液中,由水电离出的c(H+)=1×10-14mol·L-1,则该溶液中,一定能大量共存的离子是( )A. K+、Na+、MnO、SO B. Na+、CO、AlO、Cl-C. K+、Na+、Cl-、Br- D. K+、Cl-、Ba2+、HCO2.Li﹣SO2电池具有输出功率高和低温性能好等特点。电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应为2Li+2SO2Li2S2O4。列说法正确的是( )A. 该电池反应为可逆反应 B. 放电时,Li+向负极移动C. 充电时,阴极反应式为Li++e﹣===Li D. 该电池的电解质溶液可以换成LiBr的水溶液3.设NA为阿伏加德罗常数的值。下列说法正确的是( )A. 1 mol·L-1的AlCl3溶液中,含Al3+数小于NAB. 标准状况下,将2.24 L氯化氢溶于足量水中,溶液中含有的HCl分子数为NAC. 1 mol NaBH4中含的离子的数目为6NAD. 30 g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA4.在空气中直接蒸发下列盐的溶液:①Fe2(SO4)3②Na2CO3③KCl ④CuCl2⑤NaHCO3可以得到相应盐的晶体(可以含有结晶水)的是( )A. ①③⑤ B. ①②③ C. ②④ D. ①③④⑤5.将含有一个羟基的化合物A 10 g,与乙酸反应生成乙酸某酯11.85 g,并回收到未反应的A 1.3 g,则A的相对分子质量约为( )A. 98 B. 116 C. 158 D. 2786.amL三种气态烃组成的混合物与足量氧气混合,点燃爆炸后,恢复到原来的状态(常温、常压),体积共缩小2amL。则三种烃可能是( )A. CH4、C2H4、C3H4 B. C2H6、C3H6、C4H6C. CH4、C2H6、C3H8 D. C2H4、C2H2、CH47.测得某乙酸乙酯和乙酸的混合物中含氢的质量分数为7.8%,则此混合物中含氧元素的质量分数为( )A. 56.4% B. 49.8% C. 45.4% D. 15.6%8.已知HA为酸性略强于醋酸的一元弱酸,则在0.1 mol·L-1NaA溶液中,离子浓度关系正确的是( )A.c(Na+)>c(A-)>c(H+)>c(OH-) B.c(Na+)+c(H+) =c(A-)+c(OH-)C.c(Na+)+c(OH-)=c(A-)+c(H+) D.c(Na+)>c(OH-)>c(A-)>c(H+)9.下列说法正确的是( )A. 室温下,pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH)>c(OH﹣)=c(H+)B. 醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO﹣)+c(CH3COOH)<c(Na+)C. 相同物质的量浓度的NaClO和NaHCO3混合溶液中:c(HClO)+c(ClO﹣)=c(HCO)+c(H2CO3)+c(CO)D.c(NH)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)10.下列有关电解质溶液的叙述,不正确的是( )A. 稀醋酸加水稀释,醋酸电离程度增大,溶液的pH升高B. 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO﹣)C. 在氯水中通入氯化氢气体后,溶液中c(HClO)减小D. 常温下,pH=2的盐酸与pH=12的氨水等体积混合所得溶液中:c(Cl﹣)>c(NH)>c(H+)>c(OH﹣)11.取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g)N2O4(g) ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是( )A. 答案A B. 答案B C. 答案C D. 答案D12.在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)2CO(g)达到平衡,平衡时c(CO2) 随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是A. 该反应的ΔH>0、ΔS<0 B. 体系的总压强p:p(Ⅰ) >p(Ⅲ)C. 平衡常数:K(Ⅰ) >K(Ⅱ) D.T1K时,Ⅳ点所处的状态中v(正) <v(逆)13.某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示,下列说法中正确的是( )A. 30 min~40 min间该反应使用了催化剂 B. 反应方程式中的x=1,正反应为吸热反应C. 30 min时降低温度,40 min时升高温度 D. 8 min前A的平均反应速率为0.08 mol•L﹣1•min﹣114.一定条件下存在反应:H2(g)+ I2(g)2HI(g) ΔH<0,现有三个相同的体积均为1 L 的恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 mol HI(g),在Ⅲ中充入2 mol H2和2 mol I2(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )A. 容器Ⅰ、Ⅱ中正反应速率相同B. 容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数C. 容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色深D. 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于115.甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是 ( )A. 平衡时各容器内c(NO2)的大小顺序为乙>甲>丙B. 平衡时N2O4的百分含量:乙>甲=丙C. 平衡时甲中NO2与丙中N2O4的转化率不可能相同D. 平衡时混合物的平均相对分子质量:甲>乙>丙16.已知某溶液中只存在OH-、H+、Cl-、NH四种离子,其离子浓度可能有如下关系:①c(Cl-)>c(NH)>c(H+)>c(OH-) ②c(Cl-)>c(NH)>c(OH-)>c(H+)③c(NH)>c(Cl-)>c(OH-)>c(H+) ④c(NH)=c(Cl-)>c(OH-)=c(H+)下列说法正确的是( )A. 若①正确,则溶液中溶质一定为NH4ClB. 若③正确,则溶液中c(NH3·H2O)+c(NH)>c(Cl-)C. 若④正确,且盐酸和氨水体积相等,则盐酸中c(H+)等于氨水中c(OH-)D. 溶质不同时,上述四种关系式均可能成立17.实验室用铅蓄电池作电源电解饱和食盐水制取Cl2,已知铅蓄电池放电时发生如下反应:负极:Pb+SO42--2e-===PbSO4正极:PbO2+4H++SO42-+2e-===PbSO4+2H2O今欲制得Cl20.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )A. 0.025 mol B. 0.050 mol C. 0.100 mol D. 0.200 mol18.据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是 ( )A. 电池放电时Na+从b极区移向a极区B. 电极b采用MnO2,MnO2既作电极材料又有催化作用C. 每消耗1 mol H2O2,转移的电子为1 molD. 该电池的正极反应为BH4-+8OH--8e-===BO2-+6H2O19.下列有关性质的比较,正确的是( )A. 第一电离能:O>N B. 水溶性:CH3CH2OH>CH3CH2OCH2CH3C. 沸点:HCl>HF D. 晶格能:NaCl>MgO20.共价键、金属键、离子键和分子间作用力都是构成物质微粒间的不同相互作用力,下列含有上述两种相互作用力的晶体是( )A. SiC晶体 B. Ar晶体 C. NaCl晶体 D. NaOH晶体 二、填空题(每空2分,共40分) 21.(8分)草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。某草酸亚铁样品(不含结晶水)中含有少量草酸,现用滴定法测定该样品中FeC2O4的含量。实验方案如下:①将准确称量的0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol·L-1的H2SO4溶液,使样品溶解,加热至70 ℃ 左右,立即用高锰酸钾溶液滴定至终点。②向滴定终点混合液中加入适量的Zn粉和过量的2 mol·L-1的H2SO4溶液,煮沸5~8 min.用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.020 00 mol·L-1的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 mL。试回答下列问题:(1)高锰酸钾标准液用________滴定管盛装(填“酸式”或“碱式”)。(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为__________________________________________________________________________________________________________________________________________________________________________。(3)在步骤②中,下列操作会引起测定结果偏高的是________________________________。A、滴定管在盛装高锰酸钾前未润洗 B、滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出C、滴定前读数正确,滴定终点时俯视读数 D、滴定前读数正确,滴定终点时仰视读数(4)0.20 g样品中FeC2O4的质量分数为________。(不考虑步骤②中的损耗)22.(8分)常温下用惰性电极电解200 mL NaCl、CuSO4的混合溶液,所得气体的体积随时间变化如下图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)(1)曲线________(填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化。(2)NaCl的物质的量浓度为________,CuSO4的物质的量浓度为________。(3)t2时所得溶液的pH为________。23.(12分)已知在一恒容密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g) ΔH=-196.0 kJ·mol-1。SO2的平衡转化率与温度、压强的关系如下图所示:根据图示回答下列问题:(1)压强:p1________(填“>”“=”或“<”)p2。(2)升高温度,平衡向________(填“左”或“右”)移动。(3)200 ℃下,将一定量的SO2和O2充入体积为2 L的密闭容器中,经10 min后测得容器中各物质的物质的量如下表所示:①10 min内该反应的反应速率v(O2)=_________________,该反应达到化学平衡状态的标志是_________。a.SO2和O2的体积比保持不变 b.混合气体的密度保持不变c.体系的压强保持不变 d.SO2和SO3物质的量之和保持不变②当反应放出98.0 kJ热量时,测得该反应达平衡状态,该温度下SO2的转化率为__________。(4)400 ℃时,将等量的SO2和O2最初在两个容积相等的容器中反应,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的百分含量为p%,则乙容器中SO2的百分含量________。a.等于p% b.大于p% c.小于p% d.无法判断24.(12分)氮化铝(AlN)是一种重要的功能材料,如下流程图所示,以三乙基铝[(C2H5)3Al]和氨为原料,采用溶胶—凝胶法可合成AlN。请回答下列问题:(1)基态N原子的电子排布式为 ,H、C、N三种元素的电负性由大到小的顺序为 。(2)中间体分子中Al与N之间的相互作用力为 ,中间体分子中采取sp3杂化的原子有 。(3)在C2H6分子中,存在下列作用中的 (填序号)。①σ键 ②π键 ③极性键 ④非极性键(4)AlN的晶体结构与金刚石类似,若AlN的密度为ρ g·cm-3,阿伏加德罗常数为NA,则AlN晶胞的边长为 cm。 2019级高二4月调研考试化学试题参考答案1.【答案】C 【解析】A项,MnO显紫红色,故错误;B项,此溶质为酸或碱,CO和AlO在酸中不能大量共存,故错误;C项,既能在碱中大量共存,又能在酸中大量共存,正确;D项,HCO既不能在碱中大量共存,也不能在酸中大量共存,错误。2.【答案】C 【解析】电池反应为2Li+2SO2Li2S2O4,不是可逆反应,指的是充放电时(条件不一样)反应方向相反, A错误;原电池工作时,阳离子向正极移动,B错误;充电时,阴极上发生得电子的还原反应,电极反应式为Li++e﹣===Li, C正确;Li可以与水反应,故电解质应为非水材料,即电解质溶液不能换成LiBr的水溶液, D错误。3.【答案】D 【解析】A项,溶液体积不明确,故溶液中的铝离子的个数无法计算,错误;B项,HCl溶于水后,全部电离为氢离子和氯离子,故溶液中无HCl分子,错误;C项,NaBH4由1个钠离子和1个BH4构成,故1 mol 中含2NA个离子,错误;D项,甲醛和醋酸的最简式均为CH2O,故30 g混合物中含有的CH2O的物质的量为1 mol,则含有NA个碳原子,正确。4.【答案】B 【解析】①Fe2(SO4)3加热时虽发生水解,但硫酸难挥发,蒸发溶液可生成Fe2(SO4)3,正确;②Na2CO3水解生成氢氧化钠,但氢氧化钠不稳定,在空气中仍生成碳酸钠,正确;③KCl性质稳定,蒸发溶液可生成KCl,正确;④CuCl2溶液水解生成氢氧化铜和盐酸,盐酸挥发,最后生成氢氧化铜,错误;⑤NaHCO3不稳定,加热分解生成碳酸钠,错误,答案选B。5.【答案】B 【解析】设该化合物为ROH,其相对分子质量为x,实际参加反应的A的质量为10 g-1.3 g=8.7 g,则反应的化学方程式可表示为ROH+CH3COOHCH3COOR+H2O ΔMrx428.7 g 11.85 g-8.7 g=,解得:x=116,故A的相对分子质量约为116。6.【答案】A【解析】设混合烃平均组成为CxHy则:CxHy+(x+)O2xCO2+H2O(l) ΔV=|V后-V前|1 1+a2a则1+=2,解得y=4即混合气体分子中平均含有4个H原子。故选A。7.【答案】C 【解析】 分析解题的基点:混合物中碳、氢原子个数比恒定。乙酸乙酯(C4H8O2)与乙酸(C2H4O2)分子中的碳、氢原子个数比都是1∶2,碳、氢元素的质量比为6∶1,碳元素的质量分数为6×7.8%,氧元素的质量分数为1-7×7.8%= 45.4%。8.【答案】B 【解析】A项,NaA为强碱弱酸盐,A-水解导致溶液呈碱性,则c(H+)<c(OH-),A-水解、钠离子不水解,所以c(Na+)>c(A-),A-水解程度较小,则溶液中离子浓度大小顺序是c(Na+)>c(A-)>c(OH-)>c(H+),错误;B项,溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),正确;C项,溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),溶液呈碱性,钠离子不水解,所以c(Na+)+c(OH-)>c(A-)+c(H+),错误;D项,根据A知,c(OH-)<c(A-),错误;故选B。9.【答案】C 【解析】室温下,pH=11的氨水与pH=3的盐酸等体积混合溶液显碱性,A错误;醋酸与醋酸钠的pH=7的混合溶液中c(OH‑)=c(H+),电荷守恒:c(CH3COO‑)=c(Na+), B错误;浓度相等NaClO、NaHCO3混合溶液,物料守恒:c(HClO)+c(ClO-)=c(HCO)+c(H2CO3)+c(CO), C正确;NH4HSO4电离出的氢离子抑制铵根离子水解,c(NH)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中,c[(NH4)2SO4]<c(NH4HSO4)<c(NH4Cl),故D错误;答案为C。10.【答案】D 【解析】醋酸浓度越小,其电离程度越大,则稀醋酸加水稀释后醋酸电离程度增大,由于氢离子浓度减小,则溶液的pH升高, A正确;在CH3COONa溶液中加入适量CH3COOH,当溶液为中性时,c(OH﹣)=c(H+),根据电荷守恒可知:c(Na+)=c(CH3COO﹣),B正确;在氯水中通入氯化氢气体后,溶解平衡Cl2+H2O⇌HClO+HCl向着逆向移动,导致溶液中c(HClO)减小, C正确;氨水为弱碱,常温下pH=2的盐酸与pH=12的氨水等体积混合后溶液呈碱性,则c(OH﹣)>c(H+),根据电荷守恒可知c(NH)>c(Cl﹣),溶液中正确的离子浓度大小为c(NH)>c(Cl﹣)>c(OH﹣)>c(H+),D错误;故选D。11.【答案】BD 【解析】因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,故A错误B正确;若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,不可能出现NO2的百分含量不变的情况,故C错误;在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,反应是放热反应,温度升高,平衡向逆反应方向移动,故D正确。故选BD。12.【答案】D 【解析】CO2(g)+C(s)2CO(g),反应的气体化学计量数增大,则ΔS>0。根据图像可得,温度越高,c(CO2)越小,平衡正向移动,可知该反应为吸热,即ΔH>0,故A错误;Ⅰ这条曲线是通入0.1 mol CO2,Ⅱ这条曲线是通入0.2 mol CO2。状态Ⅰ和状态Ⅲ都是通入0.1 mol CO2。状态Ⅰ到状态Ⅲ,温度升高,平衡正向移动,气体的总物质的量增大,根据PV=nRT,可知压强增大,即p(Ⅲ)>p(Ⅰ),故B错误;平衡常数只与温度有关,温度越高,吸热反应的平衡常数越大,即K(Ⅱ)>K(Ⅰ),故C错误;T1K时,Ⅳ点在该温度的平衡状态下方,则到平衡状态,c(CO2)需增大,平衡要逆向移动,即v(正)
2020林州一中高二3月线上调研考试化学试题含答案: 这是一份2020林州一中高二3月线上调研考试化学试题含答案
2020林州一中高二6月月考化学试题PDF版含答案: 这是一份2020林州一中高二6月月考化学试题PDF版含答案
2021南阳一中高二上学期第二次月考化学试题PDF版含答案: 这是一份2021南阳一中高二上学期第二次月考化学试题PDF版含答案











