






2020-2021学年第二章 化学反应速率与化学平衡第一节 化学反应速率示范课课件ppt
展开1.知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响。2.知道催化剂可以改变反应历程,能从调控化学反应速率的角度分析和选择反应条件。3.能用简单碰撞理论模型说明反应条件对化学反应速率的影响,体会理论模型的构建过程,强化模型认知意识。
通过活化能和简单碰撞理论对问题进行讨论。
【思考】如何解释浓度、压强、温度及催化剂等因素对化学反应速度的影响呢?为什么许多化学反应需要满足一定的条件才能够发生?
1.基元反应与反应机理研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。
一、化学反应的碰撞理论
第一步: 2HI → H2 + 2I·
第二步: 2I· → I2
每一步反应都称为基元反应,这两个先后进行的基元反应反映了2HI=H2+I2的反应历程。反应历程又称反应机理。
例如: 2HI=H2 + I2
(课本P25)以气体的反应为例,任何气体中分子间的碰撞次数都是非常巨大的。通常情况下,当气体的浓度为1ml/L时,在每立方厘米、每秒内反应物分子的碰撞可达到1028次。如果反应物分子间的任何一次碰撞都能发生反应的话,反应只需10-5s就可以完成。任何气体的反应均可瞬间完成。但实际并非如此。这就说明并不是反应物分子的每一次碰撞都能发生反应。我们把能够发生化学反应的碰撞叫做有效碰撞。
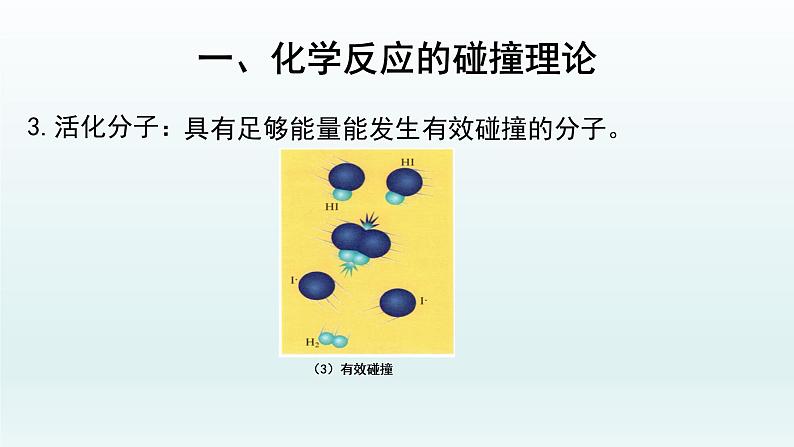
能够发生化学反应的碰撞称为有效碰撞。
(1)反应物分子必须具有一定的能量(2)碰撞时有合适的取向
具有足够能量能发生有效碰撞的分子。
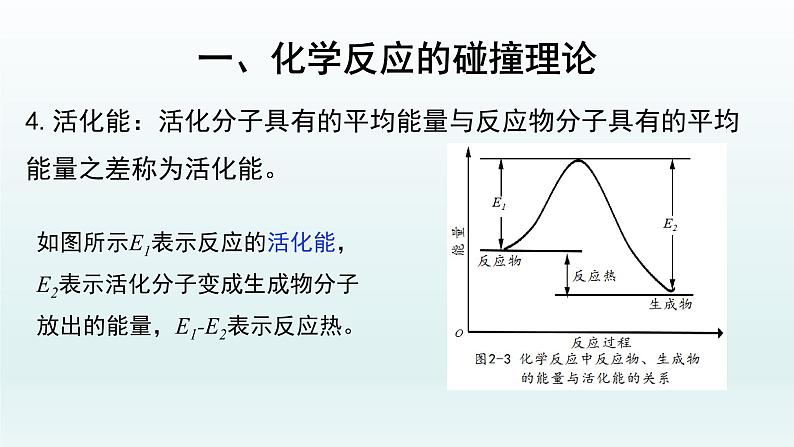
如图所示E1表示反应的活化能,E2表示活化分子变成生成物分子放出的能量,E1-E2表示反应热。
4.活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差称为活化能。
【总结】化学反应发生的条件:
化学反应速率与单位时间内分子间的有效碰撞次数有关;
有效碰撞次数越多,反应速率越快。
1.下列有关有效碰撞的说法不正确的是( )A. 能发生有效碰撞的分子一定是活化分子B. 有效碰撞是发生化学反应的充要条件C. 只要条件合适,普通分子之间的碰撞也可能是有效碰撞D. 活化分子间的碰撞不一定是有效碰撞
【解析】物质发生化学反应,是活化分子发生有效碰撞,二者缺一不可。
二、用碰撞理论解释外界条件对反应速率的影响
【思考】有效碰撞的频率越高反应速率一定就越大吗?
例如:在一定条件(1)时,1ml 某反应体系中有效碰撞的频率为10;同一反应,在另一条件(2)时,100ml 反应体系中有效碰撞的频率为100。则条件(1)的反应速率大于条件(2)。
结论:单位体积内有效碰撞频率越高,反应速率越大。
1.浓度对反应速率的影响
2.压强对反应速率的影响
【思考】增大压强是否一定会提高化学反应速率呢?请用碰撞理论解释。
【不同加压方式对反应速率影响的微观解析】
【结论】有气体参与的反应,改变压强的本质为改变浓度,速率才会改变。
3.温度对反应速率的影响
4.催化剂对反应速率的影响
2.下列说法正确的是( )A. 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大B. 有气体参加的化学反应,若压缩反应容器体积增大压强,可增加活化分子的百分数,从而使反应速率增大C. 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数D. 催化剂不影响反应活化能但能增大活化分子百分数,从而增大反应速率
【总结】影响化学反应速率的因素微观解析
已知分解1 ml H2O2放出热量98 kJ,在含少量I-的溶液中,H2O2分解的机理为:H2O2+I-= H2O+IO-(慢)、H2O2+IO-= H2O+O2+I-(快)。下列有关该反应的说法不正确的是( )A.总反应中v(H2O2)∶v(O2)=2∶1B.H2O2的分解速率与I-的浓度有关C.该反应的催化剂是I-,而不是IO-D.由于催化剂的加入降低了反应的活化能,使该反应活化能低于98 kJ·ml-1
【解析】总反应为:2H2O2=2H2O+O2↑,催化剂是I-,降低了活化能。
在含Fe3+的S2O82-和I-的混合溶液中,反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)的分解机理及反应过程中的能量变化如图:步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)步骤②:2Fe2+(aq)+S2O82-(aq)===2Fe3+(aq)+2SO42-(aq)下列有关该反应的说法正确的是( )A.反应速率与Fe3+的浓度有关B.Fe2+是该反应的催化剂C.v(S2O82-)=v(I-)=v(I2)D.若不加Fe3+,则正反应的活化能比逆反应的大
【解析】该放热反应中,Fe3+为催化剂,反应速率与Fe3+的浓度有关。
高二—人教版—化学选择性必修1—第二章
第一节 化学反应速率(第3课时)答疑
化学反应是有历程的,下列有关叙述错误的是( ) A. 所有的化学反应都由多个基元反应构成B. 化学反应不同,反应历程就不相同C. 反应物的结构和反应条件决定着一个反应的反应历程D. 由多个基元反应构成的化学反应中,其快慢取决于反应历程中的慢反应
【注意】大多数反应是由多个基元反应构成的,化学反应不同,反应历程一定不相同,反应速率主要取决于慢反应的速率。
下列说法不正确的是( )A.增大反应物浓度,活化分子百分数增大,有效碰撞次数增多B.增大压强,单位体积内气体的活化分子数增多,有效碰撞次数增多C.升高温度,活化分子百分数增加,分子运动速度加快,有效碰撞次数增多D.催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞次数增多
活化分子、有效碰撞与反应速率的关系
某反应过程的能量变化如右图所示。请填写下列空白。(1)反应过程______(填“a”或“b”)有催化剂参与。(2)该反应为_____反应(填“放热”或“吸热”)。反应热为____________。(3)使用催化剂______(填“能”或“不能”)影响该反应的反应热。
【注意】催化剂只改变活化能,不改变反应热。
高中化学人教版 (2019)选择性必修1第一节 化学反应速率多媒体教学ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 化学反应速率多媒体教学ppt课件,共26页。PPT课件主要包含了想一想,成果展示,化学反应速率,v△c△t,温馨提示,化学反应速率的测定,实验目的,实验原理,实验药品,实验步骤等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 化学平衡习题ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡习题ppt课件,文件包含高二化学人教版化学平衡第二课时-课件pptx、高二化学人教版化学平衡第三课时-课件pptx、高二化学人教版化学平衡第一课时-课件pptx、化学平衡第一课时-练习题docx、化学平衡第三课时-练习题docx、化学平衡第二课时-练习题docx等6份课件配套教学资源,其中PPT共132页, 欢迎下载使用。
高中人教版 (2019)第一节 化学反应速率多媒体教学课件ppt: 这是一份高中人教版 (2019)第一节 化学反应速率多媒体教学课件ppt,文件包含第二章化学反应速率与化学平衡_第一节化学反应速率一-课件pptx、第二章化学反应速率与化学平衡_第一节化学反应速率一-教案docx等2份课件配套教学资源,其中PPT共21页, 欢迎下载使用。













