






- 中考化学复习第8讲酸和碱精讲课件 课件 0 次下载
- 中考化学复习第8讲酸和碱精练课件 课件 0 次下载
- 中考化学复习第9讲重要的盐精练课件 课件 0 次下载
- 中考化学复习第10讲常见的金属及其氧化物精讲课件 课件 0 次下载
- 中考化学复习第10讲常见的金属及其氧化物精练课件 课件 0 次下载
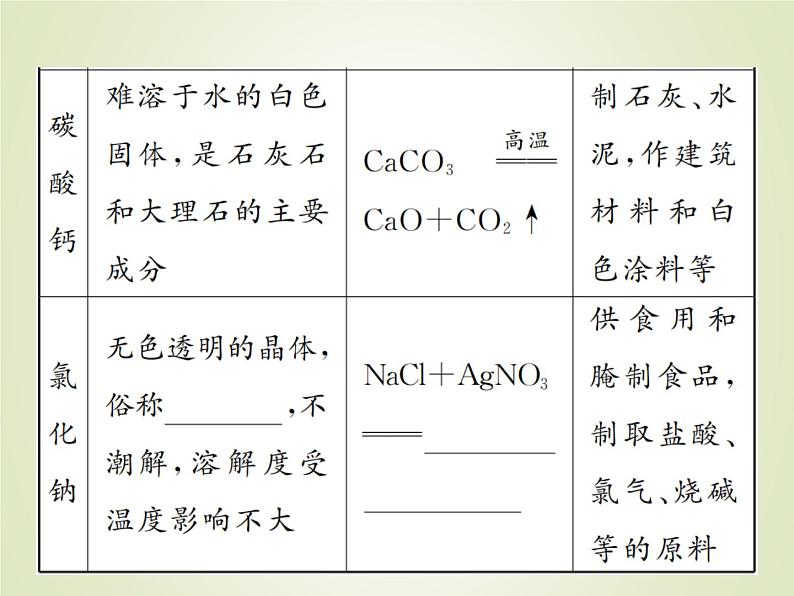
中考化学复习第9讲重要的盐精讲课件
展开2.盐的溶解性一般来说,钾盐、钠盐、铵盐、硝酸盐都________;而大多数碳酸盐都________于水;盐酸盐除________不溶,硫酸盐除________不溶,其余均可溶(注:Ag2SO4、CaSO4为微溶物)。
1.与某些金属反应2.与酸反应
3.与碱反应4.与某些盐反应
1.Cl-的检验:加入AgNO3溶液,有白色沉淀生成,再加稀硝酸,沉淀不溶解,证明样品中含Cl-。例:AgNO3+HCl===AgCl↓+HNO3。2. 的检验:加入Ba(NO3)2溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解,说明样品中含有 。例:Ba(NO3)2+H2SO4===BaSO4↓+2HNO3。3. 的检验:向试样中滴加__________,有气体产生,将气体通入澄清石灰水,变浑浊,说明样品中含有 。例:CaCO3+2HCl===CaCl2+H2O+CO2↑。
例1 实验室有一包白色固体,其中除了碳酸钠以外,还可能含有硝酸钡、硫酸钠、氢氧化钠中的一种或几种。步骤①:取少量白色固体于烧杯中,向烧杯中加入足量水并不断搅拌,固体部分溶解。步骤②:接着向烧杯中加入足量稀硝酸并不断搅拌,此时固体质量变化如图。下列说法正确的是( )
A.A→B段对应的实验现象是固体部分溶解,无气泡冒出B.B→C段对应溶液pH逐渐变大C.C点对应溶液中一定含有的溶质是硝酸、硝酸钠、硝酸钡D.原白色固体中一定含有碳酸钠、硫酸钠、硝酸钡、氢氧化钠
变式1 (2020,眉山)已知,常温下氯化钠、氯化钡的水溶液呈中性,向含有盐酸和氯化钡的混合溶液中逐滴滴入过量的X,溶液pH与滴入X的量的关系如图所示,则X可能是下列物质中的( )A.NaOH溶液B.H2OC.AgNO3溶液D.Na2CO3溶液
例2 分别把下列各组中的物质加入水中,最终可能得到无色澄清溶液的是( )A.MgCl2 NaOH H2SO4B.Ba(NO3)2 Na2SO4 HClC.KOH CuSO4 HClD.AgNO3 NaCl HNO3
变式2-1 在pH=1的无色溶液中能大量共存的离子组是( )
变式2-2 甲、乙两化工厂分布如图所示。箭头代表水流方向。如果在a处取得水样经检测只有少量OH-、 。在c处取得水样经检测pH=7,且只含有少量NaCl。则b处水中含有的物质应是下列哪一组( )A.MgSO4、NaCl B.H2SO4、Ba(NO3)2C.BaCl2、HCl D.H2SO4、MgCl2
例3 四瓶失去标签的溶液分别为:①NaOH ②CuSO4 ③MgCl2 ④Na2SO4,不用其他任何试剂而要将它们一一检验出来的正确顺序是( )A.③①②④ B.②③①④C.②①③④ D.①③②④
变式3 从HCl、CuSO4、NaOH、Na2CO3、Na2SO4、Ca(NO3)2六种溶液中,任意取出两种溶液(分别编号为a和b)混合,得到无色澄清溶液,无其他明显现象,测得混合后溶液pH=1。仅根据上述实验现象和数据,对a、b作出的推断中,不正确的是( )A.肯定有一种是HCl,另一种可能是NaOH溶液B.符合上述实验现象的a、b组合可能不止一种C.b都不可能是CuSO4溶液、Na2CO3溶液D.b都不可能是CuSO4溶液、Na2CO3溶液、NaOH溶液
例4 某固体混合物成分是由Na+、Ba2+、Cu2+、Cl-、 、 中的几种离子构成,取一定质量的该固体混合物样品,进行如下实验:①将固体样品溶于水得无色透明溶液,加入足量BaCl2溶液过滤,得到白色沉淀和无色滤液。②在①所得的白色沉淀中加入过量稀硝酸,白色沉淀部分溶解并产生气泡。③在①所得的无色滤液中滴加AgNO3溶液产生白色沉淀。
由此推断该固体中一定含有的离子是( )A.Na+、 、 B.Na+、 、 、Cl-C.Ba2+、 、 、Cl-D.Na+、Ba2+、Cu2+、 、
变式4 某一种或几种物质的水溶液中,可能含有以下几种离子:K+、Cl-、Ca2+、Ba2+、 、 。现取两份100 mL溶液进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生。(2)第二份加足量的Ba(NO3)2溶液,有白色沉淀产生,再加入过量的稀硝酸,沉淀部分溶解。根据上述实验,以下推测正确的是( )A.一定存在Cl-B.一定存在 ,可能存在Ba2+C.一定存在K+D.一定存在 ,可能存在Ca2+
例5 (2021,宿迁)海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如图。
已知:粗盐中的杂质有泥沙、MgCl2、CaCl2,流程中部分操作及试剂已省略。(1)试剂X的作用是除去粗盐中的Ca2+,则试剂X为__________(填化学式)。(2)“操作1”中玻璃棒的作用是________,“操作2”的名称为________。(3)滤渣中除泥沙外,还含有____________________。(4)实际生产中,步骤1常选用____________作为沉淀剂。(5)步骤2需电解________状态的MgCl2以获得金属镁。
变式5 鄞州区自实行“五水共治”以来,取得显著成效。某化工厂流程会产生澄清废水,其中可能含有离子Ag+、Cu2+、Cl-、 ,已知:白色的沉淀Fe(OH)2在空气中会迅速转化为红褐色的Fe(OH)3。(1)取少量废水,加入过量稀盐酸,产生白色沉淀;再加入过量氢氧化钠溶液,产生蓝色沉淀。该废水中含有的金属离子是______________。(2)兴趣小组设计了一个除去该废水中原有金属离子的实验方案,部分流程如图所示,操作Ⅰ的名称是________,单质A是______。
1.Na2CO3的水溶液呈碱性,下列说法错误的是( )A.碳酸钠在水中会电离出OH-B.往碳酸钠溶液中加稀硫酸后溶液的pH降低C.碳酸钠溶液中存在OH-D.往碳酸钠溶液中滴加紫色石蕊试液后溶液显蓝色
2.(2021,湖州)某科学兴趣小组在课余时间做了“开门大吉”的游戏,其规则是:每把钥匙代表一种试剂,每扇门代表需要鉴别的两种溶液,见如图。如果钥匙代表的试剂能够鉴别出门上代表的两种溶液,钥匙就能把门打开(每把钥匙只能使用一次),下列能够依次将四扇门打开的钥匙顺序是( )
3.(2020,台州)厨房里有两瓶白色固体,分别为食盐(NaCl)和纯碱(Na2CO3)。(1)可用于施制肉类和蔬菜,使食物不易腐败的是____________。(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。方案一:分别滴加少量食醋,有气泡产生的是______________。方案二:加水溶解,分别滴加__________________________________________溶液,有沉淀产生的是纯碱。
CaCl2(Ba2+、Ca2+的可溶性盐或
4.有一包白色固体样品,可能含氢氧化钠、硝酸钠、碳酸钠、硫酸钠、氯化钡中的一种或几种。小金同学为探究其成分完成了以下实验:①取少量白色固体溶于水,得到无色溶液,等分为两份;②往一份无色溶液中加入稀硫酸,产生沉淀质量与所加稀硫酸质量关系如图所示;③往另一份无色溶液中通入适量的CO2,产生白色沉淀。
请回答:(1)仅根据②推测原样品中一定不存在的物质是________________________。(2)原样品的所有可能组成是___________________________________________。
Na2CO3和Na2SO4
BaCl2、NaOH;BaCl2、NaOH、NaNO3
5.(2020,湖州)除去下列物质中混有的少量杂质,下列方案不可行的是( )
6.某KCl固体样品中含有少量CaCl2杂质,实验室提纯氯化钾的流程如下:(氯化钾溶解度受温度影响较小)
(1)沉淀a是______________________。(2)操作Ⅰ是______。①冷却热饱和溶液 ②蒸发结晶(3)若KCl固体样品中还含有少量杂质K2SO4,小科认为提纯该样品只要在上述方案基础上增加一步实验:在“加入过量K2CO3溶液”与“过滤”操作之间,加过量的硝酸钡溶液。小江认为这种方案不合理,会导致所得KCl固体中含有新的杂质,新杂质是__________________。
碳酸钙(或CaCO3)
7.(2021,杭州)某种粗盐水中有少量含 、K+的杂质,小金用这种粗盐水经过下列实验流程制取纯净氯化钠晶体。
(1)固体A是__________。(填化学式)(2)加碳酸钠溶液时发生反应的化学方程式:________________________________________。(3)若将溶液C蒸发至出现大量固体时停止加热,利用余热将溶液蒸干得到晶体,所得晶体仍不是纯净的氯化钠,理由是________________。
BaCl2+Na2CO3===BaCO3↓+2NaCl
8.(2020,杭州)小金完成了图示实验①②③,下列判断正确的是( )
A.实验①中石灰水有剩余B.实验②中有气泡产生C.实验③中没有明显现象D.实验③所得溶液中一定含CaCl2和NaCl
9.下列实验中,实验原理和主要操作方法都符合实验目的的是( )
10.(2021,台州)钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙,现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。
提示:①食醋的主要成分是醋酸(HAc)。醋酸和碳酸钙反应的化学方程式为CaCO3+2HAc===CaAc2+H2O+CO2↑。②鱼骨中其他成分与食醋反应生成的气体可忽略不计。(1)该实验中浓硫酸的作用是___________________________________________________。(2)由图乙中的AB曲线,可知锥形瓶中反应速率的变化情况是__________(选填“变大”“变小”或“不变)。
吸收二氧化碳携带的水蒸气,防
(3)根据图中的数据计算鱼骨中碳酸钙的质量分数。
(4)生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明________________________________________________。
11.(2020,温州)工业纯碱中含少量氯化钠。兴趣小组分别采用不同的方法测定工业纯碱样品中碳酸钠的质量分数。(1)方法一:差量法。称取W克样品与足量的稀盐酸充分反应,生成的二氧化碳通过装有试剂X的乙装置,并利用测量乙装置增加的质量,求得样品中碳酸钠的质量分数。该方法中试剂X可选用__________________。
(2)方法二:沉淀法。称取15克样品完全溶解于水中配成60克样品溶液,取三个烧杯分三次进行实验,每次加入30克氯化钙溶液充分反应,过滤、洗涤、干燥所得的沉淀质量记录如表。计算样品中碳酸钠的质量分数。(Na2CO3+CaCl2===CaCO3↓+2NaCl)
(3)请写出提高方法一测量精确度的操作建议______________________________________________________________________________________________________(写出2条)。
以减慢通气速度;反应结束后向装置内通氮气;在甲、乙两装
置之间加吸收水蒸气的装置
12.碳酸氢钠片是一种常用药,能用于治疗胃酸过多,这是因为人体的胃液中含有盐酸,已知:NaHCO3+HCl===NaCl+H2O+CO2↑,为测定药片中碳酸氢钠的含量,小科进行了如下实验:(1)小科认为,要测定药片中碳酸氢钠的含量,实验中需要采集两个数据:一是测出碳酸氢钠片样品的质量;二是根据碳酸氢钠与盐酸的反应原理,通过实验测出反应生成的____________质量。
(2)小科按如图甲的实验方案,取药片和足量的稀盐酸进行实验,通过测量反应前后总质量的变化来采集实验数据,同学们认为,测得碳酸氢钠的质量分数会偏大,原因是_________________________________________________________(答出一点即可)。
部分水蒸气(或有部分液体溅出烧杯)
(3)为减小实验误差,小科又设计了如图乙的实验方案,取药片和足量的稀盐酸进行了三次实验,采集的实验数据如表:请计算药片中碳酸氢钠的质量分数。
中考化学一轮复习基本过关练习课件第9讲 常见酸、碱、盐(含解析): 这是一份中考化学一轮复习基本过关练习课件第9讲 常见酸、碱、盐(含解析),共23页。PPT课件主要包含了热点考点,重要考点,一般考点,不变色,中和反应,浓硫酸,苛性钠,熟石灰,消石灰,考点1酸碱性与pH等内容,欢迎下载使用。
中考化学复习第16讲盐和化肥课件: 这是一份中考化学复习第16讲盐和化肥课件,共41页。PPT课件主要包含了盐的化学性质,知识梳理答案,故选D,故选C,KNO3,解反应,硫酸铵,氯化钡,碳酸钠,硫酸钠等内容,欢迎下载使用。
中考总复习化学第7讲 盐 化学肥料课件: 这是一份中考总复习化学第7讲 盐 化学肥料课件,共37页。PPT课件主要包含了复习指导航标,关键能力提升,必备知识精讲,核心素养创新,·2·,·3·,·4·,·5·,知识点1常见的盐,·6·等内容,欢迎下载使用。












