



- 中考化学复习第10讲常见的金属及其氧化物精讲课件 课件 0 次下载
- 中考化学复习第10讲常见的金属及其氧化物精练课件 课件 0 次下载
- 中考化学复习第11讲常见的化学反应精讲课件 课件 0 次下载
- 中考化学复习第11讲常见的化学反应精练课件 课件 0 次下载
- 中考化学复习第12讲物质的转化精练课件 课件 0 次下载
中考化学复习第12讲物质的转化精讲课件
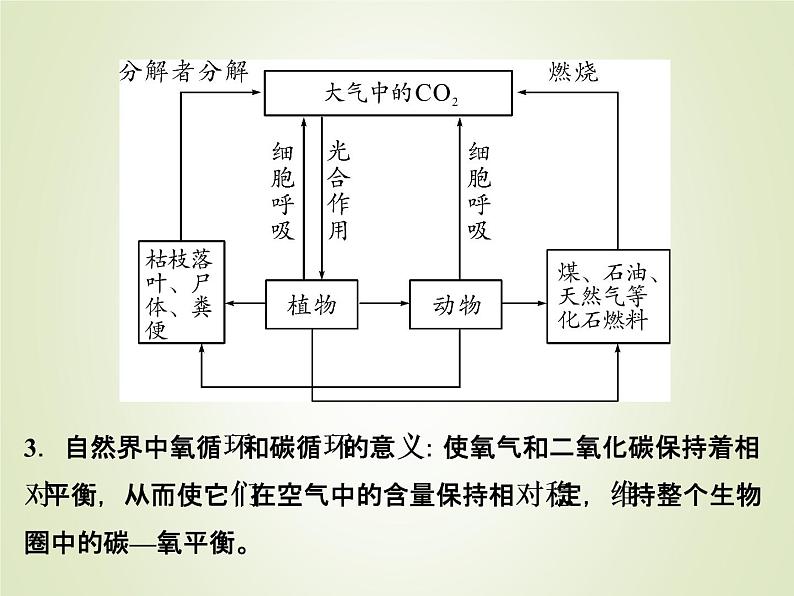
展开1.自然界中的氧循环大气中的氧气来源于植物的________作用。大气中的氧气消耗的主要途径是动植物的________作用、微生物分解动植物遗体、燃料的________、其他________反应(如铁生锈、食物的腐败)等。2.自然界中的碳循环大气中的二氧化碳通过植物的____________转变为____________,固定的碳以有机物的形式供给动、植物利用,同时呼吸作用、微生物的分解、燃料燃烧等方式释放二氧化碳返回大气,周而复始地进行循环。
3.自然界中氧循环和碳循环的意义:使氧气和二氧化碳保持着相对平衡,从而使它们在空气中的含量保持相对稳定,维持整个生物圈中的碳—氧平衡。
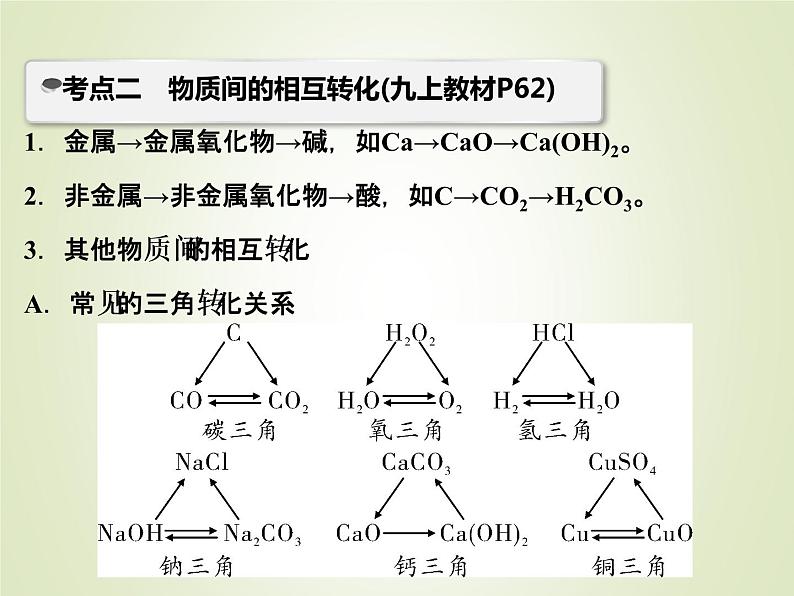
1.金属→金属氧化物→碱,如Ca→CaO→Ca(OH)2。2.非金属→非金属氧化物→酸,如C→CO2→H2CO3。3.其他物质间的相互转化A.常见的三角转化关系
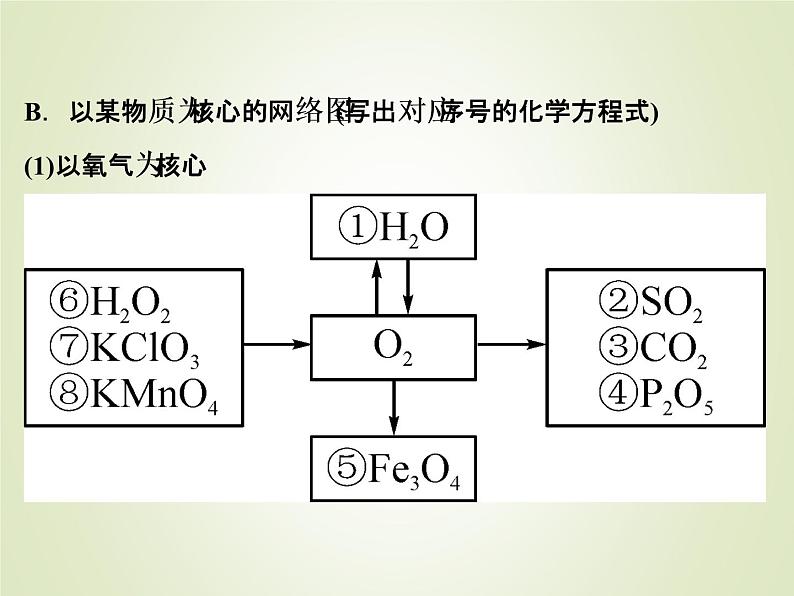
B.以某物质为核心的网络图(写出对应序号的化学方程式)(1)以氧气为核心
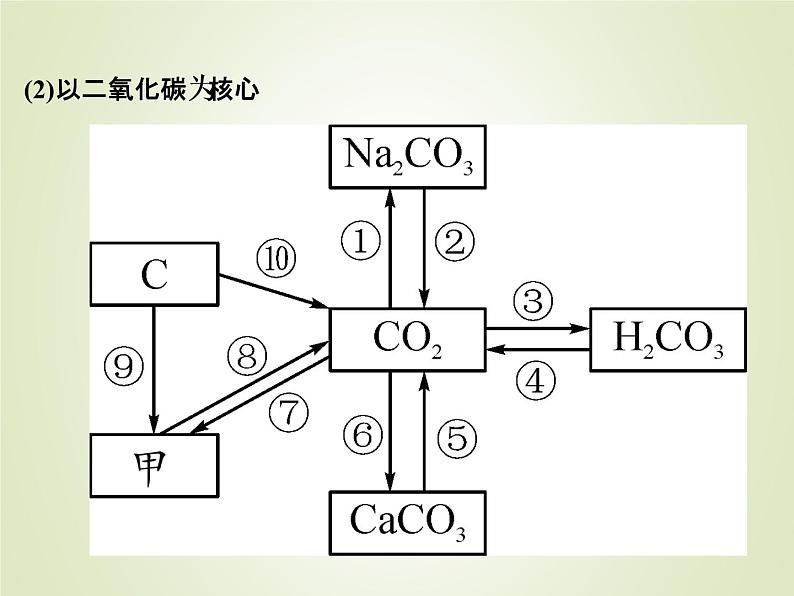
(2)以二氧化碳为核心
(3)以盐酸和硫酸为核心(化学方程式任选一个)
(4)以氢氧化钠和氢氧化钙为核心
例1 如图表示了初中科学中一些常见物质的相互转化关系(部分反应条件已省略)。下列说法错误的是( )
A.圈Ⅰ中发生的反应都是分解反应B.利用反应①可制得纯碱C.利用反应②可用来检验二氧化碳气体D.圈Ⅱ中的化学反应说明氧气具有助燃性
变式1-1 以下四种物质之间有如图所示的转化关系,其中的“→”表示某种物质可一步反应生成另一种物质(部分反应物和反应条件略去),下列各组物质按照甲、乙、丙、丁顺序,符合要求的一组是( )A.C、CO2、CO、FeB.Fe、FeSO4、Fe2O3、FeCl2C.NaOH、Ca(OH)2、Na2CO3、CO2D.CuO、CuSO4、Cu、CuCl2
变式1-2 下列物质间的转化,只需通过一步反应就能实现的是( )A.BaCO3→Ba(OH)2 B.Na2SO4→NaClC.Fe→Fe2(SO4)3 D.CuO→Cu(OH)2
例2 (2021,广州)我国将力争2060年前实现碳中和。CO2的捕捉是减少碳排放的措施之一。(1)一种利用NaOH溶液捕捉回收CO2的过程如图所示。
①捕捉室中NaOH溶液常喷成雾状,优点是________________________________________________。②“反应分离”环节发生的复分解反应是___________________________________________(写化学方程式)。③“反应分离”环节分离物质采用的方法是________。④CO2用途广泛,写出一种用途:____________________。
积,使反应更快、更充分
Na2CO3+Ca(OH)2
===CaCO3↓+2NaOH
(2)CaO固体也可以捕捉回收CO2。研究表明CaC2O4·H2O热分解制得的CaO疏松多孔,具有良好的CO2捕捉性能。取1.46 g CaC2O4·H2O进行加热,固体质量随温度变化如图。
①写出400~600 ℃范围内分解反应的化学方程式:______________________________________(CaC2O4·H2O的相对分子质量:146)。②据图分析,CaO捕捉CO2的反应温度应________(选填“高于”或“低于”)800 ℃。
CaC2O4 CaCO3+CO↑
变式2 侯氏制碱法所得的纯碱中常含有少量氯化钠,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等固定装置已略去)。
实验步骤如下:①按图连接装置,并检查气密性;②准确称得盛有碱石灰(固体氢氧化钠和氧化钙的混合物)的干燥管D的质量为83.4 g;③准确称得6.0g纯碱样品放入装置B的广口瓶中;④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6 g。
试回答:(1)鼓入空气的目的是__________________________________,装置A中试剂X最适宜选用______________。(2)若没有C装置,则会导致测定结果________(填“偏大”或“偏小”)。(3)E装置的作用是____________________________________。
使B中产生的二氧化碳全部进入D中
防止空气中CO2和水蒸气进入D中
(4)请根据实验中测得的有关数据,计算纯碱样品中碳酸钠的质量分数。(要求:写出计算过程,结果保留1位小数)
1.(2020,嘉兴)学习了物质分类与转化规律后,某同学绘制了部分物质间相互反应的关系图。图中阴影部分表示相邻两类物质的反应,其中不能用于制取ZnCl2的是( )A.① B.② C.③ D.④
2.如图,给出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规律,判断下列选项正确的是( )A.不能一步实现转化的有①②B.实现③转化,可通至氯化钠溶液C.实现⑤转化,可加入碳酸钙粉末D.实现⑥转化,可加入氢氧化钾溶液
3.(2021,杭州)二氧化碳的资源化利用是实现碳减排的重要途径。如图是一种实现二氧化碳转化为重要原料二甲醚(化学式为C2H6O)的途径:(1)转化①是二氧化碳与一种常见单质反应生成甲醇和水,这种单质的化学式为______。(2)转化②是甲醇发生分解反应生成二甲醚和水,反应中生成二甲醚和水的分子数之比为________。
4.(2020,杭州)一种制备氢氧化镁的生产流程如图所示,MgCl2和NaOH按恰好完全反应的比例加料。
(1)写出步骤c中发生反应的化学方程式:_______________________________________。(2)x=_______。(3)过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是______________________。(4)如图流程中若用下列物质代替氢氧化钠,也能制得氢氧化镁的是_______。①盐酸 ②氯化钙 ③氨水 ④硫酸镁
MgCl2+2NaOH===Mg(OH)2↓+2NaCl
5.(2020,衢州)如图所示,是小科建构的铜及其化合物之间相互转化的关系图。
(1)写出图中“?”处物质的化学式________。(2)要一步实现图中“Cu→Cu2+”的转化,可将铜加入适量的某种盐溶液中,则该溶液的溶质是___________________________________________________。(3)根据图中的转化关系,利用硝酸铜溶液制备纯净的硫酸铜晶体。请设计一个实验方案,要求写出主要操作步骤及所需要的试剂________________________________________________________________________________________________________。
硝酸银(AgNO3)[或硝酸汞
Hg(NO3)2,合理即可]
向沉淀中加入适量稀硫酸,充分反应后蒸发结晶(合理即可)
在硝酸铜溶液中加入氢氧化钠溶液,过滤、洗涤沉淀,
6.(2021,温州)工业上常用碳酸镁矿石(主要成分是难溶于水的碳酸镁,杂质不溶于水也不与酸反应)与稀硫酸反应来制备硫酸镁。硫酸镁在不同温度时的溶解度如表所示。制备流程如图。
(1)用150千克溶质质量分数为98%的浓硫酸配制9.8%的稀硫酸,需要水________千克。(2)小明模拟工业制备硫酸镁晶体,将碳酸镁矿石和稀硫酸充分反应后过滤,发现滤液中含有硫酸。为了测定所得滤液中硫酸镁和硫酸的质量比,他取少量滤液倒入烧杯,将溶质质量分数为10%的氢氧化钠溶液逐渐加入。除要知道实验前氢氧化钠溶液质量外,实验中还要通过测量获取哪两个数据,才可计算硫酸镁与硫酸的质量比?________________________________________________________________________________________。[硫酸镁与氢氧化钠反应的化学方程式:MgSO4+2NaOH===Mg(OH)2↓+Na2SO4]
刚出现沉淀时剩余氢氧化钠溶液的质
量、不再出现沉淀时剩余氢氧化钠溶液的知识(合理即可)
(3)小明将除去杂质后的滤液加热至90 ℃,得到硫酸镁浓溶液,继续加热,观察到晶体快速析出。其原因可能是__________________________________________________________。
温度升高,硫酸镁溶解度减小,且溶剂快速蒸发
7.(2021,绍兴)2021年3月,中央财经会议明确把碳达峰、碳中和纳入生态文明建设整体布局,争取在2060年前实现碳中和。“碳中和”是指在一定时间内产生的二氧化碳排放总量,通过二氧化碳去除手段来抵消掉这部分碳排放,达到“净零排放”的目的。(1)二氧化碳是引起温室效应的主要气体,根据图甲回答支持这一结论的信息是:_______________________________________________________。
全球平均气温随二氧化碳浓度增加而升高
(2)科学家已经研究出多种方式来实现二氧化碳的转化。①固碳的另一种方法是将收集的二氧化碳和水混合后注入地下玄武岩中,最终与岩石中的矿物质作用形成固态的石头碳酸盐。这种固碳方式属于________(选填“物理”或“化学”)变化。②我国研发的“液态太阳燃料合成技术”(图乙),甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。甲醇制取过程中能量转化是:太阳能→电能→________能。甲醇合成时,若碳元素全部来自于二氧化碳,则制取10吨甲醇需要消耗二氧化碳_________吨。(二氧化碳转化成甲醇的方程式为CO2+3H2 CH3OH+H2O)
8.(2021,湖州)20世纪30年代,美国科学家鲁宾和卡门利用18O分别标记H2O和CO2,将C18O2和CO2分别通入含小球藻的H2O和 中(如图所示),迅速收集产生的氧气。
(1)18O和16O互为__________原子, 和H2O以及CO2和C18O2具有相同的化学性质,因此可以用来示踪物质变化情况。(2)该实验是为了研究___________________________________________________________。(3)该实验必须在________条件下进行。(4)制备含有较多小球藻的液体时,需在盛有小球藻的液体中加入__________(选填“无机盐”或“无机盐和有机物”),并置于适宜环境下培养。
光合作用释放的氧气中的氧元素来自水
9.(2021,温州)“化学氧自救呼吸器”是一种在缺氧环境中通过制氧剂临时供氧的装置。制氧剂的主要成分是超氧化钾(KO2),产生氧气的主要原理是超氧化钾与人体呼出的水汽反应,其化学方程式为4KO2+2H2O===4KOH+3O2↑。制氧剂中其他成分不能生成氧气。(1)小明设计化学氧自救呼吸器时,为确定制氧剂的用量,除了查阅人体每分钟呼吸次数外,还需了解哪些与人体呼吸相关的数据?________________________________________________________(列举一个)
人体呼出气体中水蒸气含量(或每次呼吸消耗氧气的质量)
(2)若该呼吸器需为使用者提供48克氧气,则至少需要含超氧化钾80%的制氧剂多少克?
中考化学复习第12讲物质的转化精练课件: 这是一份中考化学复习第12讲物质的转化精练课件,共11页。PPT课件主要包含了二氧化碳,稀盐酸,和碳酸钙溶液等内容,欢迎下载使用。
中考化学复习第11讲常见的化学反应精讲课件: 这是一份中考化学复习第11讲常见的化学反应精讲课件,共48页。PPT课件主要包含了考点扫描,物质的变化,物质的性质和用途,化学变,得到氧,失去氧,还原性,氧化性,提供氧,氧化剂等内容,欢迎下载使用。
中考化学复习第9讲重要的盐精讲课件: 这是一份中考化学复习第9讲重要的盐精讲课件,共51页。PPT课件主要包含了考点扫描,几种重要的盐,AgCl,BaSO4,稀盐酸,重点突破,Na2CO3,氢氧化镁,氢氧化钙,Cu2+等内容,欢迎下载使用。












