

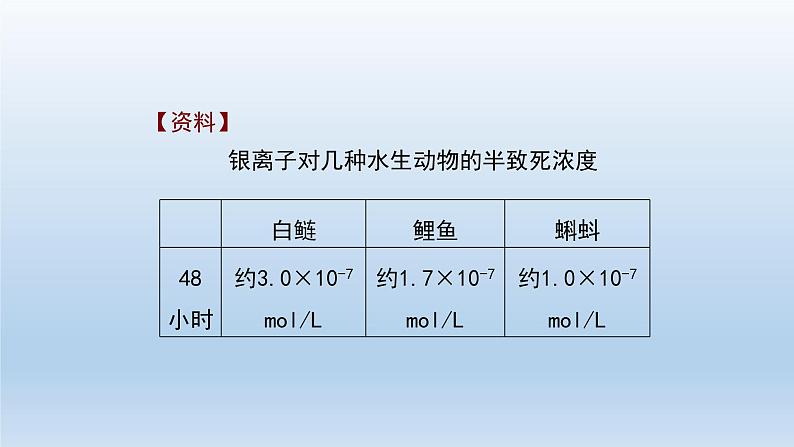

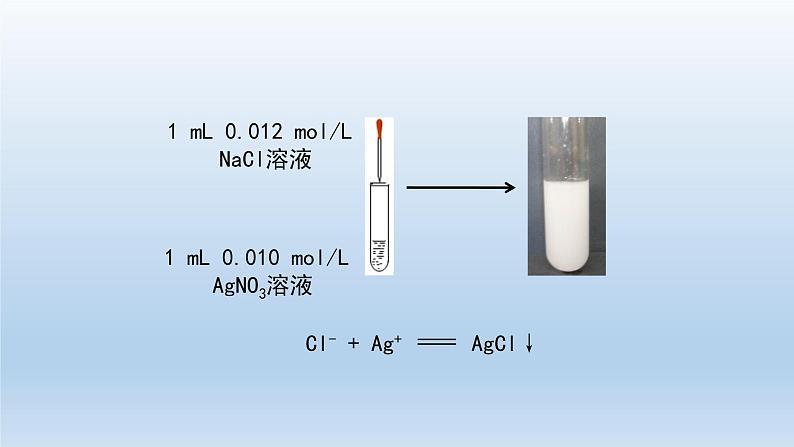
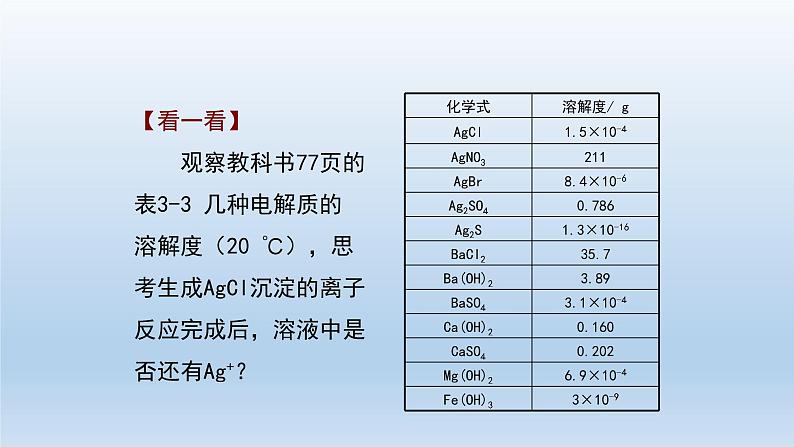
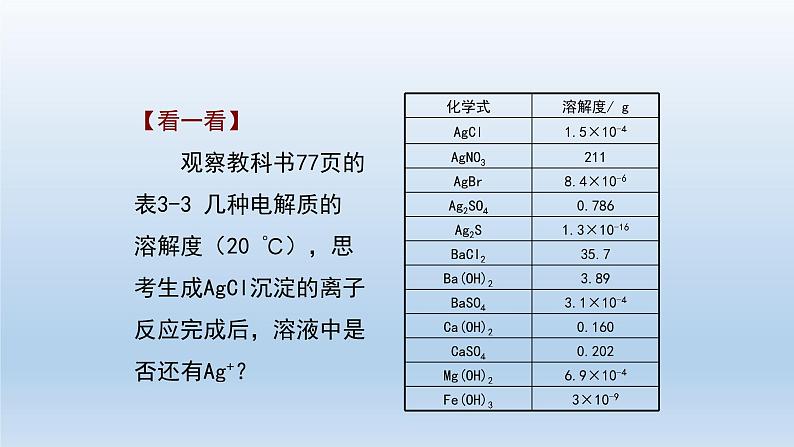
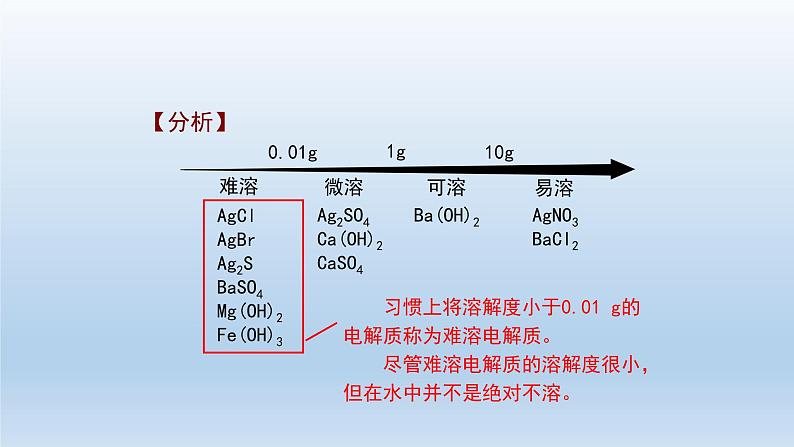





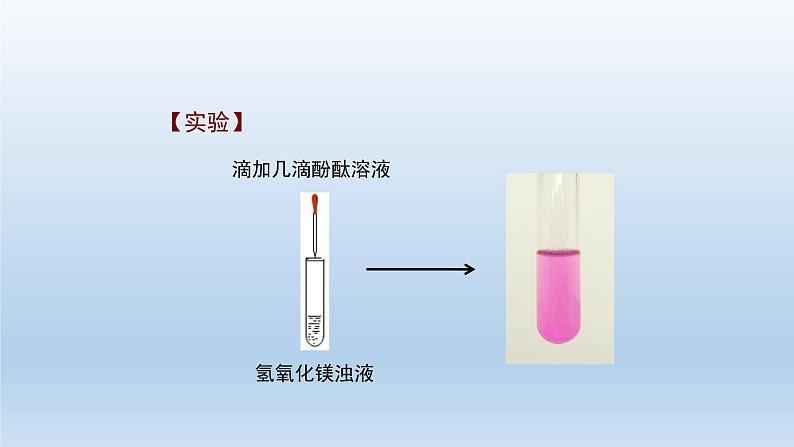



高中化学第四节 沉淀溶解平衡习题ppt课件
展开练习题
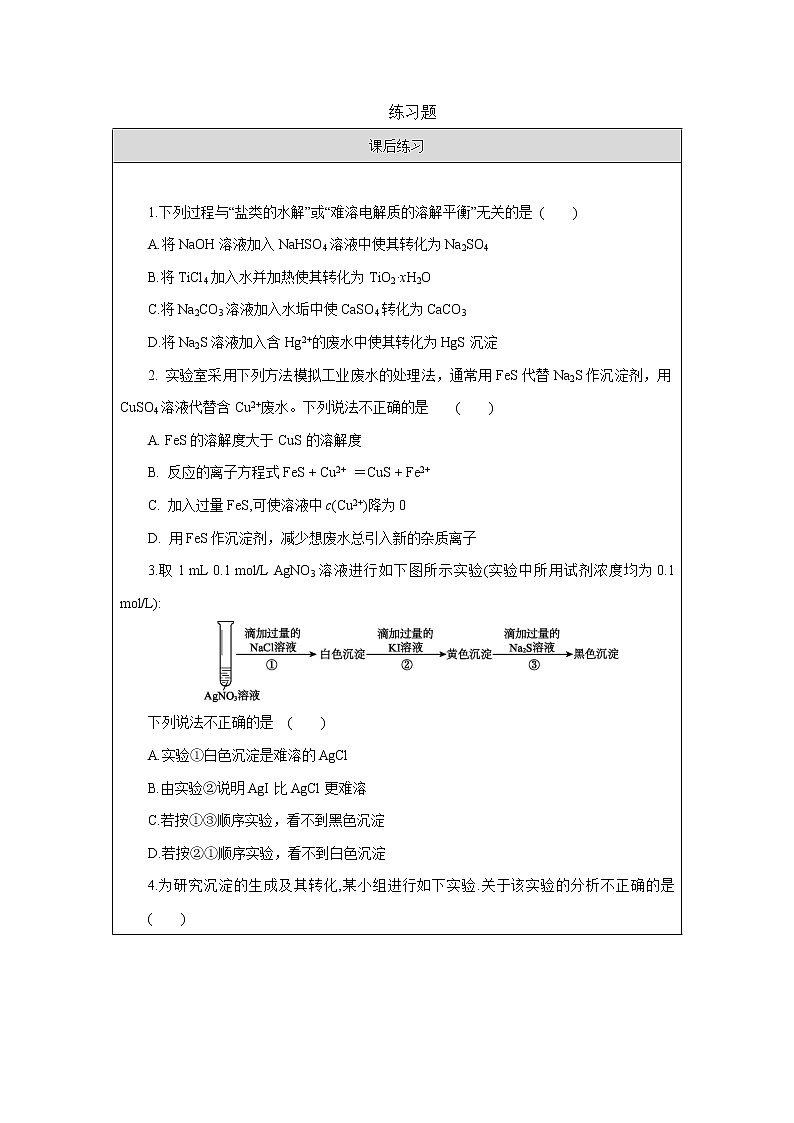
课后练习 |
1.下列说法正确的是( ) A.沉淀就是在水溶液中不溶解的物质 B.难溶电解质都能溶解于稀盐酸溶液中 C.等体积等物质的量浓度的AgNO3溶液与NaCl溶液充分反应后,溶液中剩余Ag+浓度为零 D.等体积等物质的量浓度的AgNO3溶液与NaCl溶液充分反应后,溶液中 Q (AgCl)=Ksp(AgCl) 2.难溶电解质在水中达到沉淀溶解平衡时,下列说法中错误的是( ) A.沉淀的速率和溶解的速率相等 B.难溶电解质在水中形成饱和溶液 C.再加入难溶电解质,溶液中各离子的浓度不变 D.难溶电解质溶解形成的阴、阳离子的浓度相等 3.室温下,向AgCl饱和溶液中加水,下列叙述正确的是 ( ) A. AgCl的溶解度、Ksp均不变 B. AgCl溶解度、Ksp均变大 C. 沉淀过程停止,溶解过程加快 D. 沉淀速率将小于溶解速率,直至再达到平衡 4.在一定温度下,氢氧化镁存在沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq) + 2OH-(aq) , 则氢氧化镁在下列物质中的溶解度最大的是( ) A.0.1mol/LMgCl2溶液 B.0.1mol/LKOH溶液 C.0.1mol/LKCl溶液 D.0.1mol/L(NH4)2SO4溶液 5.室温下,在Ca(NO3)2溶液中加入(NH4)2CO3溶液后,过滤,若测得滤液中c(C)=10-3mol/L,则Ca2+是否沉淀完全: (填“是”或“否”)。 [已知c(Ca2+)≤10-5mol/L时可视为沉淀完全,室温下Ksp(CaCO3)=4.96×10-9] 6.(1)某温度下,向50 mL 0.018 mol/L的AgNO3溶液中加入50 mL 0.020 mol/L的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,则完全沉淀后,溶液中剩余的c(Ag+)= mol/L。 (2)已知:Ksp=c(Cu2+)·c2(OH-)=2×10-20。 ①某温度下,,CuSO4溶液中c(Cu2+)=0.02 mol/L,如果生成Cu(OH)2沉淀,应调整溶液的pH,使之大于 。 ②要使0.2 mol/L CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为 。 |
高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡课前预习ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡课前预习ppt课件,共46页。
高中人教版 (2019)第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡公开课课件ppt: 这是一份高中人教版 (2019)第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡公开课课件ppt,共12页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡课堂教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡课堂教学课件ppt,文件包含341pptx、342pptx等2份课件配套教学资源,其中PPT共47页, 欢迎下载使用。













