

2021-2022学年湖南省长沙市南雅中学高一(上)期中考试化学试卷(含答案解析)
展开
这是一份2021-2022学年湖南省长沙市南雅中学高一(上)期中考试化学试卷(含答案解析),共16页。试卷主要包含了1ml/,【答案】A,【答案】D,【答案】C,【答案】B等内容,欢迎下载使用。
2021-2022学年湖南省长沙市南雅中学高一(上)期中考试化学试卷 下列说法中正确的是( )A. 常温下不需要加热就能进行的反应一定是放热反应
B. “神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高
C. 锌锰干电池中,锌外壳是正极,石墨棒是负极材料
D. 常见的充电电池有锂离子电池、铅酸蓄电池、锌锰干电池等 下列不属于有机高分子材料的是( )A. 富勒烯 B. 硅橡胶 C. 有机玻璃 D. 合成纤维 如图是某化学课外活动小组设计的用化学电源使LED灯发光的装置。下列有关该装置的说法正确的是( )A. 铜为负极,其附近的溶液变蓝,溶液中有产生
B. 如果将稀硫酸换成柠檬汁,LED灯将不会发光
C. 如果将锌片换成铁片,电路中的电流方向将发生改变
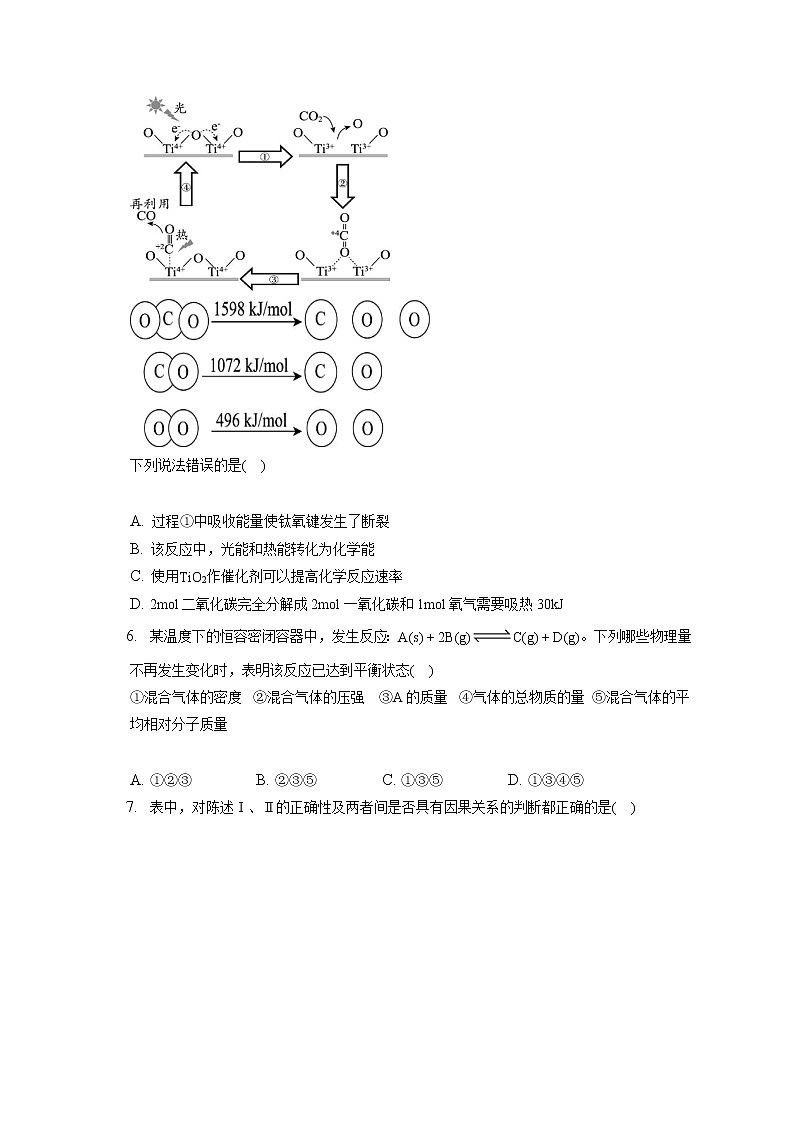
D. 其能量转化的形式主要是化学能电能光能 碳原子的不同结合方式使得有机物种类繁多,下列碳原子的结合方式中错误的是( )A. B. C. D. 以为催化剂的光热化学循环分解反应,为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。 下列说法错误的是( ) A. 过程①中吸收能量使钛氧键发生了断裂
B. 该反应中,光能和热能转化为化学能
C. 使用作催化剂可以提高化学反应速率
D. 2mol二氧化碳完全分解成2mol一氧化碳和1mol氧气需要吸热30kJ 某温度下的恒容密闭容器中,发生反应:。下列哪些物理量不再发生变化时,表明该反应已达到平衡状态( )①混合气体的密度 ②混合气体的压强 ③A的质量 ④气体的总物质的量 ⑤混合气体的平均相对分子质量 A. ①②③ B. ②③⑤ C. ①③⑤ D. ①③④⑤ 表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )选项陈述Ⅰ陈述Ⅱ判断A硅是良好的半导体材料硅可能成为未来的能源新秀Ⅰ对,Ⅱ对;有BCu能与浓反应由于Cu具有还原性,浓具有氧化性,在任何条件下生成的气体一定是Ⅰ对,Ⅱ对;有C硫单质在纯氧中燃烧有少量生成部分二氧化硫被氧化为Ⅰ对,Ⅱ对;无D可用氢氧化钠溶液来检验铵根铵盐与强碱加热下能发生复分解反应生成氨气Ⅰ对,Ⅱ对;有 A. A B. B C. C D. D 将等质量且过量的两份锌粉a、b中分别加入相同体积、相同物质的量浓度的稀硫酸,同时向a中加入少量硫酸铜溶液,下列各图产生的体积与时间的关系中正确的是( )A. B.
C. D. 在恒容密闭容器中发生反应:,下列说法正确的是( )A. 增加的量反应速率加快 B. 升高温度反应速率不一定变化
C. 充入使压强增大反应速率加快 D. 充入CO反应速率加快当三份Cu粉分别与过量的稀硝酸、浓硝酸、热的浓硫酸反应后,收集到的气体在相同状况下体积相等时,三份Cu粉的质量比为不考虑转化为和反应生成气体的溶解( )A. B.
C. D. 化学与生活密切相关,下列物质用途叙述不正确的是( )A. 是制造普通玻璃的原料之一
B. SiC可用作耐高温结构材料、耐高温半导体材料
C. 可用于杀菌消毒,还是一种食品添加剂
D. 晶体Si用于生产光导纤维如图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨气和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是( )A. 在实验室中,不能直接分解氯化铵制备氨气
B. 在实验室中制备干燥的氨气和氯化氢时,均可选用无水氯化钙作干燥剂
C. 实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉
D. 喷泉结束后,将烧瓶内溶液混合后呈紫色,蒸干可得氯化铵固体某化学小组为了探究铝电极在原电池中的作用,进行了下列实验,实验结果记录如表。下列说法正确的是( )编号电极材料电解质溶液电流表指针偏转方向①Mg、Al稀盐酸偏向Al②Al、Cu稀盐酸偏向Cu③Al、石墨稀盐酸偏向____④Mg、AlNaOH溶液偏向Mg A. 实验①和②中,Al电极的作用不相同
B. 实验③中,电流表指针偏向Al
C. 实验④中,Mg为负极,电极反应式为:
D. 综合以上实验,铝在原电池中的作用,与另一个电极材料和电解质溶液有关下列说法中正确的是( )A. 相对分子质量相同、结构不同的两种化合物互为同分异构体
B. 有4种同分异构体
C. 分子中所有原子一定不共面
D. 同分异构体之间的转化是物理变化某温度时,在2L容器中发生A 、B两种物质之间的转化反应,A、B物质的量随时间变化的曲线如图所示,下列说法正确的是( )A. 该反应的化学方程式是A2B
B. 时,正反应速率大于逆反应速率
C. 时,A、B的物质的量相等且反应达到了平衡状态
D. 反应开始至,A的平均反应速率为I.有下列各组微粒或物质,请按要求填空填字母:A.和
B.和
C.和
和
E.和____组两种物质互为同素异形体。____组中两种物质属于同系物。____组中两种物质互为同分异构体。现有A、B、C三种烃,其球棍模型如图:等质量的以上物质完全燃烧时耗去的量最多的是________。填字母将1mol A和适量的混合后光照,充分反应后生成的、、、四种有机产物的物质的量依次增大,则参加反应的的物质的量为__________mol。将B通入溴的四氯化碳溶液中可使溴的四氯化碳溶液褪色,请写出该反应的化学方程式:__________________________________。用C设计成碱性条件下的燃料电池,写出正极的电极反应:______________。 硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。从图1中选择符合图2要求的X、Y代表的物质:X____、Y____。硫酸是重要的化工原料,小组同学对硫酸的工业制备和性质进行探究。查阅资料,工业制硫酸的过程如图:①上述工业制硫酸过程中,没有发生氧化还原反应的过程是____填“Ⅰ”“Ⅱ”或“Ⅲ”。②过程Ⅱ中,小组同学在和101kPa条件下,将一定量的和充入含有催化剂的密闭容器中发生反应,随着反应的进行,用气体传感器测量各组分的浓度见表。反应时间010203040506070100107535211115a1b03589999根据数据分析,表中a、b代表的数值分别是:____、____;小组同学判断和的反应50秒后处于平衡状态,他们的判断依据是_______。 某化学小组按如图所示实验流程比较浓硝酸和稀硝酸的氧化性强,其中B为一种紫红色金属,C为红棕色气体。请回答下列问题:与B反应的离子方程式是__________________。实验时在装置Ⅰ中加入B后,在加入A之前需向整套装置中通入足量的气体,该操作的目的是:_____________________________。装置Ⅱ中发生反应的化学方程式是_____________________。装置Ⅲ中的实验现象为:__________,由此得出结论:浓硝酸的氧化性比稀硝酸______填“强”或“弱”。装置是尾气处理装置,产物为水和一种盐,请写出化学方程式________。 和在工业上用途广泛,某同学为探究、的性质,设计如图装置进行实验。中发生反应的化学方程式为_________________________________。若C中加入淀粉碘化钾溶液,关闭,打开,使A产生的气体进入C,则C中实验现象为__________________________。若要实现硫元素由价转化为0价,需关闭,打开,在C中加入_____溶液,此过程体现了的____________性。若C中加入品红溶液,打开、,使A、E产生的气体同时进入C中,观察到C中品红溶液没有褪色,原因可能为_____________________用离子方程式表示。假设反应产生的有标准状况下全部进入C中与刚好完全反应,则制备所需的质量至少为_________浓盐酸足量,且产生的全部进入C中参与反应。
答案和解析 1.【答案】B 【解析】A.反应中能量变化与反应条件无关,则需要加热的反应可能为吸热或放热反应,不需要加热的反应可能为吸热或放热反应,如铝热反应在高温下进行,但为放热反应,氢氧化钡晶体与氯化铵在常温下就可进行,但为吸热反应,A错误;B.飞船返回舱表层采用的新型无机非金属材料,具有耐高温、抗氧化的特点,为保证内部温度的相对稳定,高温时能自动烧蚀,以带走热量,B正确;C.锌锰干电池中,锌外壳作负极,石墨棒作正极,C错误;D.锌锰干电池是一次电池,只能放电,不能充电,D错误;故选:B。
2.【答案】A 【解析】A.富勒烯是由多个碳原子形成的单质,不属于有机高分子材料,故A选;B.硅橡胶为人工合成的有机高聚物,属于有机高分子化合物,故B不选;C.有机玻璃属于合成有机高分子材料,故C不选;D.合成纤维是以小分子的有机化合物为原料,经加聚反应或缩聚反应合成的有机高分子化合物,故D不选;故选:A。
3.【答案】D 【解析】锌比铜活泼,稀硫酸作电解质溶液时,形成原电池:锌为负极,发生氧化反应;铜为正极,发生还原反应生成氢气;外电路中电流方向为灯,以此解答该题。
A.稀硫酸原电池中,Zn为负极,Cu片为正极,铜片上,故A错误;B.柠檬汁呈弱酸性,如果将稀硫酸换成柠檬汁,则与仍然形成原电池,LED灯将微弱发光,故B错误;C.稀硫酸原电池中,电流方向由Cu片流向Zn片,如果将锌片换成铁片,则Fe作负极,Cu仍为正极,电流方向由Cu片流向Fe片,即电流方向不变,故C错误;D.原电池的能量变化为化学能电能,LED灯工作时能量变化为电能光能,所以电路中能量转化的形式主要是“化学能电能光能”,故D正确;故答案选D。
4.【答案】C 【解析】在有机物的分子结构中,1个C要连有4个键,其中碳碳双键属于2个键,碳碳三键属于3个键,往往省略掉。所以,当给出的结构中,如果1个C周围的键少于4个,则要由键补足至4个;如果多于4个,则一定不合理。
A. 该物质是正丁烷,图中省略了键,A正确;B. 该物质是异丁烷,图中省略了键,B正确;C. 图中有1个C周围连有5个键个单键和1个三键,不合理,C错误;D. 该物质是环丁烷,图中省略了键,D正确;故合理选项为C。
5.【答案】D 【解析】A.由图可知,过程①中钛氧键发生了断裂,断键吸收能量,A正确;B.根据图示,该反应中,光能和热能转化为化学能,B正确;C.使用作催化剂可以降低反应的活化能,从而提高化学反应速率,C正确;D.反应的,即2mol二氧化碳完全分解成2mol一氧化碳和1mol氧气需要吸热556kJ,D错误;故选:D。
6.【答案】C 【解析】①反应物中A的状态是固体,若混合气体的密度不变,则说明反应已经达到平衡状态,①符合题意;②该反应的反应前后气体的物质的量不变,反应在恒温、恒容密闭容器中进行,若混合气体的压强不变,则不能说明反应已经达到了平衡状态,②不符合题意;③反应物A是固体,若其质量发生改变,说明反应未达到平衡状态,若A的质量不变,则反应达到平衡状态,③符合题意;④该反应是反应前后气体的物质的量不变的反应,因此不能根据气体的总物质的量不变判断反应是否已经达到平衡状态,④不符合题意;⑤该反应的反应前后气体的物质的量不变。由于反应物A是固体,若反应未达到平衡状态,则气体的质量会发生改变,气体的平均相对分子质量也会发生改变,因此若混合气体的平均相对分子质量不变,说明反应已经达到平衡状态,⑤符合题意;故表明该反应已达到平衡状态的叙述是①③⑤,故合理选项是C。
7.【答案】D 【解析】A.硅是良好的半导体材料,体现的是硅的导电性,硅可能成为未来的能源新秀,体现的是硅的可燃性,二者没有因果关系,A不正确;B.过量的Cu与浓反应,后来生成的气体可能是NO,B不正确;C.硫单质在纯氧中燃烧只能生成,生成需要催化剂的帮助,C不正确;D.用氢氧化钠溶液来检验铵根,利用的就是铵盐与强碱的复分解反应,D正确;故选:D。
8.【答案】B 【解析】足量的锌和相同量的稀硫酸反应,a中加入硫酸铜溶液,会置换出金属铜,形成锌、铜、稀硫酸原电池,加速金属锌和硫酸反应的速率,所以反应速率:,速率越大,锌完全反应时所用的时间越短,所以a所用的时间小于b所用的时间;产生氢气的量取决于稀硫酸的物质的量,而a、b中金属锌均过量,和相同量的硫酸反应生成氢气的量相等,所以氢气的体积:;故选B。
9.【答案】D 【解析】A.是固体,浓度视为常数,增加的量浓度不变,反应速率不变,故A错误;B.升高温度,活化分子的数目增大,有效碰撞的次数增大,反应速率一定加快,故B错误;C.充入不参与反应的,使恒容密闭容器中的压强增大,实际参加反应的气体浓度不变,反应速率不变,故C错误;D.充入CO,增大反应物浓度,反应速率加快,故D正确;故选:D。
10.【答案】A 【解析】相同状况下气体体积相等,即气体的物质的量相等,可分别设NO、、的物质的量为1mol。由得失电子守恒可得关系,,,生成1mol气体消耗Cu的物质的量分别为、、1mol,所以在生成气体体积相同时消耗三份铜粉的质量比为:。故选:A。
11.【答案】D 【解析】A.制造普通玻璃的原料有石灰石、碳酸钠和石英,故A正确;B.SiC俗称金刚砂,可用作耐高温结构材料、耐高温半导体材料,故B正确;C.二氧化硫具有还原性,可用作葡萄酒抗氧化剂,也可用于杀菌消毒,故C正确;
D.二氧化硅具有良好光学特性,可用于制造光导纤维,故D错误;
故选:D。
12.【答案】BD 【解析】A.氯化铵分解生成氨气和氯化氢气体,在试管口遇冷,二者又会化合生成氯化铵,所以实验室不能直接分解氯化铵制备氨气,A正确;B.氨气能与氯化钙作用,生成,所以实验室不能用无水氯化钙干燥氨气,B错误;C.实验中同时打开止水夹a、c、d,氨气与氯化氢结合成氯化铵固体,使两烧瓶内气体压强都减小,从而形成喷泉,盛氨气的烧瓶内形成蓝色喷泉,盛氯化氢气体的烧瓶内形成红色喷泉,C正确;D.喷泉结束后,将烧瓶内溶液混合后,两溶质发生反应生成氯化铵,溶液显弱酸性,溶液呈紫色或红色,但蒸干时氯化铵会分解,得不到氯化铵固体,D错误;故选:BD。
13.【答案】AD 【解析】A.由表中可以看出实验①电流表指针偏向Al,说明Al是正极,而实验②中指针偏向Cu,说明此时Al是负极,故两实验中Al 电极的作用不相同,A正确;B.实验③中Al和石墨,Al为负极,而电流表指针偏向正极,故偏向石墨,B错误;C.由于Mg与NaOH溶液不反应,而Al能与NaOH溶液发生反应:,Al被氧化,故实验④中,Al为负极,电极反应式为: ,而Mg为正极,电极反应式为:;C错误;D.分析实验①②③可知铝在原电池中的作用,与另一个电极材料有关,分析实验①④可知铝在原电池中的作用,与电解质溶液有关,D正确;故答案为:AD。
14.【答案】BC 【解析】A.相对分子质量相同、结构不同的两种化合物,分子式不一定相同,如与,两者不是同分异构体,故A错误;有 、共4种同分异构体,故B正确;C.含有结构,为四面体结构,分子中所有原子一定不共面,故C正确;D.同分异构体之间的结构不同,同分异构体之间的转化必然有旧键断裂和新键形成,属于化学变化,故D错误;
故选:BC。
15.【答案】B 【解析】A.从图中可知,到末物质A减少了,物质B增加了,故A为反应物,B是生成物,且物质的量之比等于系数比,且后都不再改变,说明是可逆反应,故该反应的化学方程式是2AB,A错误;B.从图中可知,时物质A在继续减小,物质B在继续增加,故反应在向正方向进行,故正反应速率大于逆反应速率,B正确;C.从图中可知,时,A、B的物质的量均为相等,但是物质A还在减少,物质B还在增加,故反应并未达到了平衡状态,C错误;D.反应开始至, A的平均反应速率为,D错误;故答案为:B。
16.【答案】
【解析】 同素异形体是指由同种元素形成的不同单质,和属于同素异形体,故选:A; 同系物是指结构相似、在分子组成上相差一个或若干个原子团的化合物,故选:C; 分子式相同,结构不同的有机物,互为同分异构体,故选:E; 为,B为可简化为,C为,可简化为,三者C原子个数相同,中H原子数目最多,则等质量的以上物质完全燃烧时耗去的量最多的是,故选:A; 将1mol甲烷和适量的混合后光照,设的物质的量为amol,由C元素守恒可得,解得,、、、四种有机产物的物质的量分别为、、、,则参加反应的的物质的量为; 为乙烯,乙烯通入溴的四氯化碳溶液中发生加成反应,可使溴的四氯化碳溶液褪色,该反应的化学方程式:; 碱性燃料电池中,正极是氧气得电子生成,其电极方程式为。
17.【答案】和; ①②;;自50s开始,、的浓度保持不变 【解析】由图可知,X代表的物质是价的盐,即或,Y代表的是价的盐,即,故答案为:和;;①氧化还原反应的特征是元素的化合价发生变化,过程Ⅰ由中价的S转化为中价的S,故是氧化还原反应,过程Ⅱ由中价的转化为中价的S,故是氧化还原反应,过程Ⅲ由转化为没有化合价的改变,故不是氧化还原反应,故答案为:Ⅲ;②根据过程Ⅱ中发生的反应进行计算:可知在:;从表中可知,自50s以后、的浓度均不再改变,说明从50s开始反应达到化学平衡,故,化学平衡的重要标志是正逆反应速率相等,体系各组分的浓度保持不变;故答案为:;;自50s开始,、的浓度保持不变。
18.【答案】排出系统内的氧气,防止生成的NO被氧化 出现红棕色气体;强 【解析】B为一种紫红色金属,即B为铜,C为红棕色气体,即C为二氧化氮,则装置Ⅰ中是铜与浓硝酸反应制备二氧化氮的反应,装置Ⅱ中二氧化氮与水反应生成硝酸和NO,根据流程图,D为NO,在装置V中一氧化氮和二氧化氮与NaOH溶液反应,据此分析解答。为一种紫红色金属,即B为铜,C为红棕色气体,即C为二氧化氮,A与B的反应为浓,离子方程式为:;故答案为:;由于NO易被氧化,所以在反应之前应排尽装置中的氧气,本实验中在加入A之前需向整套装置中通入足量的气体,目的是排出系统内的氧气,防止生成的NO被氧化,故答案为:排出系统内的氧气,防止生成的NO被氧化;装置Ⅱ中二氧化氮与水反应生成硝酸和一氧化氮,反应的化学方程式为,故答案为:;根据流程图装置Ⅲ和,说明浓硝酸可以把一氧化氮氧化成二氧化氮,而稀硝酸不能把一氧化氮氧化,装置Ⅲ中的实验现象为:出现红棕色气体,所以浓硝酸的氧化性比稀硝酸强,故答案为:出现红棕色气体;强;因为一氧化氮、二氧化氮都是有毒气体,所以最后需要进行尾气处理,NO、与NaOH溶液发生归中反应生成亚硝酸钠和水,反应方程式为:,故答案为:。
19.【答案】浓
溶液变蓝
或;氧化
; 【解析】本实验的目的是用A装置、E装置分别制取、气体,然后验证的氧化性、的氧化性和还原性。中,Cu与浓硫酸在加热条件下反应,生成硫酸铜、二氧化硫和水,发生反应的化学方程式为浓。故答案为:浓;若C中加入淀粉碘化钾溶液,关闭,打开,使A产生的进入C,发生反应,则C中实验现象为溶液变蓝。故答案为:溶液变蓝;若要实现硫元素由价转化为0价,应与具有较强还原性的物质反应,同时需关闭,打开,在C中加入或溶液,此过程体现了的氧化性。故答案为:或;氧化;若C中加入品红溶液,打开、,使A、E产生的气体同时进入C中,观察到C中品红溶液没有褪色,原因可能为二者发生氧化还原反应,生成两种没有漂白性的物质硫酸和盐酸,离子方程式为。假设反应产生的有标准状况下全部进入C中,与刚好完全反应,由得失电子守恒可建立如下关系式:,则制备所需的质量至少为。故答案为:;。
相关试卷
这是一份湖南省长沙市南雅中学2023-2024学年高一上学期第三次12月月考化学试卷(Word版附答案),共10页。试卷主要包含了5 Fe~56等内容,欢迎下载使用。
这是一份湖南省长沙市南雅中学2023-2024学年高一上学期第三次12月月考化学试卷,共6页。
这是一份湖南省长沙市南雅中学2023-2024学年高一化学上学期第一次月考试题(Word版附解析),共13页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。








