




所属成套资源:人教版化学九下PPT课件+教案全册
- 课题3 《溶液的浓度》课件+教案 课件 1 次下载
- 实验活动5《一定溶质质量分数氯化钠溶液的配制》课件+教案 课件 2 次下载
- 课题1《常见的酸和碱》第二课时课件+教案 课件 1 次下载
- 课题1《常见的酸和碱》第三课时课件+教案 课件 1 次下载
- 课题2《酸和碱的中和反应》第一课时课件+教案 课件 1 次下载
人教版九年级下册课题1 常见的酸和碱备课课件ppt
展开
这是一份人教版九年级下册课题1 常见的酸和碱备课课件ppt,文件包含课题1《常见的酸和碱》第一课时教案pptx、课题1《常见的酸和碱》第一课时教案docx等2份课件配套教学资源,其中PPT共21页, 欢迎下载使用。
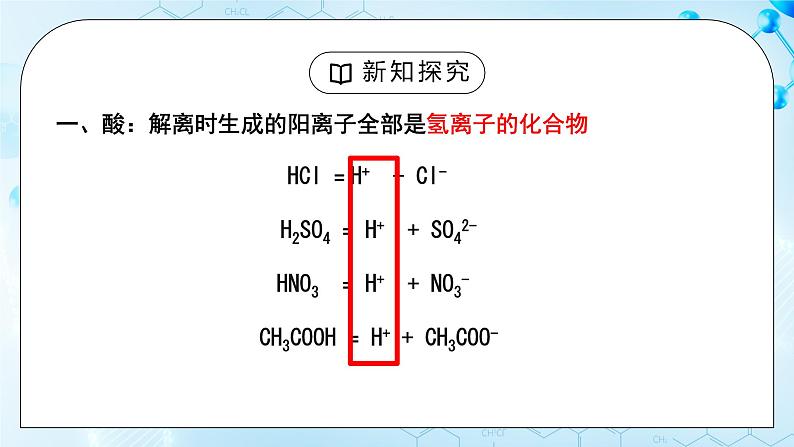
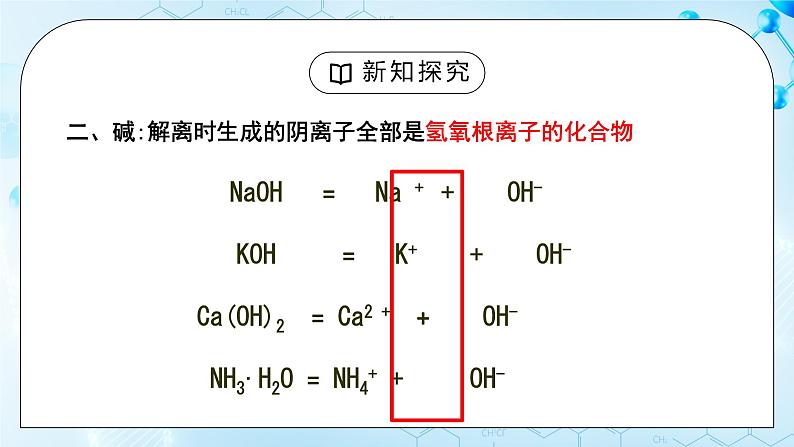
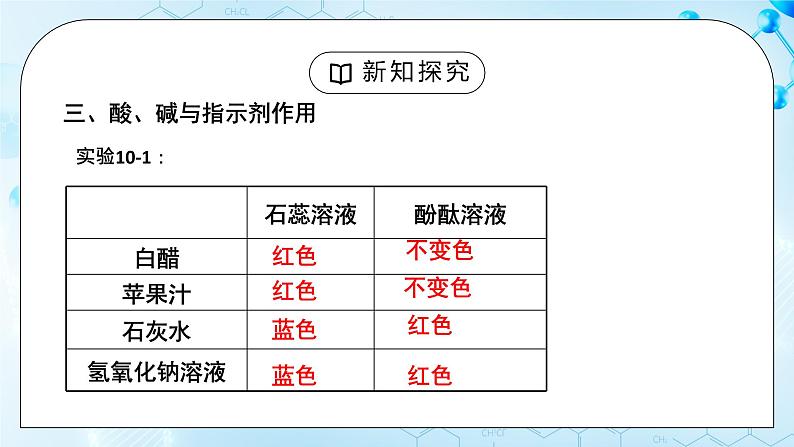
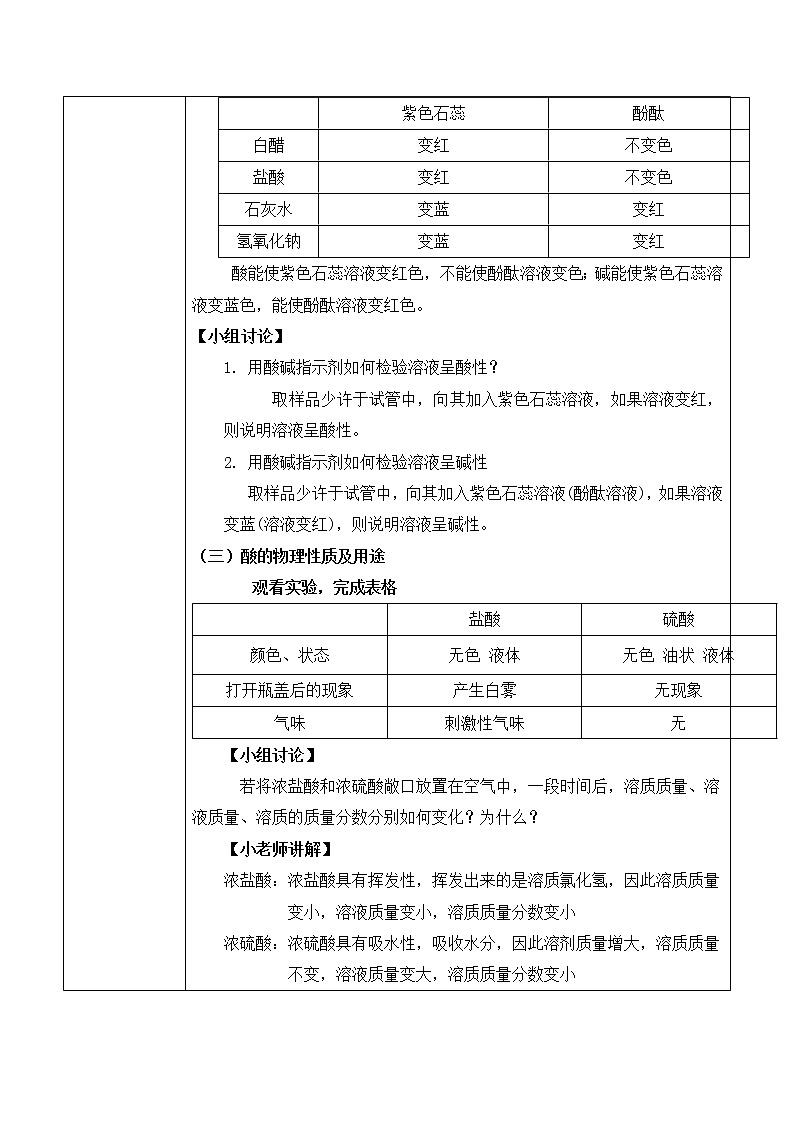
人教版化学九年级上册《常见的酸和碱》教学设计课题名常见的酸和碱教学目标1、掌握酸和碱的定义;2、认识紫色石蕊、无色酚酞两种酸碱指示剂,并会用酸碱指示剂检验溶液的 酸碱性。3、掌握盐酸、硫酸的物理性质及用途 教学重点盐酸、硫酸的物理性质及用途教学难点盐酸、硫酸的物理性质及用途教学过程一、新课导入 调味用食醋有酸味,有些水果中也有酸味,这是因为它们当中都含有酸。石灰水中有氢氧化钙,炉具清洁剂中含有氢氧化钠,这是因为它们都含有碱。酸和碱是两种不同的物质。二、新课探究一)、酸、碱的定义【自主学习】1、什么是酸碱指示剂以及酸和碱对指示剂的作用2、浓硫酸浓盐酸的性质以及用途【教师精讲】【副板】 HCl = H+ + Cl- NaOH = Na ++ OH- H2SO4 = H+ + SO42- KOH = K+ + OH- HNO3 = H+ + NO3- Ca(OH)2 = Ca2 + OH- 我们把这种解离时生成的阳离子全部是氢离子的化合物称为酸,我们把这种解离时生成的阴离子全部是氢氧根离子的化合物称为碱。二)、酸、碱与指示剂的作用 预习实验10-1,,观看实验,完成表格 紫色石蕊酚酞白醋变红不变色盐酸变红不变色石灰水变蓝变红氢氧化钠变蓝变红 酸能使紫色石蕊溶液变红色,不能使酚酞溶液变色;碱能使紫色石蕊溶液变蓝色,能使酚酞溶液变红色。【小组讨论】 用酸碱指示剂如何检验溶液呈酸性?取样品少许于试管中,向其加入紫色石蕊溶液,如果溶液变红,则说明溶液呈酸性。 用酸碱指示剂如何检验溶液呈碱性 取样品少许于试管中,向其加入紫色石蕊溶液(酚酞溶液),如果溶液变蓝(溶液变红),则说明溶液呈碱性。(三)酸的物理性质及用途观看实验,完成表格 盐酸硫酸颜色、状态无色 液体无色 油状 液体打开瓶盖后的现象产生白雾无现象气味刺激性气味无【小组讨论】若将浓盐酸和浓硫酸敞口放置在空气中,一段时间后,溶质质量、溶液质量、溶质的质量分数分别如何变化?为什么?【小老师讲解】浓盐酸:浓盐酸具有挥发性,挥发出来的是溶质氯化氢,因此溶质质量变小,溶液质量变小,溶质质量分数变小浓硫酸:浓硫酸具有吸水性,吸收水分,因此溶剂质量增大,溶质质量不变,溶液质量变大,溶质质量分数变小名称溶质质量溶剂质量溶液质量溶质的质量分数浓盐酸变小不变变小 浓硫酸不变变大变大 (五)、酸的物理性质及用途酸用 途盐酸(HCl)1.重要的化工产品;2.金属除锈、制造药物;3.胃液中盐酸帮助消化。硫酸(H2SO4)1.重要的化工原料;2.生产化肥、金属除锈;3.浓硫酸有吸水性做干燥剂。(六)浓硫酸的腐蚀性 三、当堂检测1.下列几种溶液敞口置于空气中,溶质成分不变,但溶质的质量分数减小且溶液质量增加的是( ) A.浓硫酸 B.浓盐酸 C.浓硝酸 D.石灰水 浓硫酸有强烈的腐蚀性,又叫脱水性。正确稀释浓硫酸的方法:浓硫酸沿烧杯壁慢慢注入水中,并用玻璃棒不断搅拌。不能将水注入浓硫酸:1、水的密度较小,会浮在浓硫酸上;2、浓硫酸溶解时放出大量热,使水立即沸腾。液滴四溅,非常危险。思考:如果不慎沾染浓硫酸怎么处理?1、先用大量水冲洗;2、涂上3 % -5%的碳酸氢钠溶液。 【课堂练习】1、下列几种溶液敞口置于空气中,溶质成分不变,但溶质的质量分数减小且溶液质量增加的是( C ) A.浓硫酸 B.浓盐酸 C.浓硝酸 D.石灰水2、生活中的一些物质中含有酸和碱,如食醋中含有 CH3COOH ,柠檬中含有柠檬酸,除锈剂中含有 HCl ,石灰水中含有 Ca(OH)2 ,路炉具清洁剂中含有 NaOH 。3、如何区分浓盐酸和浓硫酸?(1)打开瓶塞,观察到有白雾的时浓盐酸,另一种为浓硫酸;(2)打开瓶塞闻气味,有刺激性气味的时浓盐酸,另一种为浓硫酸;(3)用小木条分别蘸取少量样品,小木条变黑的时浓硫酸,另一种为浓硫酸;(4)分别将样品加入到盛有等量的水的试管中,震荡,触摸试管外壁,温度升高的时浓硫酸,另一种为浓盐酸。 布置作业1.练习与应用题。2.完成配套练习题。 板书设计 常见的酸和碱一、酸和碱的定义解离时生成的阳离子全部是氢离子的化合物称为酸,解离时生成的阴离子全部是氢氧根离子的化合物称为碱。 二、酸、碱与指示剂的作用 酸能使紫色石蕊溶液变红色,不能使酚酞溶液变色;碱能使紫色石蕊溶液变蓝色,能使酚酞溶液变红色三、酸的物理性质四、酸的用途浓盐酸具有挥发性;浓硫酸具有吸水性五、浓硫酸的腐蚀性 教学反思
相关课件
这是一份初中化学人教版九年级下册课题1 常见的酸和碱获奖ppt课件,文件包含第3课时常见的碱碱的化学性质pptx、第3课时常见的碱碱的化学性质docx、第3课时常见的碱碱的化学性质docx、第3课时常见的碱碱的化学性质学用docx、实验10-5探究氢氧化钠的物理性质mp4、实验10-6氢氧化钙的性质mp4、实验10-7溶液的导电性mp4等7份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
这是一份化学九年级下册课题1 常见的酸和碱精品ppt课件,文件包含第1课时酸碱指示剂几种常见的酸pptx、第1课时酸碱指示剂常见的酸docx、第1课时酸碱指示剂几种常见的酸docx、第1课时酸碱指示剂几种常见的酸学用docx、实验10-1指示剂在酸碱溶液中的显色反应mp4、实验10-2盐酸和硫酸的物理性质的比较mp4、实验10-3浓硫酸的腐蚀性mp4、实验10-4浓硫酸的稀释mp4、探究自制酸碱指示剂mp4等9份课件配套教学资源,其中PPT共27页, 欢迎下载使用。
这是一份初中化学人教版九年级下册课题1 常见的酸和碱评课课件ppt,文件包含课题1《常见的酸和碱》第三课时课件pptx、课题1《常见的酸和碱》第三课时课件docx等2份课件配套教学资源,其中PPT共19页, 欢迎下载使用。











