
2023六安一中高三上学期第二次月考化学试题含答案
展开六安一中2023届高三年级第二次月考
化学试卷
时间:90分钟 满分:100分
可能用到的相对原子质量有:H:1 N:14 C:12 O:16 Mg:24 Al:27 S:32
Cu:64 Fe:56 Ba:137 Zn:65 Co:59
一、选择题(其中1-12为单选题,每题3分,13-16为不定向选择题,每题有1-2个选项正确,每题4分,共52分)
1.2022年7月24日,在我国文昌航天发射场,成功将问天实验舱送人预定轨道。下列说法错误的是( )
A.火箭箭体采用了高强度新型钛合金结构,钛合金属于金属材料
B.火箭的整流罩的前锥段材料——聚甲基丙烯酰亚胺属于有机高分子材料
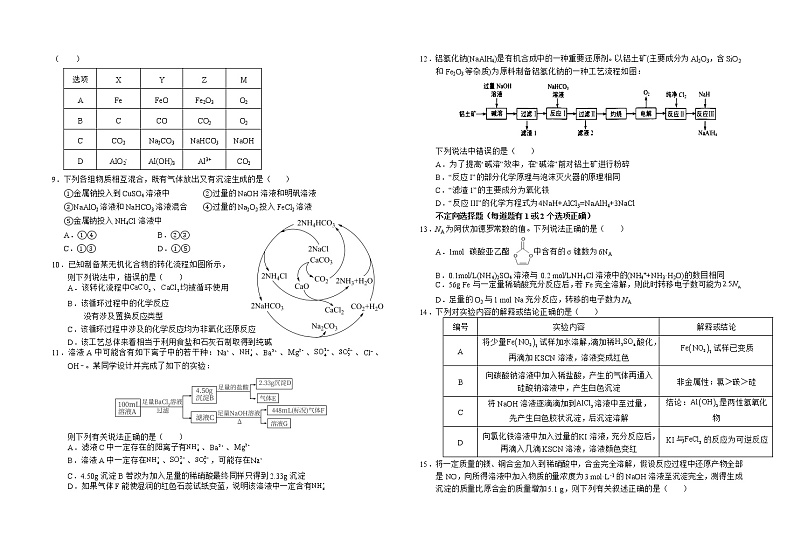
C.问天实验舱舱外设计上使用了石墨烯导热索技术,石墨烯属于新型无机非金属材料
D.问天实验舱搭载了2张长的柔性太阳翼,太阳翼是一种将太阳能转化为电能的新型
原电池装置
2.劳动光荣,奋斗幸福。下列劳动项目与所述化学知识不相符的是( )
选项 | 劳动项目 | 化学知识 |
A | 用热的纯碱溶液清洗油污 | Na2CO3溶液呈碱性, 加热促进油脂水解 |
B | 《天工开物》中记载:“世间丝、麻、裘、褐皆具素质” | 文中“丝、裘”的主要成分都是蛋白质 |
C | 《抱朴子》中记载:“丹砂(HgS)烧之成水银, 积变又还成丹砂” | 文中描述的过程是化学变化 |
D | 用糯米酿米酒 | 淀粉水解生成乙醇 |
3.下列离子方程式书写正确的是( )
A.明矾溶液与足量氨水反应:Al3++4NH3·H2O=AlO2—+2H2O+4NH4+
B.Fe3O4溶于HI溶液:Fe3O4 + 8H+ =Fe2+ + 2Fe3+ +4H2O
C.NaOH和Na2CO3等物质的量浓度混合溶液中加足量的盐酸:
CO32—+ OH—+3H+=CO2↑ + 2H2O
D.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:
4.下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将1molCl2通入含1molFeI2溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量, 可将Fe2+、I-均氧化 |
B | 向苯酚钠溶液中通入少量CO2 : C6H5O−+CO2+H2O→ C6H5OH+HCO3- | 正确,苯酚钠溶液与CO2 反应与CO2 的量无关 |
C | 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3 强于HClO |
D | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++ HCO3- +OH-= MgCO3↓+H2O | 正确;酸式盐与碱反应 生成正盐和水 |
5.下列条件下,可以大量共存的离子组是( )
A.中性溶液中:NH4+、Fe3+、SO42- ,NO3-
B.含有大量S2O32-的溶液中:H+、K+、、Al3+
C.0.1mol•L-1的NH4Cl溶液中:Li+、Ba2+、CH3COO-、OH-
D.某酸性无色透明溶液中:Na+、I-、Cl-、Mg2+
6.下列实验仪器或装置的选择正确的是( )
观察纯碱的 焰色反应 | 检验浓硫酸与铜 反应后的产物中 是否含有铜离子 | 比较和 的热稳定性 | 灼烧碎海带成灰 |
A | B | C | D |
7.下列各组物质中,因为反应条件或用量不同而发生不同化学反应的是( )
①Na与O2 ②氯水与溴化亚铁 ③Fe与Cl2 ④AlCl3溶液与氨水
⑤CO2与NaOH溶液 ⑥Fe与硝酸 ⑦AgNO3溶液与氨水
A.除③④外 B.除③⑦外 C.除⑥⑦外 D.除③外
8.下表各组物质中,可以实现XYZ(每步只发生一个反应)所示转化的是( )
选项 | X | Y | Z | M |
A | Fe | FeO | Fe2O3 | O2 |
B | C | CO | CO2 | O2 |
C | CO2 | Na2CO3 | NaHCO3 | NaOH |
D | AlO2- | Al(OH)3 | Al3+ | CO2 |
9.下列各组物质相互混合,既有气体放出又有沉淀生成的是( )
①金属钠投入到CuSO4溶液中 ②过量的NaOH溶液和明矾溶液
③NaAlO2溶液和NaHCO3溶液混合 ④过量的Na2O2投入FeCl2溶液
⑤金属钠投入NH4Cl溶液中
A.①④ B.②③
C.①③ D.①⑤
10.已知制备某无机化合物的转化流程如图所示,
则下列说法中,错误的是( )
A.该转化流程中、均被循环使用
B.该循环过程中的化学反应
没有涉及置换反应类型
C.该循环过程中涉及的化学反应均为非氧化还原反应
D.该工艺总体来看相当于利用食盐和石灰石制取得到纯碱
11.溶液A中可能含有如下离子中的若干种:、、、、、、、OH。某同学设计并完成了如下的实验:
则下列有关说法正确的是( )
A.滤液C中一定存在的阳离子有、、
B.溶液A中一定存在、、,可能存在
C.4.50g沉淀B若改为加入足量的稀硝酸最终同样只得到2.33g沉淀
D.如果气体F能使湿润的红色石蕊试纸变蓝,说明该溶液中一定含有
12.铝氢化钠(NaAlH4)是有机合成中的一种重要还原剂。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝氢化钠的一种工艺流程如图:
下列说法中错误的是( )
A.为了提高“碱溶”效率,在“碱溶”前对铝土矿进行粉碎
B.“反应I”的部分化学原理与泡沫灭火器的原理相同
C.“滤渣1”的主要成分为氧化铁
D.“反应III”的化学方程式为4NaH+AlCl3=NaAlH4+3NaCl
不定向选择题(每道题有1或2个选项正确)
13.NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1mol 碳酸亚乙酯 中含有的σ键数为6NA
B.0.1mol/L(NH4)2SO4溶液与 0.2 mol/LNH4Cl溶液中的(NH4++NH3·H2O)的数目相同
C.56g Fe与一定量稀硝酸充分反应后,若Fe完全溶解,则此时转移电子数可能为
D.足量的O2与1 mol Na充分反应,转移的电子数为NA
14.下列对实验内容的解释或结论正确的是( )
编号 | 实验内容 | 解释或结论 |
A | 将少量试样加水溶解,滴加稀酸化,再滴加KSCN溶液,溶液变成红色 | 试样已变质 |
B | 向碳酸钠溶液中加入稀盐酸,产生的气体再通入 硅酸钠溶液中,产生白色沉淀 | 非金属性:氯>碳>硅 |
C | 将NaOH溶液逐滴滴加到溶液中至过量, 先产生白色胶状沉淀,后沉淀溶解 | 结论:是两性氢氧化物 |
D | 向氯化铁溶液中加入过量的KI溶液,充分反应后, 再滴入几滴KSCN溶液,溶液颜色变红 | KI与的反应为可逆反应 |
15.将一定质量的镁、铜合金加入到稀硝酸中,合金完全溶解,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述正确的是( )
A.反应中转移电子的总物质的量为0.2 mol
B.反应过程中,消耗硝酸的物质的量为0.3 mol
C.沉淀完全时消耗NaOH溶液的体积为100 mL
D.开始加入合金的质量可能为6.4 g
16.某化合物W是由四种位于前四周期且均不同周期的常见元素组成的,探究其组成的实验过程如图(略去部分产物)。
已知:气体F燃烧时,火焰呈淡蓝色且有水生成;白色沉淀E可溶于强酸或强碱的溶液;
沉淀A为红色固体氧化物M和白色沉淀E的混合物。下列说法中错误的是( )
A.白色沉淀E为
B.化合物W中一定含有氢元素
C.生成无色气体B的反应中n(M):n(HNO3)=3:2
D.化合物W中质量分数最大的元素是铜元素
二、非选择题(本题共4小题,每空2分,共48分)
17.(12分)某澄清溶液中含有下表离子中的一种或多种。分别取它的水溶液两份进行实验,结果如下:
阳离子 | Fe2+、Fe3+、Al3+ |
阴离子 | SO32-、CO32-、SiO32-、I-、NO3- |
①向一份溶液中加入过量盐酸,产生气泡,溶液颜色变深;
②继续向①溶液中加入少许四氯化碳,振荡,静置,
下层呈现紫红色,上层溶液呈现黄色;
③向另一份溶液中加入过量氢氧化钠溶液,产生沉淀的质量
与加入碱液的体积关系如图所示。
根据以上信息,回答下列问题:
(1)原溶液中肯定含有的离子是________________________________;
(2)①中生成的气体是_______(填化学符号),它具有的性质是__________(填字母序号);
A.无色无味 B.能被NaOH溶液吸收 C.属于大气污染物 D.难溶于水
(3)①中发生反应的离子方程式有________________________、_______________________。
(4)③中沉淀溶解的化学反应方程式是________________________________________。
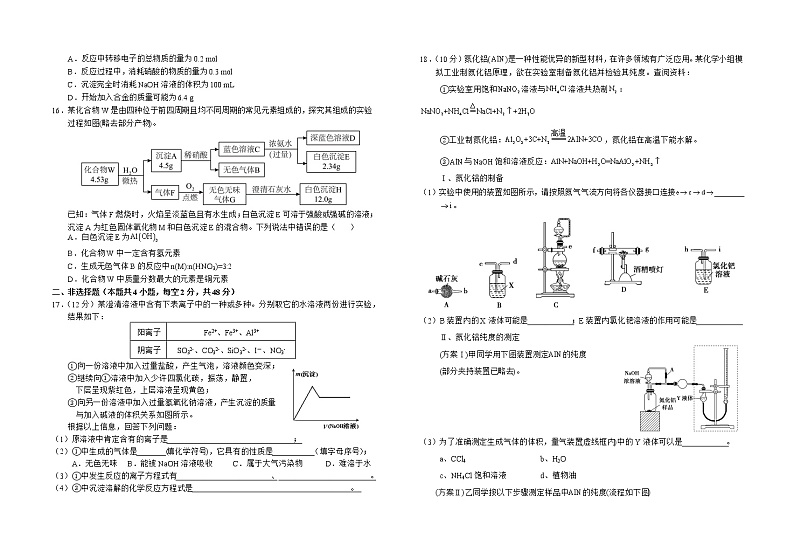
18.(10分)氮化铝()是一种性能优异的新型材料,在许多领域有广泛应用。某化学小组模拟工业制氮化铝原理,欲在实验室制备氮化铝并检验其纯度。查阅资料:
①实验室用饱和溶液与溶液共热制:
②工业制氮化铝:,氮化铝在高温下能水解。
③与饱和溶液反应:
Ⅰ、氮化铝的制备
(1)实验中使用的装置如图所示,请按照氮气气流方向将各仪器接口连接_______。
(2)B装置内的X液体可能是___________;E装置内氯化钯溶液的作用可能是___________
Ⅱ、氮化铝纯度的测定
(方案Ⅰ)甲同学用下图装置测定的纯度
(部分夹持装置已略去)。
(3)为了准确测定生成气体的体积,量气装置(虚线框内)中的Y液体可以是___________。
a、CCl4 b、H2O
c、NH4Cl饱和溶液 d、植物油
(方案Ⅱ)乙同学按以下步骤测定样品中的纯度(流程如下图)
(4)步骤②的操作是通入过量___________气体。
19.(14分)草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为,含少量等)制取工艺流程如图所示:
已知:①浸出液含有的阳离子主要有等;
②酸性条件下,不会氧化,转化为;
③部分阳离子的氢氧化物形式沉淀时溶液的见下表。
沉淀物 | |||||
开始沉淀 | 2.7 | 7.6 | 4.0 | 7.6 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 5.2 | 9.2 | 9.8 |
(1)回答下列问愿:浸出过程中加入的主要目的___________,发生反应的离子方程式为___________。
(2)向浸出液中加入发生反应的离子方程式为___________。
(3)向滤液Ⅰ中加入溶液得到的沉淀的主要成分是___________(写化学式)。
(4)萃取剂对金属离子的萃取率与的关系如图1所示,萃取剂的作用是除锰离子,其使用的适宜范围是___________(填字母代号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)①实验室里灼烧晶体,所需要的硅酸盐质仪器
除了酒精灯和玻璃棒外,还有___________(填仪器名称)
②热分解质量变化过程如图2所示。其中以前是隔绝空气加热,以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是______。
20.(12分)A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示。
(1)X的单质与A反应的化学方程式是_____________________________________。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是_________________ 。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是___________________________________
②某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是___________________
(4)氰化钠(NaCN)是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。NaCN的电子式为________;实验室用NaCN固体配制NaCN溶液时,应先将其溶于氢氧化钠溶液中,再用蒸馏水稀释。NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是_______________________。
六安一中2023届高三年级第二次月考
化学试卷参考答案
一、选择题
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
D | D | C | B | D | A | A | B | A | A | D | B | CD | D | D | C |
二、填空题(每空2分,共48分)
17、
(1)Al3+、Fe2+、I-、NO
(2)NO ACD
(3)6I-+2NO3-+8H+= 3I2+2NO↑+4H2O、3Fe2++ NO3-+4H+=3Fe3++NO↑+2H2O
(4)Al(OH)3+NaOH=NaAlO2+2H2O
18、
(1)f(g)→g(f)→a→b (2)浓硫酸 吸收CO防污染
(3)ad (4)二氧化碳或CO2
19、
(1)将Fe3+和Co3+还原
(2)
(3)CaF2、MgF2
(4)B
(5)(瓷)坩埚和泥三角 Co2O3
20、
(1)Fe2O3+2AlAl2O3+2Fe (2)2Al+2H2O+2OH-=2AlO+3H2↑
(3)①取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,
则证明原溶液中含有Fe3+
② 2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
(4)Na+[∶C⋮⋮N∶]- CN-+H2O2+H2O=HCO3-+NH3↑
六安一中2023届高三年级第二次月考
化学试卷参考答案
一、选择题
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
D | D | C | B | D | A | A | B | A | A | D | B | CD | D | D | C |
二、填空题(每空2分,共48分)
17、
(1)Al3+、Fe2+、I-、NO
(2)NO ACD
(3)6I-+2NO3-+8H+= 3I2+2NO↑+4H2O、3Fe2++ NO3-+4H+=3Fe3++NO↑+2H2O
(4)Al(OH)3+NaOH=NaAlO2+2H2O
18、
(1)f(g)→g(f)→a→b (2)浓硫酸 吸收CO防污染
(3)ad (4)二氧化碳或CO2
19、
(1)将Fe3+和Co3+还原
(2)
(3)CaF2、MgF2
(4)B
(5)(瓷)坩埚和泥三角 Co2O3
20、
(1)Fe2O3+2AlAl2O3+2Fe (2)2Al+2H2O+2OH-=2AlO+3H2↑
(3)①取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,
则证明原溶液中含有Fe3+
② 2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
(4)Na+[∶C⋮⋮N∶]- CN-+H2O2+H2O=HCO3-+NH3↑
2024六安一中高三上学期第二次月考化学试题含解析: 这是一份2024六安一中高三上学期第二次月考化学试题含解析,文件包含安徽省六安第一中学2023-2024学年高三上学期第二次月考化学试题含解析docx、安徽省六安第一中学2023-2024学年高三上学期第二次月考化学试题无答案docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
2023六安一中高三上学期第四次月考化学试题含解析: 这是一份2023六安一中高三上学期第四次月考化学试题含解析,共6页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2021六安一中高三上学期第二次月考化学试题扫描版含答案: 这是一份2021六安一中高三上学期第二次月考化学试题扫描版含答案,共8页。












