






所属成套资源:人教版化学选择性必修3课件PPT+教学设计全册
化学选择性必修3第三节 醛酮完美版ppt课件
展开
这是一份化学选择性必修3第三节 醛酮完美版ppt课件,文件包含33醛酮第1课时课件高二下学期化学人教版2019选择性必修3pptx、33醛酮教案高二下学期化学人教版2019选择性必修3docx等2份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
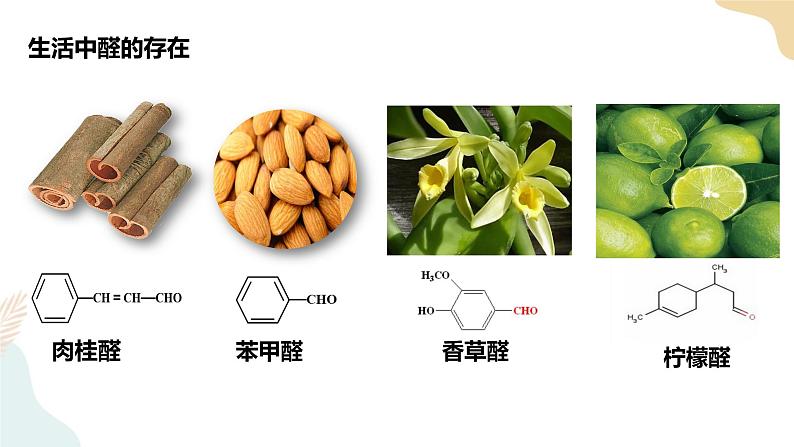
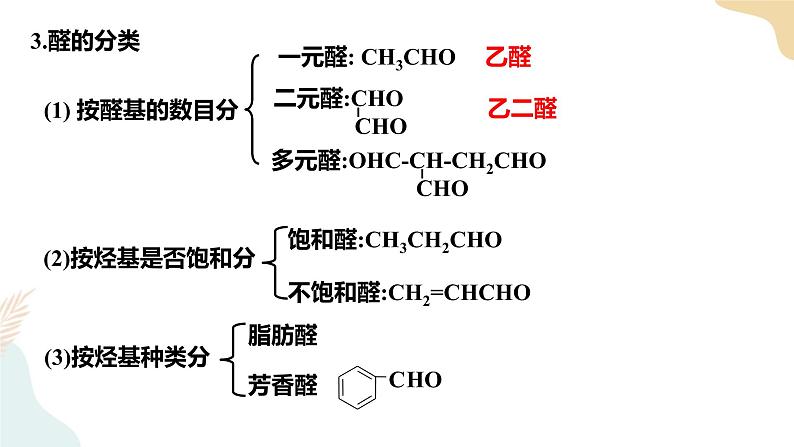
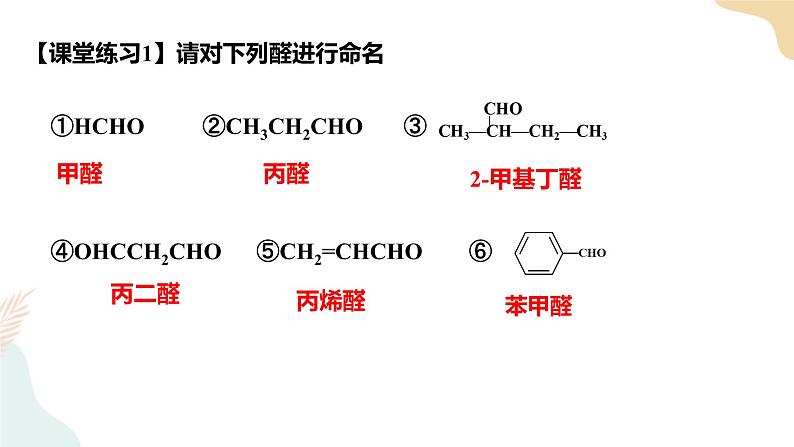
第三章 烃的衍生物 第三节醛 酮一、内容分析本节内容主要包括醛和酮,根据课程标准的要求,教材重点介绍醛,简单介绍酮。第一部分介绍乙醛的性质。 教材以乙醛作为醛的典型代表物,先介绍乙醛的物理性质,紧接着分析醛基官能团的特点,介绍乙醛的化学性质,即加成反应和氧化反应。在介绍加成反应时,分别介绍了乙醛与氢气、氰化氨的加成反应。教材中乙醛的氧化反应包括3个典型反应,即银镜反应、与新制氢氧化铜的反应,以及与氧气的反应。另外,教材通过“思考与讨论”栏目,要求学生运用有机反应规律说明乙醇、乙醛和乙酸三者之间的转化关系,进步强调官能团的转化,关注有机化合物官能团转化的基本规律。第二部分介绍醛类物质及其性质。教材在典型代表物乙醛的基础上,进步介绍甲醛和苯甲醛等其他醛类物质的性质和应用。在介绍醛类物质的性质时,教材从乙醛的结构和性质迁移到含醛基的有机化合物,只是说明其他醛类物质的性质与乙醛的相似,但没有给出反应的化学方程式。在完成“思考与讨论”栏目的教学时,可以要求学生写出相应的化学方程式。在介绍醛类物质的应用时,教材重点介绍了甲醛,并通过“信息搜索”栏目要求学生完成一篇有 关甲醛的小论文。第三部分介绍酮。课程标准对酮的要求不高,只要求学生知道酮的结构特点和应用。因此,教材仅以典型代表物丙酮为例介绍酮的性质,以及酮的结构特点和应用。最后,教材通过“思考与讨论”栏目,要求学生自主找出醛与酮的性质差异。二、核心素养1.宏观辨识与微观探析能基于官能团、化学键的特点分析和推断醛类,酮类的化学性质。能描述和分析醛、酮的重要反应,能书写相应的化学方程式。2.科学探究与创新意识能通过实验探究乙醛与银氨溶液、新制氢氧化铜悬浊液的反应及其在醛基检验中的应用。3.证据推理和模型认知通过醛基、酮羰基中原子成键情况的分析,理解醛、酮的化学性质与醛基、酮羰基的关系。掌握醛基的检验方法。能根据醛、酮的结构预测醛、酮发生的反应。4.科学态度与社会责任结合生产、生活实际了解醛类对环境和健康可能产生的影响,知道常见醛、酮的物理性质,关注有机化合物安全使用的问题,形成环境保护意识,养成节约适度、绿色低碳的生活方式。三、教学重难点重点:乙醛的结构特点和主要化学性质。难点:乙醛的氧化反应及相关化学方程式的书写。四、教学过程【导入新课】自然界的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用。 一、醛类1.定义:醛基与烃基(或H原子)直接相连的化合物称为醛2.分类 饱和一元醛的分子通式:CnH2nO (n≥1 )或CnH2n+1CHO 结构通式:RCHO【教师活动】醛、酮的命名和醇的命名相似3.系统命名 ①选择含有醛基的最长碳链最为主链 ②从靠近醛基的一端开始依次给主链碳原子编号【注意】由于醛基总是位于碳链的一端,所以醛基碳总是在第一位!【课堂练习1】请对下列醛进行命名①HCHO ②CH3CH2CHO ③ ④OHC-CHO⑤OHCCH2CHO ⑥CH2=CHCHO ⑦ ⑧ 4.物理性质 ①随C数↑:熔沸点增大,随支链增多而降低;密度随C数↑而逐渐增大;
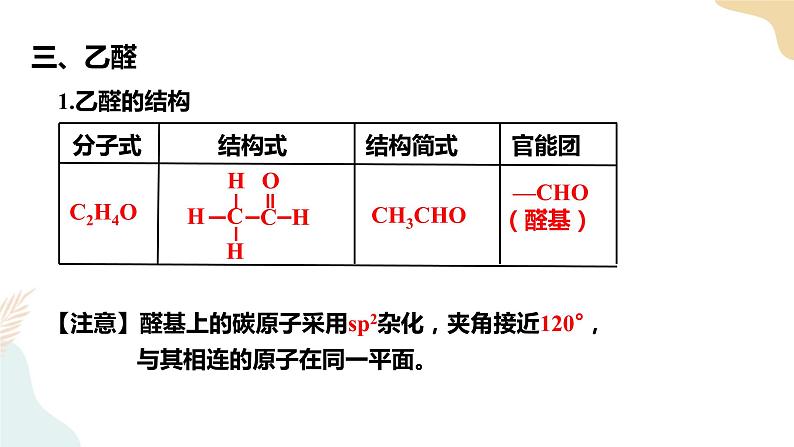
②溶解度:随着C数↑,在水中的溶解度逐渐减小,低级醛易溶于水(CH3CHO、HCHO) ③状态:除甲醛(HCHO)是气体,其他的醛常温下是液体或者固体,有一定气味(或刺激性气味) 【教师活动】以乙醛为例,我们一起来探究醛类物质的性质。二、乙醛的分子结构和物理性质1.分子结构分子式:C2H4O 结构式: 结构简式:CH3CHO官能团名称:醛基 官能团结构简式:-CHO【注意】①醛基不能写成-COH 或-CH=O。②醛基上的碳原子采用sp2杂化,夹角接近120°,与其相连的原子在同一平面【课堂练习2】 中最少有 个原子共面,最多有 个原子共面 【教师活动】展示乙醛溶液【学生活动】观察,闻气味,总结乙醛的物理性质2.物理性质无色、有刺激性气味的液体;密度比水小,沸点是20.8℃;易挥发,易燃烧;易溶于水、乙醇、乙醚、氯仿等有机溶剂。【教师活动】从结构上分析可知。乙醛分子中含有官使团一CHO,它对乙醛的化学性质起着决定性的作用。从C=O的结构特点分析乙醛可能N发生的反应。 三、乙醛的化学性质1.加成反应(还原反应)①与H2加成: 【注意】①乙醛不能与X2、HX、H2O进行加成反应②酯基(—COO—)和羧基 (—COOH) 中的C=O不能与H2发生加成反应②与HCN加成 【原理】当极性分子与醛基发生加成反应时,带正电荷的原子或原子团连接在氧原子上,带负电荷的原子或原子团连接在碳原子上。应用:醛与氢氰酸加成,在有机合成中可以用来增长碳链。 2.氧化反应(1)与O2反应①可燃性:②催化氧化: 【小结】 醇CnH2n+2O 醛CnH2nO 羧酸CnH2nO2 【过渡】乙醛具有还原性。能与氧气发生反应, 那能和弱氧化剂反应吗?(2)与弱氧化剂的反应
①银镜反应:与银氨溶液的反应
【探究实验2】教材P67:实验3—7 现象:试管内壁覆着一层光亮的银镜 制备银氨溶液的方法:在洁净的试管中加入1ml 2%AgNO3 溶液,然后边振荡试管边逐滴滴入2%NH3·H2O ,至最初产生的沉淀恰好溶解为止;相关反应方程式: ①中:AgNO3 + NH3·H2O = AgOH↓(白色) + NH4NO3; AgOH + 2NH3·H2O = [Ag(NH3)2]OH + 2H2O。③中:CH3CHO+2[Ag(NH3)2]OH CH3COONH4+2Ag↓+3NH3+H2O。 【小结】银镜反应的应用 ①检验醛基的存在及测定醛基的数目【牢记】1mol –CHO~ 2 mol [Ag(NH3)2]OH~ 1 mol H2O~ 2 mol Ag~ 3mol NH3②工业上用来制瓶胆和镜子 【课堂练习3】完成下列化学方程式① CH3CH2CHO + [Ag(NH3)2]OH ② + [Ag(NH3)2]OH ③ HCHO + [Ag(NH3)2]OH 【小结】银镜反应实验注意事项①制备银氨溶液时,试剂滴加顺序不能颠倒,且氨水不能过量②银氨溶液必须是新制的(现用现配)③试管内壁应洁净,必须用水浴加热,不能用酒精灯直接加热;④加热时不能振荡或摇动试管;⑤可以用AgNO3溶液清洗做过银镜反应后的试管。【探究实验2】铜镜反应:教材P67:实验3—8 现象:①中:产生蓝色沉淀 ③中:试管内产生了砖红色沉②与新制氢氧化铜反应CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O【注意】①氢氧化铜溶液一定要新制 ②碱一定要过量【应用】①可以用来定性或定量检验醛基的存在;1mol –CHO~2mol Cu(OH) 2~ 1molNaOH~ 1mol Cu2O~ 3mol H2O②医学上检验病人是否患糖尿病
【课堂练习4】完成下列化学方程式①CH3CH2CHO + Cu(OH)2 + NaOH ② + Cu(OH)2 + NaOH ③ HCHO + Cu(OH)2 + NaOH(3)与强氧化剂反应:能使酸性KMnO4溶液、酸性K2Cr2O7溶液及溴水褪色
CH3CHO + Br2 + H2O→CH3COOH+ 2HBr 【小结】醛类的两个特征反应及—CHO的检验特征反应银镜反应与新制的Cu(OH)2反应
现象产生银镜
产生砖红色沉淀
注意事项①试管内壁必须洁净②银氨溶液随用随配,不可久置③水浴加热,不可用酒精灯直接加热④醛用量不宜太多⑤银镜可用AgNO3溶液浸泡洗涤除去①新制的Cu(OH)2要随用随配②)配制新制的Cu(OH)2时,所用NaOH溶液必须过量
③Cu(OH)2的量要少 ④加热至沸腾,但温度不能过高共同点①两个反应都必须在碱性环境中进行②-CHO与[Ag(NH3)2]OH或Cu(OH)2均以物质的量比1:2反应四、乙醛的制备:写出工业上制取乙醛的化学方程式1.乙醇氧化法:2.乙烯氧化法:3.乙炔水化法:【归纳总结】完成下表,“√”代表能发生反应,“×”代表不能发生反应)官能团试剂 碳碳双键碳碳三键苯的同系物醇酚醛酮酸性KMnO4溶液√√√√√√×溴水(Br2/CCl4)√√××√√×与H2加成√√√×√√√ 【过渡】除乙醛外,其他醛类化合物,如甲醛、丙醛,苯甲醛等,他们在分子结构中都含有醛基,所以化学性质与乙醛相似。五、甲醛(蚁醛)1.物理性质:无色、有刺激性气味气体,易溶于水甲醛的水溶液(35%~40%)称福尔马林,具有杀菌、防腐性能,可用于消毒和制作标本。2.化学性质HCHO+4[Ag(NH3)2]OH 2H2O + 4Ag↓ + 6NH3 + (NH4)2CO3HCHO+4Cu(OH)2+2NaOH Na2CO3 + 2Cu2O↓ + 6H2O 【教师活动】结合酮的官能团结构,酮的化学性质与醛的化学性质有哪些相同点和不同点呢?五、酮1. 定义:由酮羰基跟两个烃基相连的化合物。2. 物理性质丙酮:是最简单的酮,常温下是无色透明的液体,易挥发,具有令人愉快的气味,能与水、乙醇等混溶。3.用途:重要的有机溶剂和化工原料,丙酮可作化学纤维、钢瓶贮存乙炔等的溶剂,还用于生产有机玻璃、农药和涂料等。4. 化学性质①能燃烧,但不能和银氨溶液及新制的 Cu(OH)2反应②不能使溴水、酸性高锰酸钾溶液褪色③可加氢还原为相应的醇 【课堂小结】
相关课件
这是一份高中化学人教版 (2019)选择性必修3第三节 醛酮完美版ppt课件,共34页。PPT课件主要包含了CH3-C-H,+H-H,O-H等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修3第三节 醛酮优秀课件ppt,共60页。PPT课件主要包含了新课导入,第三节醛酮,第三章,新知讲解,官能团,表示方法,简写为RCHO,醛基碳的杂化类型,⒈物理性质,⒉分子结构等内容,欢迎下载使用。
这是一份高中化学第三节 醛酮一等奖课件ppt,共38页。









