
- 3.5有机合成 第2课时 课件高二化学人教版(2019)选择性必修3 课件 17 次下载
- 3.5有机合成 第3课时 课件 高二化学人教版(2019)选择性必修3 课件 17 次下载
- 3.5 有机合成 第1课时 讲义 高二化学人教版(2019)选择性必修3 其他 17 次下载
- 4.1 糖类课件+教案 课件 22 次下载
- 4.2 蛋白质课件+教案 课件 20 次下载
3.4 羧酸 羧酸的衍生物 第1课时教学设计下学期高二化学人教版(2019)选择性必修3
展开第三章 烃的衍生物
第四节 羧酸 羧酸的衍生物
一、内容分析
本节包括羧酸和羧酸衍生物两部分内容,羧酸衍生物主要包括酯、油脂和酰胺。需要说明的是,尽管课程标准没有提及油脂,教材仍然把油脂作为羧酸衍生物进行了介绍。另外,课程标准对胺和酰胺这两种烃的含氮行生物的要求较低,学生只需知道胺和酰胺的结构特点及应用。
本节课介绍羧酸。 教材在乙酸的基础上介绍羧酸的一些简单分类,以及甲酸、苯甲酸和乙二酸等几种常见羧酸的物理性质和用途,并以表格的方式列举几种羧酸的熔点和沸点数据。按酸的化学性质主要取决于羧基官能团,教材分析了羧基的结构特点,并解释羧酸的化字性质。由于必修教材中已介绍了羧酸的典型代表物乙酸的性质,为了避免简单的重复,
教材通过探究羧酸的酸性,让学生利用乙酸的酸性去设计实验解决问题,通过“思考与讨论”让学生进一步了解酯化反应的脱水方式。
二、核心素养
1.宏观辨识与微观探析
能基于官能团、化学键的特点分析和推断羧酸的化学性质。能描述和分析羧酸的重要反应,能书写相应的化学方程式。了解酯化反应与酯水解反应的化学键变化
2.变化观念与平衡思想
以乙酸为代表物,了解羧酸的组成与结构,理解羧酸的化学性质及应用,以乙酸乙酯为代表物,了解酯的结构和主要性质。
3.科学探究与创新意识
探究乙酸、碳酸、苯酚的酸性强弱,了解示踪原子法在酯化反应反应机理分析中的应用。
4.科学态度与社会责任
结合生产、生活实际了解羧酸在生活和生产中的应用。
三、教学重难点
教学重点:羧酸的结构及性质
教学难点:羧酸酸性强弱的比较,酯化反应中有机化合物的断键规律
四、教学过程
【新课引入】自然界的许多植物中含有有机酸,例如,蚁酸(甲酸)、乳酸)、草酸(乙二酸)、柠檬酸等。
一、羧酸的结构与分类
1.定义:羧酸分子中烃基(或氢原子)和羧基相连而构成的有机化合物
官能团:—COOH
2.饱和一元羧酸的通式:CnH2n+1COOH或CmH2mO2
【注意】饱和一元羧酸与比它多一个碳原子的饱和一元醇Cm+1H2(m+1)+2O等相对分子质量
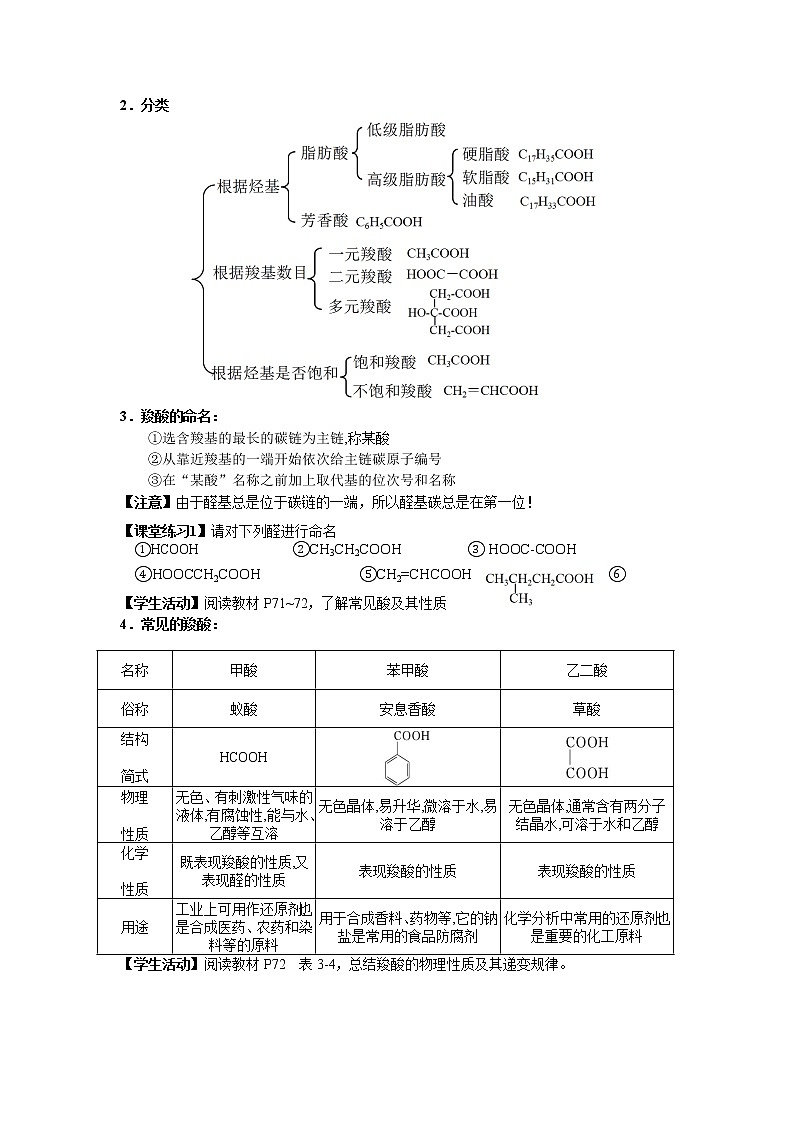
2.分类
3.羧酸的命名:
①选含羧基的最长的碳链为主链,称某酸
②从靠近羧基的一端开始依次给主链碳原子编号
③在“某酸”名称之前加上取代基的位次号和名称
【注意】由于醛基总是位于碳链的一端,所以醛基碳总是在第一位!
【课堂练习1】请对下列醛进行命名
①HCOOH ②CH3CH2COOH ③ HOOC-COOH
④HOOCCH2COOH ⑤CH2=CHCOOH ⑥
【学生活动】阅读教材P71~72,了解常见酸及其性质
4.常见的羧酸:
名称 | 甲酸 | 苯甲酸 | 乙二酸 |
俗称 | 蚁酸 | 安息香酸 | 草酸 |
结构 简式 | HCOOH | ||
物理 性质 | 无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶 | 无色晶体,易升华,微溶于水,易溶于乙醇 | 无色晶体,通常含有两分子结晶水,可溶于水和乙醇 |
化学 性质 | 既表现羧酸的性质,又表现醛的性质 | 表现羧酸的性质 | 表现羧酸的性质 |
用途 | 工业上可用作还原剂,也是合成医药、农药和染料等的原料 | 用于合成香料、药物等,它的钠盐是常用的食品防腐剂 | 化学分析中常用的还原剂,也是重要的化工原料 |
【学生活动】阅读教材P72表3-4,总结羧酸的物理性质及其递变规律。
二、物理性质:
1.熔沸点:
①随分子中碳原子数的增加,熔沸点逐渐升高,随支链增多熔沸点逐渐降低。
②羧酸与相对分子质量相当的其他有机化合物相比,沸点较高,这与羧酸分子间可以形成氢键有关。
2.溶解度:
①甲酸、乙酸等分子中碳原子数较少的羧酸能够与水互溶。
②随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水。
③高级脂肪酸是不溶于水的蜡状固体。
【教师活动】分析羧酸化学键的极性,指出容易断键的位置。想一想可能会发生什么类型的反应?
【学生活动】①O-H断裂:解离出氢离子,表现酸性
②C-O断裂: -OH被取代,生成酯、酰胺等羧酸衍生物
三、化学性质
1.弱酸性:具有酸的通性
一元羧酸电离的方程式: R-COOH ⇌R-COO- + H+
(1)与指示剂反应:使紫色石蕊试液变 红
(2)与活泼金属起置换反应(与氢前金属反应)
2CH3COOH + 2Na = 2CH3COONa + H2↑
(3)与碱性氧化物反应
2CH3COOH + Cu2O = 2CH3COOCu + H2O
(4)中和反应
CH3COOH + NaOH = CH3COONa + H2O
(5)与某些盐反应
2CH3COOH + CaCO3 = Ca(CH3COO)2 + H2O
CH3COOH + NaHCO3 = CH3COONa + CO2↑+ H2O
【实验探究】比较乙酸、碳酸和苯酚的酸性强弱
原理:强酸制弱酸
B装置现象及解释 | 有 无 色气体产生,说明酸性:乙酸 > 碳酸; 方程式:2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O |
D装置的现象及解释 | 溶液 变浑浊 ,说明酸性:碳酸 > 苯酚 方程式:CO2 + H2O + C6H5ONa → C6H5OH + NaHCO3 |
C装置的作用 | 除去CO2中的乙酸蒸气,防止对碳酸酸性大于苯酚的检验产生干扰 |
实验结论 | 酸性:乙酸 > 碳酸 > 苯酚 > HCO3— |
2.酯化反应:羧酸和醇在酸催化下生成酯和水的反应,属于取代反应
【实验】乙酸与乙醇酯化反应
原理:酸脱 羟基 ,醇脱 氢
实验操作 | 在试管中先加入3mL乙醇,然后一边振荡试管一边慢慢地加入2mL浓硫酸和2mL乙酸,加入2-3块碎瓷片。连接好装置,用酒精灯小心均匀地加热试管3-5min,将产生的气体经导管通到饱和碳酸钠溶液的液面上,观察现象。 |
实验现象 | ①饱和Na2CO3溶液的液面上有透明的油状液体生成 ②能闻到香味 |
注意事项 | ①试剂加入顺序为乙醇、浓硫酸、冰醋酸 ②浓硫酸起催化剂和吸水剂作用 ③实验需要缓慢加热,以防乙酸和乙醇大量挥发,液体剧烈沸腾;防止副反应发生④导气管在液面上是为了防倒吸 ⑤饱和碳酸钠的作用是:吸收乙醇,反应乙酸,降低乙酸乙酯的溶解度 |
提高乙酸乙酯产率措施 | ①用浓硫酸吸水 ②加热将酯蒸出 ③适当增加乙醇的用量 |
【小结】常见的酯化反应
1.一元羧酸与二元醇或二元羧酸与一元醇的酯化反应
①乙酸与乙二醇
②乙二酸与乙醇
2.多元羧酸与多元醇之间的酯化反应:如乙二酸与乙二醇
①生成普通酯
②生成环酯
③生成高分子化合物
【课堂小结】









