



所属成套资源:人教版化学选择性必修1PPT课件
人教版 (2019)第一节 化学反应速率获奖课件ppt
展开
这是一份人教版 (2019)第一节 化学反应速率获奖课件ppt,共21页。PPT课件主要包含了反应物的性质,温故知新,有效碰撞,普通分子,活化分子,→v↑,有效碰撞次数↑,温度↑,活化分子百分数↑,运动加快碰撞频率↑等内容,欢迎下载使用。
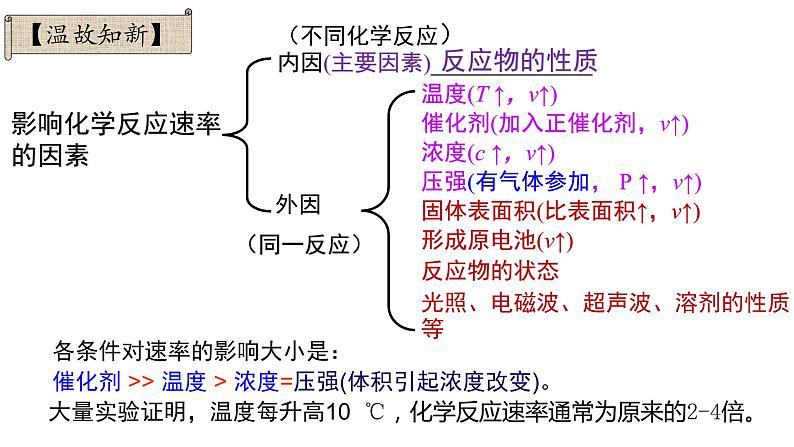
各条件对速率的影响大小是: 催化剂 >> 温度 > 浓度=压强(体积引起浓度改变)。
(不同化学反应)内因(主要因素)______________
影响化学反应速率的因素
外因(同一反应)
温度(T ↑,v↑)催化剂(加入正催化剂,v↑)浓度(c ↑,v↑)压强(有气体参加, P ↑,v↑)固体表面积(比表面积↑,v↑)形成原电池(v↑)反应物的状态光照、电磁波、超声波、溶剂的性质等
大量实验证明,温度每升高10 ℃,化学反应速率通常为原来的2-4倍。
【问题】如何解释浓度、压强、温度及催化剂等因素对化学反应速率的影响呢?
【微观探析】理论分析,从有效碰撞的角度理解影响化学反应速率的因素
阅读教材P25-26页,回答下列问题:1、什么是基元反应和反应历程?2、什么是有效碰撞?发生有效碰撞的条件是什么?3、什么是活化分子?什么是活化能?在能量反应图里怎么表示活化能?
【学习任务一】认识有效碰撞理论
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。
每一步反应都称为基元反应,这两个先后进行的基元反应反映了2HI= H2+ I2 的反应历程。反应历程又称反应机理。
如2HI=H2 + I2 ,实际上是经过下列两步反应完成的: ① 2HI→ H2 + 2I·(自由基) ② 2I· → I2。
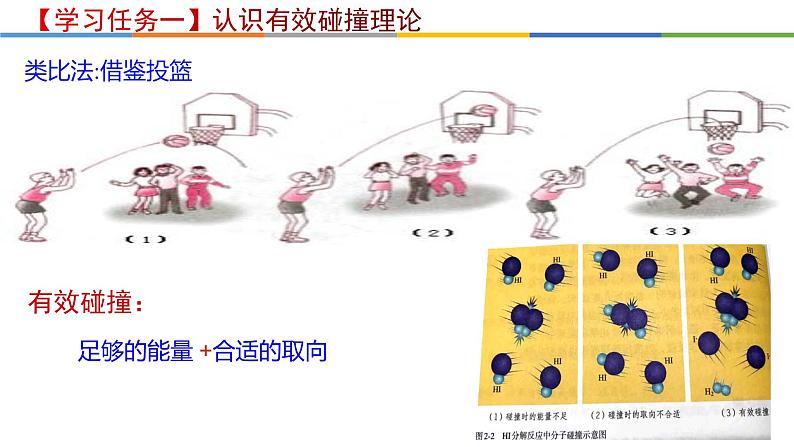
【质疑】基元反应发生的先决条件是反应物分子必须发生碰撞,那么反应物分子发生的每一次碰撞都能发生反应吗?
类比法:借鉴投篮
足够的能量 +合适的取向
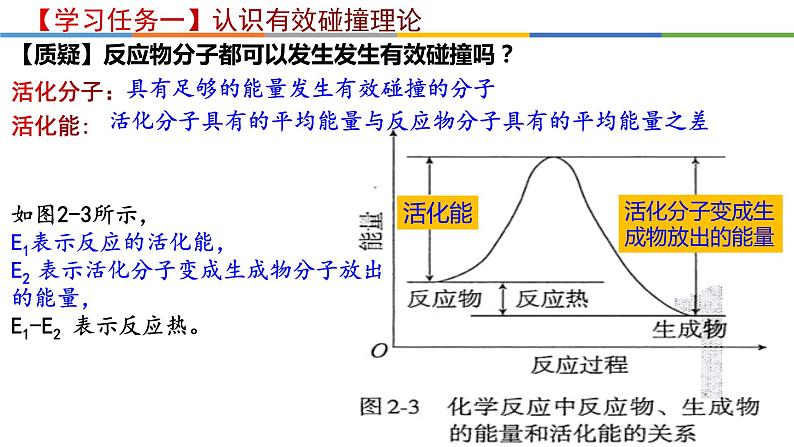
活化分子具有的平均能量与反应物分子具有的平均能量之差
如图2-3所示,E1表示反应的活化能,E2 表示活化分子变成生成物分子放出的能量,E1-E2 表示反应热。
具有足够的能量发生有效碰撞的分子
活化分子变成生成物放出的能量
【质疑】反应物分子都可以发生发生有效碰撞吗?
一个反应要发生一般经历哪些过程?
活化分子百分数:活化分子数/分子总数 ×100%
化学反应速率与活化分子、有效碰撞的关系:
N活化分子 = N总分子× 活化分子%
单位体积内___________越多(或活化分子的百分数越大)→单位时间内_________次数越多→化学反应速率___________。
构建模型【有效碰撞理论模型】
对某一化学反应,一定条件下,反应物分子中活化分子的百分数是一定的,单位体积内活化分子的数目与反应物分子的总数成正比。(课本P26最后一段)
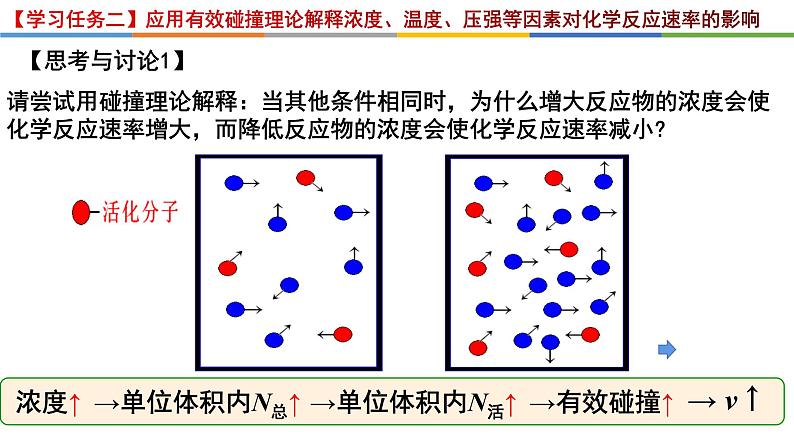
请尝试用碰撞理论解释:当其他条件相同时,为什么增大反应物的浓度会使化学反应速率增大,而降低反应物的浓度会使化学反应速率减小?
【学习任务二】应用有效碰撞理论解释浓度、温度、压强等因素对化学反应速率的影响
气体P↑,V体↓,气体浓度↑即单位体积内反应物分子总数↑
单位体积内活化分子数↑
请尝试用碰撞理论解释:当其他条件相同时,为什么增大压强会使化学反应速率增大,而减小压强会使化学反应速率减小?
请尝试用碰撞理论解释:当其他条件相同时,为什么升高温度会使化学反应速率增大,而降低温度会使化学反应速率减小?
使用催化剂→降低活化能→大大增加活化分子百分数 →增加有效碰撞几率 →加快反应速率
请尝试用碰撞理论解释:当其他条件相同时,为什么加入催化剂会使化学反应速率增大?
催化剂的研究是高科技领域的重要内容。
【知识拓展】除了改变浓度、温度、压强及选用催化剂等,还有很多改变化学反应速率的方法。例如,通过光辐照、放射线辐照、超声波、电弧、强磁场、高速研磨等。总之,向反应体系输入能量,都有可能改变化学反应速率。
1.在有气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )A.增大反应物的浓度 B.降低温度C.增大压强 D.加入催化剂
Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
向盛有PbO2和稀H2SO4混合物的试管中滴加含Fe2+的溶液,振荡使其充分反应,观察现象;再向其中加入Pb,振荡使其充分反应,观察现象。
【高考链接】(2018年全国I卷)采用N2O5为硝化剂是一种新型的绿色硝化技术,在材料、医药等工业中得到广泛应用。回答下列问题:(3)对于反应2N2O5(g)→4NO2(g)+O2(g),提出如下反应历程: 第一步 N2O5 NO2+NO3 快速平衡 第二步 NO2+NO3→NO+NO2+O2 慢反应 第三步 NO+NO3→2NO2 快反应其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是___________(填标号)。A. v(第一步的逆反应)>v(第二步反应)B. 反应的中间产物只有NO3C. 第二步中NO2与NO3的碰撞仅部分有效D. 第三步反应活化能较高
4、(2019年全国I卷)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。
可知水煤气变换的ΔH 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正= eV,写出该步骤的化学方程式: 。
5、炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法不正确的是( )
A. 每活化一个氧分子吸收0.29eV能量B. 水可使氧分子活化反应的活化能降低0.18 eVC. 氧分子的活化是O-O的断裂与 C-O键的生成过程D. 炭黑颗粒是大气中SO2转化为SO3 的催化剂
相关课件
这是一份化学第二章 化学反应速率与化学平衡第一节 化学反应速率公开课课件ppt,文件包含新人教版化学选择性必修一212影响化学反应速率的因素活化能课件pptx、新人教版化学选择性必修一212影响化学反应速率的因素活化能针对练习含解析docx、新人教版化学选择性必修一212影响化学反应速率的因素活化能教案doc等3份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
这是一份化学选择性必修1第一节 化学反应速率精品课件ppt,文件包含212活化能练习解析版docx、212活化能练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
这是一份人教版 (2019)选择性必修1第一节 化学反应速率一等奖ppt课件,文件包含人教版高中化学选择性必修一212《活化能》课件pptx、人教版高中化学选择性必修一212《活化能》学案docx等2份课件配套教学资源,其中PPT共28页, 欢迎下载使用。










