



人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优质课件ppt
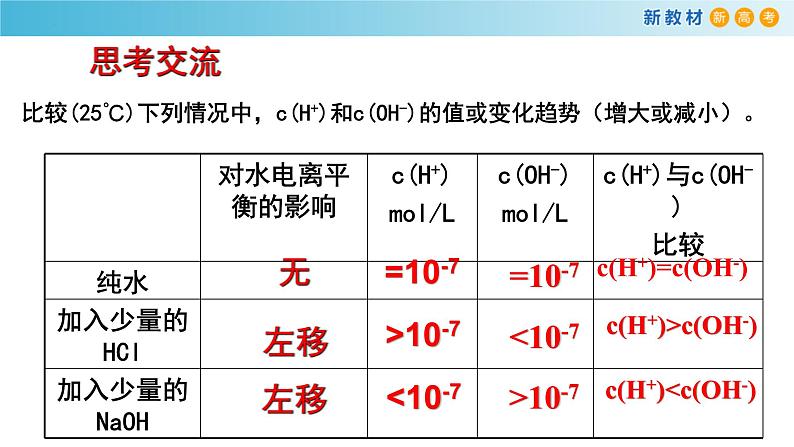
展开比较(25℃)下列情况中,c(H+)和c(OH-)的值或变化趋势(增大或减小)。
c(H+)=c(OH-)
c(H+)>c(OH-)
c(H+)
掌握单一溶液的pH计算。
认识溶液的酸碱性及pH。
掌握检验溶液pH的方法
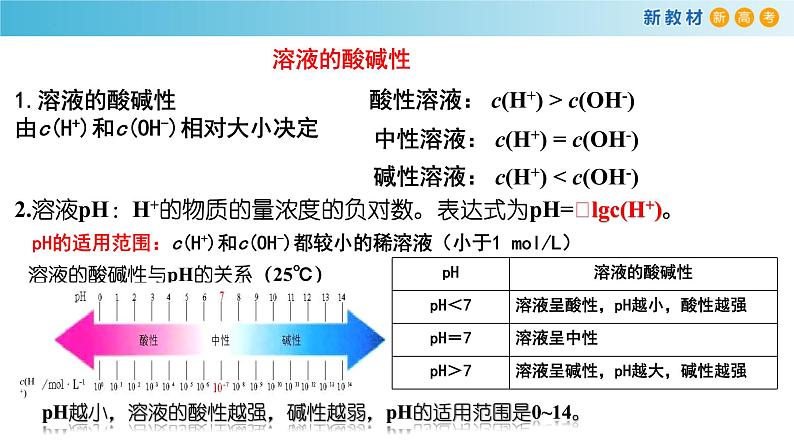
碱性溶液: c(H+) < c(OH-)
酸性溶液: c(H+) > c(OH-)
中性溶液: c(H+) = c(OH-)
1.溶液的酸碱性由c(H+)和c(OH-)相对大小决定
2.溶液pH:H+的物质的量浓度的负对数。表达式为pH=﹣lgc(H+)。
溶液的酸碱性与pH的关系(25℃)
pH越小,溶液的酸性越强,碱性越弱,pH的适用范围是0~14。
pH的适用范围:c(H+)和c(OH-)都较小的稀溶液(小于1 ml/L)
pH=7的溶液一定呈中性吗?
不一定。25 ℃时,pH=7的溶液呈中性,温度高于25 ℃时,由于水的电离程度增大,KW>1.0×10-14,此时pH=7呈碱性。判断溶液酸碱性的唯一标准是溶液中c(H+)和c(OH-)的相对大小,不应看pH的大小,因此只有满足c(H+)=c(OH-)的溶液才一定呈中性。
c(H+)=c(OH-)
c(H+)>c(OH-)
c(H+)<c(OH-)
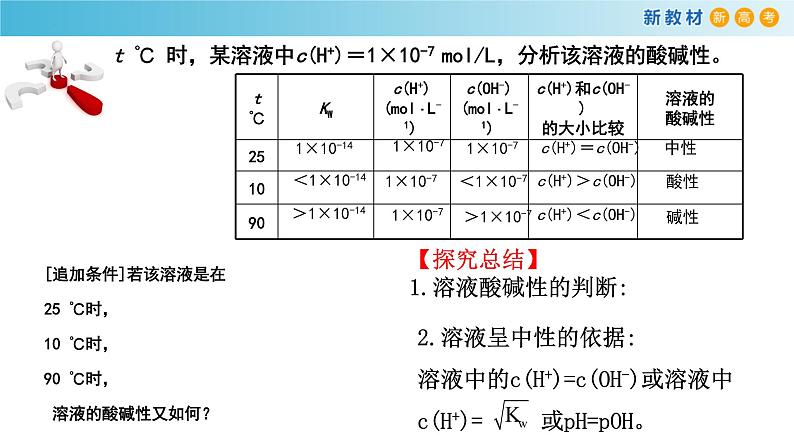
t ℃ 时,某溶液中c(H+)=1×10-7 ml/L,分析该溶液的酸碱性。
[追加条件]若该溶液是在25 ℃时,10 ℃时,90 ℃时, 溶液的酸碱性又如何?
【探究总结】1.溶液酸碱性的判断:
2.溶液呈中性的依据:溶液中的c(H+)=c(OH-)或溶液中c(H+)= 或pH=pOH。
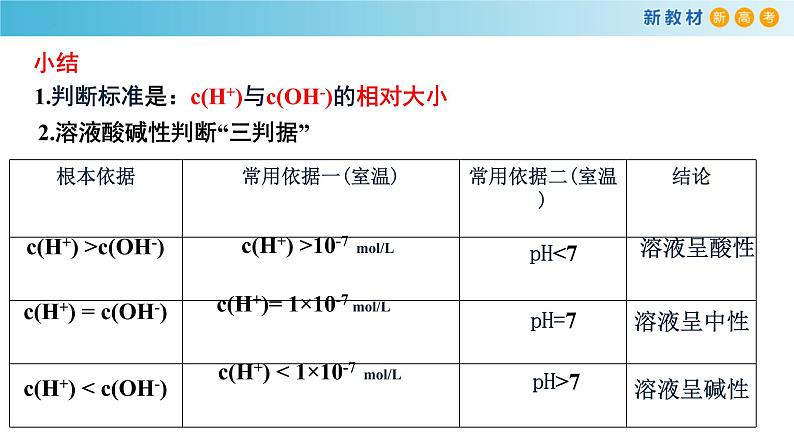
1.判断标准是:c(H+)与c(OH-)的相对大小
2.溶液酸碱性判断“三判据”
c(H+) >c(OH-)
c(H+) >10-7 ml/L
c(H+) = c(OH-)
c(H+) < c(OH-)
c(H+)= 1×10-7 ml/L
c(H+) < 1×10-7 ml/L
1、正误判断。(1) 25℃时,等物质的量浓度的酸、碱溶液中,水的电离程度相同 ( )(2) 25℃时,水在同pH的H2SO4溶液和CH3COOH溶液中的电离程度不同( )(3) 某温度下,某溶液中c(H+)= 1×10-7 ml/L,则该溶液一定呈中性( )(4) 常温下,某溶液由水电离出的c(OH-) =1×10-13 ml/L, 则该溶液可能呈酸性,也可能呈碱性( )
2.在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
(1)A点水的离子积为________, B点水的离子积为________。造成水的离子积变化的原因是________。
【解析】(1)A点,水的离子积Kw=c(H+)·c(OH-) =1×10-7 ml·L-1×1×10-7 ml·L-1=1×10-14;B点水的离子积Kw=c(H+)·c(OH-) =1×10-6ml·L-1×1×10-6ml·L-1=1×10-12;温度升高,促进了水的电离,c(H+)、c(OH-)均增大,水的离子积Kw增大。
【解题指南】解答本题需注意以下三点:(1) Kw=c(H+)·c(OH-),Kw的值与温度有关;(2)判断溶液的酸碱性要根据c(H+)和c(OH-)的相对大小;(3) 水电离产生的c(H+)= 水电离产生的c(OH-)。
1×10-14 1×10-12
水的电离要吸热,温度升高,水的电离程度增大,即离子积增大
【解析】(2) B点c(H+)=c(OH-),溶液为中性,盐酸显酸性,c(H+)>c(OH-),故体系不可能处于B点位置。(3) 100 ℃时,c(H+)=5×10-4 ml·L-1,c(OH-)=2×10-9ml·L-1,水电离产生的c(H+)=c(OH-)=2×10-9ml·L-1。
(2)100 ℃时,若向溶液中滴加盐酸,能否使体系处于B点位置?为什么? ____________________________________________。 (3)100 ℃时,若盐酸中c(H+)=5×10-4 ml·L-1,则由水电离产生的c(H+)=________。
否,在盐酸中c(H+)≠c(OH-),所以不可能处于B点
2×10-9 ml·L-1
【延伸探究】(1)25 ℃时的氢氧化钠溶液升温到100 ℃时,溶液的pH________(填“减小”“不变”或“增大”)。
提示:减小。25 ℃时pH=12的氢氧化钠溶液中,c(H+)=1×10-12ml·L-1,c(OH-)=1×10-2 ml·L-1,升温到100 ℃时,c(OH-)不变,升高温度时,Kw增大,但c(OH-)不变,故c(H+)增大,pH减小。
(2)若C点处于直线AB上,则C点溶液显________(填“酸性”“中性”“碱性” 或“不确定”)。 提示:中性。直线AB上的点均符合c(H+)=c(OH-),故为中性。
常用的pH值的测定方法有哪些? 如何用pH试纸测定溶液的pH值?
1.酸碱指示剂法(只能粗略测定溶液的pH范围,不能准确测定出pH的具体值)
二、溶液pH的测定方法
2.pH试纸法(定量粗略测量)
使用pH试纸不能用蒸馏水润湿。润湿后相当于稀释了溶液。
若是酸性溶液,则润湿后测得pH偏大;
若是碱性溶液,则润湿后测得pH偏小;
若是中性溶液,则无影响;
pH计又叫酸度计,可用来精密测量溶液的pH,其量程为0~14。
(1)pH=2的HCl溶液和pH=2的H2SO4溶液中c(H+)相等吗?它们混合后c(H+)如何变化?提示:只要两溶液中的pH相等,则它们的c(H+)一定相等;c(H+)相等的两强酸溶液混合后,c(H+)不会发生变化。
(2)在一定温度下,强碱的pH一定比弱碱的pH大吗?提示:不一定。pH的大小,取决于溶液中c(OH-)的大小。强碱溶液中c(OH-)不一定大,弱碱溶液中c(OH-)不一定小。
(3)常温常压时,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合后,滴入石蕊溶液,溶液的颜色如何变化?提示:溶液呈红色。pH=3的CH3COOH中已电离出的H+,与pH=11的NaOH电离出的OH-完全中和,因CH3COOH是弱酸,还会继续电离,即醋酸过量,反应后溶液显酸性。
(4)pH试纸使用前能否用蒸馏水润湿?若用湿润的pH试纸测量溶液的pH对结果有何影响?
提示:使用pH试纸不能用蒸馏水润湿,润湿后相当于稀释了溶液。若是酸性溶液,则润湿后测得pH偏大;若为碱性溶液,则润湿后测得pH偏小;若为中性溶液,则无影响。
(5)某同学用pH试纸测量新制氯水的pH为1.0,他的结论正确吗?提示:新制氯水具有漂白性,不能使用pH试纸进行测定,其结论错误。
(6)现欲测定100 ℃沸水的pH及酸碱性,甲同学使用pH试纸测定,请推测pH试纸呈什么颜色,溶液的酸碱性如何?提示:pH试纸呈黄色,沸水呈中性。
(7)同样测定100 ℃沸水的pH及酸碱性,乙同学选择了pH计,请分析pH计的读数等于7吗?水溶液还呈中性吗?提示:由于沸水电离程度增大,溶液中c(H+)增大,所以测定的pH<7,但由于c(H+)=c(OH-),所以溶液呈中性。
1、某溶液中由水电离产生的c(H+) H2O= 10-12 ml/L ,则该溶液呈酸性还是碱性?并求算该溶液中 c(H+)的可能值 ?
2、浓度均为0.1ml/L的下列溶液中由水电离出的c(H+) H2O大小关系为:①盐酸 ②醋酸溶液 ③硫酸溶液 ④氢氧化钠溶液
解答: c(H+) H2O= c(OH-) H2O= 10-12 ml/L若c(H+) aq= c(H+) H2O= 10-12 ml/L 则 c(OH-) aq= 10-2 ml/L 溶液显碱性若c(OH-) aq= c(OH-) H2O = 10-12 ml/L 则 c(H+) aq= 10-2 ml/L 溶液显酸性
② > ① =④ > ③
1.由水电离的c(H+)或c(OH-)的计算(25℃)
(1)中性溶液 c(H+)=c(OH-)=1.0× 10-7 ml/L。(2)溶质为酸的溶液H+来源于酸的电离和水的电离,而OH-只来源于水的电离。Kw=c(H+)•c(OH-) c(H+)=c酸(H+)+c水(H+)由于酸电离产生的H+抑制了水的电离,因此c水(H+)<1×10-7 ml/L,c水(H+)
(1)单一溶液pH的计算步骤:①强酸溶液(HnA) 设HnA的浓度为c ml/L,则c(H+)=nc ml/L, pH=﹣lgc(H+)=﹣lg(nc)
②强碱溶液(B(OH)n)设B(OH)n的浓度为c ml/L,则c(OH-)=nc ml/L, pH=﹣lgc(H+)=14+lg(nc)
例:试计算常温下的①0.005 ml/L H2SO4溶液;②0.005 ml/L Ba(OH)2 溶液的pH值
解、①∵ c (H+) =0.005×2=0.01
∴ pH = - lg 0.01 = 2
解∵ c(OH-) =0.005×2=0.01
∴ pH = - lg 10-12 = 12
或∵ c (OH-) =0.005×2=0.01
∴ pOH = - lg 0.01 = 2
pH= 14 - 2 = 12
1.在常温下,(1)c(H+)=1.0×10-3 ml·L-1的某溶液中,c(OH-)= 。pH为 。 (2)pH=4的盐酸中,c(H+)= , c(H+)水= 。 2.常温下,计算下列溶液的pH。(1)1.0×10-3 ml·L-1的盐酸的pH为 。 (2)5.0×10-4 ml·L-1的H2SO4溶液的pH为 。 (3)将8 g NaOH固体溶于水得到2 L溶液,其pH为 。 (4)a ml·L-1的Ba(OH)2溶液的pH为 。
1.0×10-11 ml·L-1 3
2)1.0×10-4 ml·L-1 1.0×10-10 ml·L-1
3.某温度下,纯水中c(H+)=1.0 ×10-6 ml/L。该温度时,0.01ml/L的HCl溶液中,pH=________; 0.01ml/L的NaOH溶液中,pH=________。
【提示】计算溶液的pH时,一定要注意溶液的温度。
鲁科版 (2019)选择性必修1第1节 水与水溶液教学课件ppt: 这是一份鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002587_t3/?tag_id=26" target="_blank">第1节 水与水溶液教学课件ppt</a>,共21页。PPT课件主要包含了0×10-12,0×10-11,溶液呈酸性,溶液呈碱性,1一般情况下,2室温下,常温下,pH=7,pH<7,pH>7等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第二单元 溶液的酸碱性试讲课课件ppt: 这是一份苏教版 (2019)选择性必修1第二单元 溶液的酸碱性试讲课课件ppt,共31页。PPT课件主要包含了课前导入,滴定管,小专题,滴定实验中的误差分析,误差分析的方法,作业布置,预习盐类水解等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第二单元 溶液的酸碱性评优课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第二单元 溶液的酸碱性评优课课件ppt,共40页。PPT课件主要包含了课前导入,cH+越大,pH越小,溶液酸碱性的判断,习题研究等内容,欢迎下载使用。













