

人教版高考一轮复习课时练习13元素周期表和元素周期律含答案
展开元素周期表和元素周期律
(建议用时:40分钟)
一、选择题(每小题只有一个选项符合题意)
1.下列说法中正确的是( )
A.所有非金属元素都分布在p区
B.最外层电子数为2的元素都分布在s区
C.元素周期表中第ⅢB族到第ⅡB族10个纵行的元素都是金属元素
D.同一主族元素从上到下,金属性呈周期性变化
C 解析:非金属元素中氢在s区,其余非金属元素均分布在p区,A项错误;最外层电子数为2的元素可能在s区(如Mg)、p区(如He)或d区(如Ti、Fe)等,B项错误;同主族元素从上到下,金属性逐渐增强,非金属性逐渐减弱,属递变性质而不是周期性变化,D项错误。
2.(2020·江苏高考)下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是( )
A.NaOH的碱性比Mg(OH)2的强
B.Cl2得到电子的能力比Br2的弱
C.原子半径r: r(Br)>r(Cl)>r(Mg)>r(Na)
D.原子的最外层电子数n: n(Na)<n(Mg)<n(Cl)<n(Br)
A 解析:同周期元素自左至右金属性减弱,所以金属性:Na>Mg,则碱性:NaOH>Mg(OH)2,故A正确;同主族元素自上而下非金属性减弱,所以非金属性:Cl>Br,所以Cl2得电子的能力比Br2强,故B错误;电子层数越多原子半径越大,电子层数相同,核电荷数越小原子半径越大,所以原子半径:r(Br)>r(Na)>r(Mg)>r(Cl),故C错误;Cl和Br为同主族元素,最外层电子数相等,故D错误。
3.周期表中27号元素钴的方格中注明“3d74s2”,由此可以推断( )
A.它位于周期表的第四周期第ⅡA族
B.它的基态核外电子排布式可简写为[Ar]4s2
C.Co2+的核外价层电子排布式为3d54s2
D.Co位于周期表中第9列
D 解析:“3d74s2”为Co的价层电子排布,其简写式中,也要注明3d轨道,B项错误;“7+2=9”,说明它位于周期表的第9列,位于第Ⅷ族,A项错误,D项正确;失电子时,应失去最外层的电子,即先失4s上的电子,Co2+的价层电子排布式为3d7,C项错误。
4.(2020·北京模拟)四种短周期元素在元素周期表中的位置如图所示,下列说法不正确的是( )
A.只有M可能是金属元素
B.四种元素中最活泼的非金属元素是Z
C.X、M的最高价氧化物对应水化物的酸性:X>M
D.单质沸点:M>Z
B 解析:根据元素在周期表中的位置可知,M、X、Y、Z分别为Al、Si、C、N或Si、P、N、O或P、S、O、F或S、Cl、F、Ne。X、Y、Z都是非金属元素,只有M可能为金属元素,故A正确;Z可能为Ne,Ne是稀有气体元素,不是四种元素中最活泼的非金属元素,故B错误;元素周期表中,同一周期主族元素从左向右元素非金属性逐渐增强,其最高价氧化物对应水化物的酸性逐渐增强,故C正确;四种情况下,M的单质为铝、硅、白磷(或红磷等)、硫,常温下均为固体,Z的单质为N2、O2(O3)、F2、Ne,常温下均为气体,则M形成单质的沸点大于Z形成单质的沸点,故D正确。
5.某元素的电离能如下(单位:kJ/mol),此元素位于元素周期表的族数是
( )
I1 | I2 | I3 | I4 | I5 | I6 | I7 |
14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
A.ⅡA B.ⅢA
C.ⅤA D.ⅣA
C 解析:在主族元素中,当原子失去电子达到稳定结构后,如果再失去电子,则其电离能会突然增大很多,主族元素最外层电子数与其族序数相等,根据表中数据知,第五电离能和第六电离能相差较大,说明该原子核外最外层有5个电子,则为第ⅤA族元素。
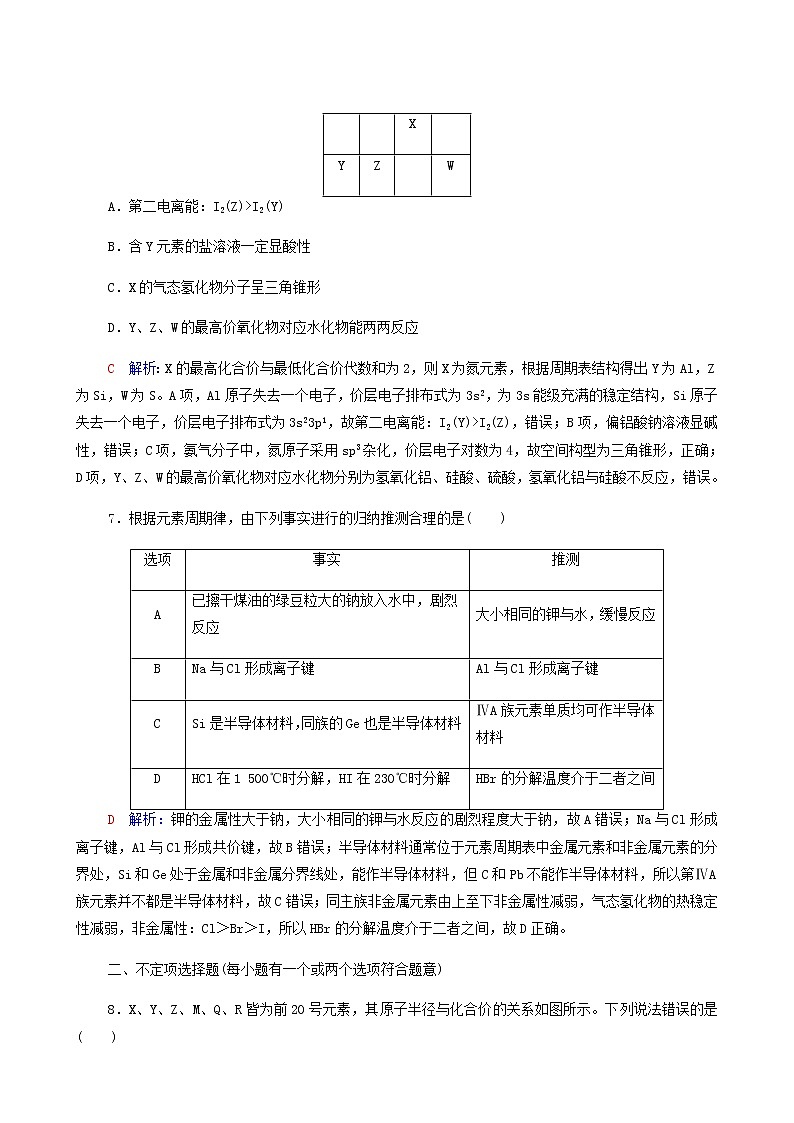
6.下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中X的最高化合价与最低化合价代数和为2。下列判断正确的是( )
|
| X |
|
Y | Z |
| W |
A.第二电离能:I2(Z)>I2(Y)
B.含Y元素的盐溶液一定显酸性
C.X的气态氢化物分子呈三角锥形
D.Y、Z、W的最高价氧化物对应水化物能两两反应
C 解析:X的最高化合价与最低化合价代数和为2,则X为氮元素,根据周期表结构得出Y为Al,Z为Si,W为S。A项,Al原子失去一个电子,价层电子排布式为3s2,为3s能级充满的稳定结构,Si原子失去一个电子,价层电子排布式为3s23p1,故第二电离能:I2(Y)>I2(Z),错误;B项,偏铝酸钠溶液显碱性,错误;C项,氨气分子中,氮原子采用sp3杂化,价层电子对数为4,故空间构型为三角锥形,正确;D项,Y、Z、W的最高价氧化物对应水化物分别为氢氧化铝、硅酸、硫酸,氢氧化铝与硅酸不反应,错误。
7.根据元素周期律,由下列事实进行的归纳推测合理的是( )
选项 | 事实 | 推测 |
A | 已擦干煤油的绿豆粒大的钠放入水中,剧烈反应 | 大小相同的钾与水,缓慢反应 |
B | Na与Cl形成离子键 | Al与Cl形成离子键 |
C | Si是半导体材料,同族的Ge也是半导体材料 | ⅣA族元素单质均可作半导体材料 |
D | HCl在1 500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
D 解析:钾的金属性大于钠,大小相同的钾与水反应的剧烈程度大于钠,故A错误;Na与Cl形成离子键,Al与Cl形成共价键,故B错误;半导体材料通常位于元素周期表中金属元素和非金属元素的分界处,Si和Ge处于金属和非金属分界线处,能作半导体材料,但C和Pb不能作半导体材料,所以第ⅣA族元素并不都是半导体材料,故C错误;同主族非金属元素由上至下非金属性减弱,气态氢化物的热稳定性减弱,非金属性:Cl>Br>I,所以HBr的分解温度介于二者之间,故D正确。
二、不定项选择题(每小题有一个或两个选项符合题意)
8.X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是( )
A.QX中存在离子键和共价键
B.简单离子半径:r(M-)>r(Q+)>r(R2+)
C.X、Y、Z三种元素组成的化合物可能是盐或碱
D.ZM3各原子最外层电子数均满足8电子结构
AB 解析:X、Y、Z、M、Q、R皆为前20号元素,由其原子半径与主要化合价的关系图可知,M的最高正价为+7,则M为Cl;结合原子序数、原子半径、化合价可知,Q为Na、R为Ca;Y只有-2价,Y为O元素;Z有+5、-3价,且原子半径大于Y(O)小于M(Cl),则Z为N;X的原子半径最小,其化合价为+1、-1价,则X为H。QX为NaH,NaH中只存在离子键,故A错误;Ca2+比Na+多一个电子层,则Ca2+的离子半径较大,则离子半径:r(M-)>r(R2+)>r(Q+),故B错误;H、O、N三种元素可组成碱,如NH3·H2O,也可以组成盐,如NH4NO3,故C正确;ZM3为NCl3,NCl3中N形成3个共价键,Cl形成1个共价键,均满足8电子稳定结构,故D正确。
9.科学家合成出了一种高效电解质(如图所示),其中X、Y、Z、W、Q均为短周期元素,且原子序数依次增大,Z和Q位于同一主族,Y和W的原子序数之和与Q相等。下列说法正确的是( )
A.Q的氧化物对应水化物不一定为强酸
B.该电解质阴离子中所有原子均满足8电子稳定结构
C.元素非金属性强弱的顺序为W>Y>Z
D.X和Z形成的化合物溶于水呈碱性
AD 解析:X、Y、Z、W、Q均为短周期元素,且原子序数依次增大,Z和Q位于同一主族,Q形成6个共价键、Z形成2个共价键,二者位于第ⅥA族,则Z为O,Q为S元素;X形成+1价阳离子,其原子序数小于O,又由于该物质为高效电解质,则X为Li;W形成1个共价键,其原子序数小于S,则W为F;Y和W的原子序数之和与Q相等,Y的原子序数为16-9=7,则Y为N元素。S的氧化物对应水化物不一定为强酸,如亚硫酸为弱酸,故A正确;该化合物的阴离子中,S最外层电子数为6+6=12,不满足8电子稳定结构,故B错误;同一周期元素从左向右非金属性逐渐减弱,则非金属性:F>O>N,即W>Z>Y,故C错误;X和Z形成的化合物为Li2O,Li2O为碱性氧化物,溶于水生成LiOH,其溶液呈碱性,故D正确。
10.(2021·德州模拟)X、Y、Z、W为短周期主族元素。X、Z、W形成的一种离子常用于检验Fe3+,X、Y形成的化合物YX3常用作汽车安全气囊的气体发生剂,W的单质在加热条件下可与X、Z的最高价含氧酸反应。下列叙述正确的是( )
A.原子半径:Z>Y>W>X
B.简单氢化物稳定性:Z>X
C.W形成的单质一定为共价晶体
D.ZO2和ZO3中Z原子的杂化方式相同
D 解析:X、Y、Z、W为短周期主族元素。X、Z、W形成的一种离子常用于检验Fe3+,该离子为SCN-,则X、Z、W为C、N、S元素;W的单质在加热条件下可与X、Z的最高价含氧酸反应,则W为C元素,X、Z为N、S中的一种;X、Y形成的化合物YX3常用作汽车安全气囊的气体发生剂,该化合物应该为NaN3,则X为N元素,Y为Na,Z为S。同一周期元素从左向右原子半径逐渐减小,同一主族元素从上到下原子半径逐渐增大,则原子半径:Y>Z>W>X,故A错误;非金属性越强,简单氢化物的稳定性越强,非金属性:S<N,则简单氢化物稳定性:Z<X,故B错误;C形成的单质中,金刚石为共价晶体,而石墨、C60不属于共价晶体,故C错误;SO3 分子中价层电子对个数=σ键个数+孤电子对个数=3+(6-3×2)=3,S原子采用sp2杂化;SO2的价层电子对个数=2+(6-2×2)=3,S原子采取sp2杂化,S原子的杂化方式相同,故D正确。
三、非选择题
11.(1)(2019·全国卷Ⅰ)下列状态的镁中,电离最外层一个电子所需能量最大的是________(填标号)。
A.[Ne] B.[Ne]
C.[Ne] D.[Ne]
(2)(2018·全国卷Ⅲ)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能 I1(Zn)________(填“大于”或“小于”)I1(Cu)。原因是____________________________________________________________________。
(3)(2020·天津高考)C、N、O元素的第一电离能由大到小的顺序为________________。
(4)(2020·全国卷Ⅱ)CaTiO3的组成元素的电负性大小顺序是____________。
解析:(1)A.[Ne]3s1属于基态的Mg+,由于Mg的第二电离能高于其第一电离能,故其再失去一个电子所需能量较高;B.[Ne]3s2属于基态Mg原子,其失去一个电子变为基态Mg+;C.[Ne]3s13p1属于激发态Mg原子,其失去一个电子所需能量低于基态Mg原子;D.[Ne]3p1属于激发态Mg+,其失去一个电子所需能量低于基态Mg+,综上所述,电离最外层一个电子所需能量最大的是[Ne]3s1。(2)Cu原子的价层电子排布式为 3d104s1,4s能级处于半充满状态,而Zn原子的价层电子排布式为3d104s2,4s能级处于全充满状态,Zn原子更难失去电子,第一电离能更大。(3)同周期元素,从左到右,第一电离能呈增大的趋势,但第ⅡA族大于第ⅢA族,第ⅤA族大于第ⅥA族,因此C、N、O元素的第一电离能由大到小的顺序为N>O>C。(4)同周期从左到右元素的电负性逐渐增大(稀有气体元素除外)。
答案:(1)A (2)大于 Zn核外电子排布为全满稳定结构,较难失电子 (3)N>O>C (4)O>Ti>Ca
12.根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)A元素次外层电子数是最外层电子数的,其轨道表示式是____________________________________________________________________。
(2)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是________,在元素周期表中的位置是___________________________。
(3)C元素基态原子的轨道表示式是下图中的________(填序号),另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合________(填字母)。
①
②
A.能量最低原理
B.泡利原理
C.洪特规则
(4)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫作第一电离能(设为E)。如图所示:
①同周期内,随着原子序数的增大,E值变化的总趋势是________;
②根据图中提供的信息,可推断出E氧________(填“>”“<”或“=”,下同)E氟;
③根据第一电离能的含义和元素周期律,可推断出E镁________E钙。
解析:(1)次外层电子数是最外层电子数的的元素是氖。(2)1~36号元素中,原子核外电子排布中未成对电子数最多的元素是铬,共有6个未成对电子。(3)由该基态原子的轨道表示式中的电子数可知,C元素是硅,根据洪特规则,当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同,故硅元素基态原子的轨道表示式为②。(4)同周期内,随着原子序数的增大,第一电离能变化的总趋势是增大;同主族内,随着电子层数的增多,第一电离能变化的总趋势是减小。
答案:(1)
(2)铬 第四周期第ⅥB族
(3)② C (4)①增大 ②< ③>
人教版高考化学一轮复习课时练13原子结构元素周期表含答案: 这是一份人教版高考化学一轮复习课时练13原子结构元素周期表含答案,共7页。试卷主要包含了X、Y、Z和R代表4种元素等内容,欢迎下载使用。
人教版高考化学一轮复习课时作业15元素周期表和元素周期律含答案: 这是一份人教版高考化学一轮复习课时作业15元素周期表和元素周期律含答案
鲁科版高考化学一轮复习课时练17元素周期律和元素周期表含答案: 这是一份鲁科版高考化学一轮复习课时练17元素周期律和元素周期表含答案












