





高中化学鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序课文ppt课件
展开1.通过对金属钠的性质研究,掌握研究物质性质的基本方法:观察、实验、比较、分类、假说、模型。2.通过钠与水、与氧气的反应实验,认识钠是一种非常活泼的金属单质,了解钠的物理性质、主要化学性质。3.通过对钠与氧气反应的实验探究,体会实验过程中控制实验条件的重要性。4.通过对过氧化钠的化学性质的学习,了解其在生产、生活中的应用。
学习任务1 研究物质性质的方法及运用——金属钠的性质
1.研究物质的性质,常常运用 、 、分类、比较等方法(1)观察法。①定义:有计划、有目的地用感官考察研究对象的方法。
(2)实验法。①目的:通过实验来验证对物质性质的预测或探究 。②过程。
③注意的问题:在进行实验时,要注意控制 、 、溶液的浓度等条件。(3)分类和比较。①分类:可通过分类的方法总结各类物质的 性质,根据 .对物质及其变化进行预测。②比较:可运用比较的方法,认识各类物质性质之间的 与 。(4)假说和模型。①提出假说可以对有关现象或规律的本质以及未知物质或现象进行推测性说明。②构建模型可以对物质或物质的变化进行简化模拟。
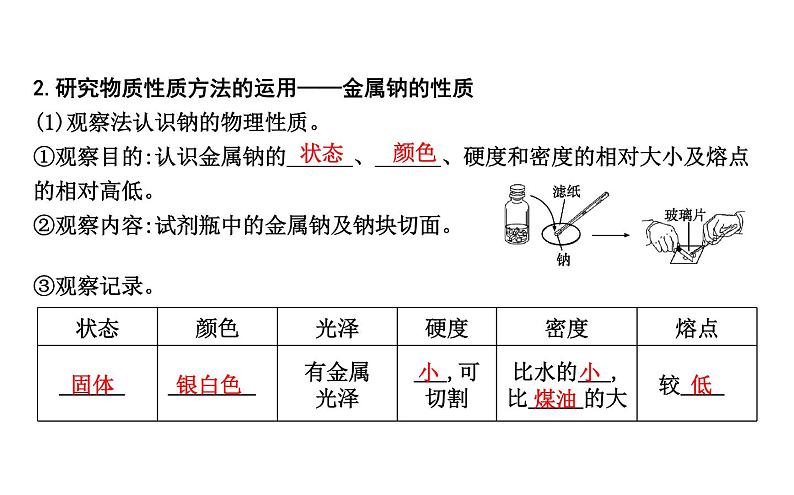
2.研究物质性质方法的运用——金属钠的性质(1)观察法认识钠的物理性质。①观察目的:认识金属钠的 、 、硬度和密度的相对大小及熔点的相对高低。②观察内容:试剂瓶中的金属钠及钠块切面。
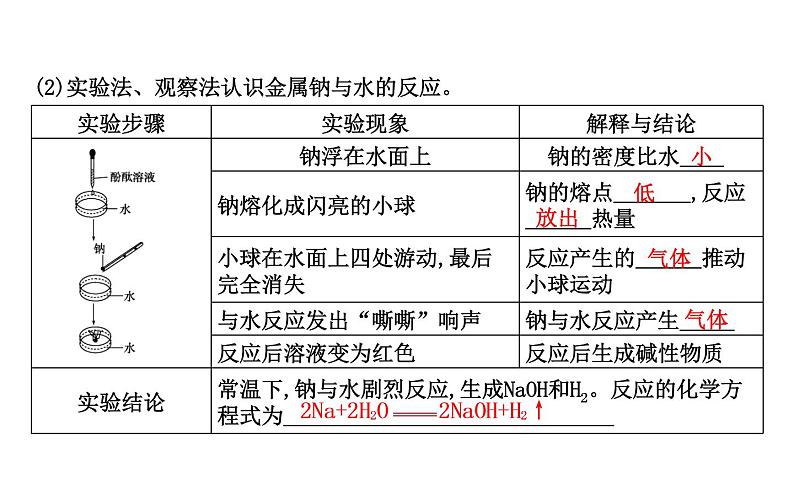
(2)实验法、观察法认识金属钠与水的反应。
(3)实验法、观察法、比较法认识钠与氧气的反应。
3.钠的用途(1)工业上用来冶炼金属,如钛、锆、铌、钽等。(2)Na—K合金在常温下呈 态,可用作原子反应堆的导热剂。(3)制作 。
探究1 钠与水、酸、盐溶液的反应
为了增强实验的安全性和效果,某学习小组的同学设计了一套如图所示的实验装置。实验如下:
(1)实验用品:U形玻璃管、分液漏斗、大头针、医用针头。(2)实验方法。①如图组装实验仪器,医用针头朝上插在胶塞上,顶端用橡胶块封闭。②将大头针穿透橡胶塞,顶端插上擦干煤油的钠块。
(3)实验操作。①通过分液漏斗向U形管内注入加有酚酞的蒸馏水到接近管口。②迅速塞上橡胶塞,拨出大头针,使钠块落入水中。
问题1:你能看到哪些明显的现象?能得出什么结论?
提示:(1)钠与水剧烈反应,快速游动,钠块逐渐变小,管壁发热。表明反应放热。(2)右侧管中水面逐渐下降,表明有难溶于水的气体生成。(3)瓶中水的颜色从无色变成粉红色,证明有碱性物质生成。
问题2:待反应结束,拔掉针头的橡胶块,用燃着的火柴靠近针头,会看到什么现象?
提示:有蓝色的火焰。表明生成了可燃性气体。
问题3:如将H2O改为稀硫酸,现象有何不同?
提示:Na与稀硫酸反应更为剧烈。
问题4:如将H2O改为CuSO4溶液,现象有何不同?
提示:除问题1的现象外,试管中还会出现蓝色沉淀。
钠与酸、碱、盐溶液反应
2.钠与碱溶液的反应实质是钠与水的反应,要注意溶质是否析出(氢氧化钙的溶解度随温度升高而降低)。3.钠与盐溶液的反应(1)钠投入盐溶液中,先与水反应,生成NaOH。(2)如果NaOH能与该盐发生复分解反应,则继续发生反应。(3)当NaOH与盐不发生复分解反应时,要考虑溶液是否饱和以及溶解度,考虑溶质的析出。
探究2 金属钠与氧气的反应——钠的保存
钠作为一种非常活泼的金属单质,其发现和应用都比较晚。金属钠的活泼性,使得其储存成为一个必须要认真考虑的问题。工业上通常是把钠浸放于液体石蜡、矿物油和苯的同系物中密封保存,而大量钠则是储存在铁桶中,然后充入氩气密封保存。我们实验室少量钠可以浸泡在煤油中保存,但金属钠会与煤油中的有机酸等物质反应生成有机酸钠(呈黄色)附着在钠表面。
问题5:从上述金属钠的保存措施中,你能得到什么样的启发?实验室把其保存在煤油中的原因是什么?
提示:因为钠易与空气中的氧气发生反应,所以金属钠保存必须隔绝空气;因为钠不与煤油反应,且钠的密度比煤油的大,所以可以把钠保存在煤油中。
问题6:CCl4是一种有机溶剂,密度为1.595 g·cm-3,当实验室没有煤油时,能否把金属钠放在CCl4中?
提示:不可以。把金属钠放在煤油中,一方面是为了隔绝空气,另一方面是因为煤油的密度小于钠的密度。而CCl4的密度(1.595 g·cm-3)大于钠的密度(0.97 g·cm-3),金属钠会浮在液体表面,达不到隔离空气的目的。
问题7:金属钠与氧气反应,能确定一定生成过氧化钠吗?
提示:不确定。金属钠与氧气反应,其产物与反应条件有关,如果是常温下反应将生成氧化钠,而如果是在加热条件下反应,将会生成过氧化钠。
金属钠在空气中长期露置时发生的变化
(2)发生主要变化的化学方程式。
题点一 钠与水及酸、碱、盐溶液的反应
1.将一块绿豆粒大小的钠投入如图所示的烧杯中,下列有关说法正确的是( )A.钠块在煤油中游动,并放出气体B.钠块熔化,只在水层游动,溶液变为红色,一段时间后煤油燃烧C.在CCl4和水层交界处上下跳动,钠块熔化,溶液变红D.在水层和煤油层交界处上下跳动,钠块熔化,溶液变红
解析:钠的密度大于煤油的密度,小于水和四氯化碳的密度,钠与水反应生成氢气和氢氧化钠,放出大量的热,所以将绿豆粒大小的钠投入题图所示的烧杯中,钠块会熔化,产生的氢气使钠块四处游动并上下跳动,生成的NaOH使溶液变红,故选D。
2.(2022·北京四中期中)向分别盛有100 mL水、100 mL稀盐酸、100 mL稀NaOH溶液的X、Y、Z三个烧杯中各投入0.5 g Na。下列有关说法正确的是( )
3.(2021·福建龙岩期中)将金属钠放入盛有下列溶液的小烧杯中,既有气体产生,又有白色沉淀产生的是(不考虑溶液温度变化)( )①MgSO4溶液 ②稀Na2SO4溶液 ③饱和澄清石灰水 ④CuSO4溶液 ⑤饱和NaCl溶液 ⑥FeCl3溶液A.①④⑥B.②④⑤C.③④⑥D.①③⑤
解析:钠投入硫酸镁溶液中,钠和水反应生成氢氧化钠和氢气,氢氧化钠与硫酸镁反应生成硫酸钠和氢氧化镁白色沉淀,故①符合题意;钠投入稀硫酸钠溶液中,钠与水反应生成氢氧化钠和氢气,没有沉淀生成,故②不符合题意;钠投入饱和澄清石灰水中,钠与水反应生成氢氧化钠和氢气,反应消耗水,故有氢氧化钙白色固体析出,故③符合题意;钠投入硫酸铜溶液中,钠和水反应生成氢氧化钠和氢气,氢氧化钠与硫酸铜反应生成硫酸钠和氢氧化铜蓝色沉淀,不是白色沉淀,故④不符合题意;钠投入饱和氯化钠溶液中,钠与水反应生成氢氧化钠和氢气,反应消耗水,饱和氯化钠溶液中析出白色氯化钠固体,故⑤符合题意;钠投入FeCl3溶液中,钠和水反应生成氢氧化钠和氢气,氢氧化钠与氯化铁反应生成氯化钠和氢氧化铁红褐色沉淀,不是白色沉淀,故⑥不符合题意。
4.下列关于钠的叙述中,不正确的是( )A.钠燃烧时发出黄色的火焰B.钠燃烧生成氧化钠C.钠受热先熔化而后才会燃烧D.钠燃烧后生成淡黄色固体
题点二 钠与氧气的反应及钠的保存
解析:钠在燃烧时生成淡黄色的过氧化钠,B错误。
5.(2021·湖南长沙期中)下列有关钠的取用方法、保存及存在形式的描述正确的是( )A.实验中,取用少量的金属钠可用手直接取B.实验室中,钠通常保存在煤油或石蜡油中C.实验后剩余的金属钠要丢入垃圾桶,不能放回原试剂瓶D.钠在自然界中主要以化合态形式存在,少量以游离态形式存在
解析:实验中,取用少量的金属钠需用镊子,A错误;钠易与空气中水蒸气、氧气等反应,不与煤油或石蜡油反应,且密度比煤油或石蜡油的大,因此实验室中,钠通常保存在煤油或石蜡油中,B正确;因为钠易与水发生反应产生氢气,有危险性,所以实验后剩余的金属钠需放回原试剂瓶中,C错误;钠的性质较活泼,在自然界中以化合态形式存在,没有游离态,D错误。
学习任务2 氧化钠、过氧化钠的性质
氧化钠和过氧化钠的性质比较及用途
在元旦晚会上,某同学给大家展示了一个魔术:吹气生火。他通过一个细长的玻璃管向放在石棉网上的一团棉花持续地、慢慢地吹气,很快棉花团剧烈燃烧起来。这引起了同学们的好奇,我们呼出的气体中有氮气、氧气、二氧化碳、水蒸气,怎么会让棉花燃烧起来呢?
问题1:从你已有的科学知识分析,棉花燃烧的必要条件是什么?
提示:一是有氧气供给,二是温度达到着火点。
问题2:随后这位同学揭开了谜底,棉花中包着过氧化钠。结合上述问题,你能得出什么结论?
提示:过氧化钠与二氧化碳、水蒸气反应能产生O2,该反应是放热反应。
问题3:根据过氧化钠在该实验中表现出的性质,判断其用途。
问题4:由此我们得到启发,当金属钠着火时,我们需要怎么做?
提示:不能用水灭火,不能用二氧化碳灭火器灭火,应该用沙子盖灭。
过氧化钠的特殊性1.Na2O2中的氧元素是-1价,类似于H2O2,所以Na2O2也具有杀菌性、漂白性。
3.Na2O2与CO2、H2O反应的规律
③如果物质的分子组成符合(CO)m·(H2)n,W g该物质在O2中完全燃烧,将其产物通过足量的Na2O2后,固体增重必为W g。(2)反应先后顺序关系。当CO2和H2O(气体)的混合气体与Na2O2反应时,由于Na2O2与H2O反应生成的NaOH能与CO2反应生成Na2CO3,所以可以视为Na2O2先与CO2反应,待CO2反应完全后,再与H2O(气体)反应。
1.(2021·吉林延边期中)有关Na2O2的叙述不正确的是( )A.是淡黄色固体B.可以做供氧剂C.应密封保存D.氧元素的化合价为-2价
解析:Na2O2是淡黄色固体,故A正确;Na2O2与水或二氧化碳反应释放出氧气,可以做供氧剂,故B正确;Na2O2易与水和二氧化碳反应,故需要密封保存,故C正确;根据化合物元素正、负化合价代数和为0,可得Na2O2中氧元素的化合价为-1价,故D错误。
2.(2021·黑龙江齐齐哈尔期中)下列叙述不正确的是( )A.Na2O是白色固体,Na2O2是淡黄色固体,两者都能与水反应生成NaOHB.Na和O2在常温下反应生成Na2O,在加热时反应生成Na2O2C.Na2O与CO2发生反应生成Na2CO3,Na2O2与CO2发生反应生成Na2CO3和O2D.将金属钠投入水中,生成氢氧化钠和O2
解析:Na2O2是淡黄色固体,与水反应生成氢氧化钠和氧气,Na2O是白色固体,与水反应生成NaOH,A正确;Na和O2在加热时反应生成Na2O2,在常温下反应生成Na2O,B正确;Na2O与CO2发生反应生成Na2CO3,Na2O2与CO2发生反应生成Na2CO3和O2,C正确;将金属钠投入水中,生成氢氧化钠和H2,D错误。
3.(2022·河北石家庄期中)CO和H2的混合气体4 g在足量的氧气中燃烧后,在150 ℃时将混合气体通过足量的Na2O2后,Na2O2增重的质量为( )A.2 g B.4 g C.8 g D.无法计算
1.误认为观察法就是用眼睛去看,其实化学上观察法不但包括用感官去直接感知,也包括用仪器去间接观察。2.实验取用后剩余的金属钠必须放回原试剂瓶,因为金属钠易与氧气、水反应。3.误认为钠与盐溶液的反应是钠与盐的置换反应。其实不然,由于钠太活泼,钠会先和水反应。4.误认为钠与氧气反应是因为氧气的量不同而生成氧化钠或过氧化钠。其实不然,只与反应条件有关。
回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法的是 (填字母)。 A.放在棕色瓶中 B.放在细沙中C.放在水中 D.放在煤油中
解析:(1)钠是活泼的金属,易和水、氧气反应,钠的密度大于煤油的密度,所以金属钠放在煤油中保存。
(2)将一小块金属钠放在干燥的坩埚中,用酒精灯加热充分反应,发生反应的化学方程式为 ,生成物的颜色为 。
(3)将Na、Na2O、Na2O2、NaOH久置于空气中,最终都是变为 (填化学式)。将少量金属钠投入硫酸铜溶液中,发生反应的化学方程式为 。
(4)过氧化钠中阴、阳离子个数比为 ,过氧化钠常用于呼吸面具和潜水艇氧气的来源,其原理为 (用化学方程式表示)。
化学必修 第一册第2节 研究物质性质的方法和程序图片课件ppt: 这是一份化学必修 第一册第2节 研究物质性质的方法和程序图片课件ppt,共52页。PPT课件主要包含了分点突破1,分点突破2,金属钠的性质,分点突破3,钠的氧化物等内容,欢迎下载使用。
鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序课文配套课件ppt: 这是一份鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序课文配套课件ppt,共60页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序教课内容课件ppt: 这是一份高中化学鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序教课内容课件ppt,共52页。PPT课件主要包含了分点突破1,分点突破2,金属钠的性质,分点突破3,钠的氧化物等内容,欢迎下载使用。













