
高中化学鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量教课课件ppt
展开1.通过对物质的量、阿伏加德罗常数、摩尔质量概念的学习,体会定量研究对化学科学的重要作用。2.通过物质的量与微粒数、物质质量之间的关系的认识,建立不可数微粒与可称量质量之间的联系。3.通过物质的量、摩尔质量概念的认知,能完成物质的量、微粒数、物质质量间的简单换算。
学习任务1 物质的量的单位——摩尔
1.物质的量(1)意义:一种可以把物质的 、 等宏观量与 、 或 等微观粒子的数量联系起来的物理量。(2)符号: 。2.物质的量的单位——摩尔(1)定义:国际计量大会规定1 ml包含 个基本单元。(2)符号: 。
(3)计量对象: 、 或 等微观粒子或 。
6.022 140 76×1023
6.02214076 ×1023ml-1
6.02 ×1023ml-1
4.物质的量(n)、阿伏加德罗常数(NA)与微粒数(N)的关系: 。
物质的量这一物理量说起来很陌生,其实在我们的生活中,可能已经在悄悄地使用了。我们在描述物体数量的时候常常不用物体最基本的单元“个”表示,而是以特定数目的集合体作为一个描述对象。如三箱可乐(基本不会说72罐可乐)、10双筷子(不说20支筷子),这里我们就把24罐可乐、两只筷子分别作为一个计量和描述的单位。同理,我们在描述微观粒子数量的时候,也可以把一定量的微粒数目(比如6.02×1023个)作为一个集合体,把这个特定的“微粒集合体”作为描述的基准,然后将任意物质所含的微粒数目均表示为这个“微粒集合体”的多少倍,这样就方便得多了。
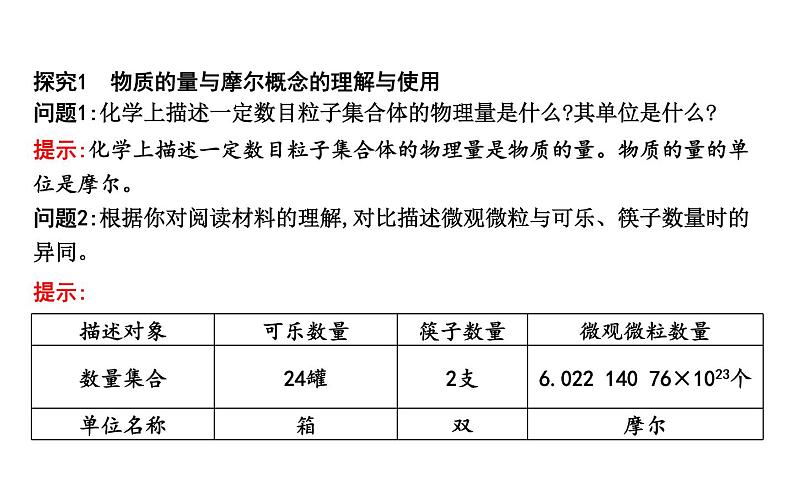
问题1:化学上描述一定数目粒子集合体的物理量是什么?其单位是什么?
提示:化学上描述一定数目粒子集合体的物理量是物质的量。物质的量的单位是摩尔。
问题2:根据你对阅读材料的理解,对比描述微观微粒与可乐、筷子数量时的异同。
探究1 物质的量与摩尔概念的理解与使用
问题3:1 ml小麦和1 ml氧的说法正确吗?为什么?
提示:上述说法均不正确。物质的量用来描述微观微粒数量时,其单位——摩尔是一个数量巨大的微粒集合,只适用于微观粒子,不能用来描述宏观物质,故1 ml小麦的说法不正确;在使用摩尔描述微观微粒时必须指明微粒的种类,要表达清楚是1 ml氧原子,还是1 ml氧分子。
问题4:0.5 ml CO2中含有的CO2分子数与原子数各为多少?
提示:分子数为0.5 ml×6.02×1023 ml-1=3.01×1023;原子总数为3.01×1023×3=9.03×1023。
探究2 物质的量n与微粒数N的关系
问题5:一个500人的企业搞年庆,人均两罐可乐。需要买多少箱呢(一箱有24罐可乐)?
问题6:微观微粒数N、微观微粒物质的量n、NA分别与问题5中的哪些数据相似?
提示:微观微粒数相当于1 000罐;微观微粒物质的量相当于42箱;NA相当于24。
问题7:微观微粒数N、微观微粒物质的量n、NA之间的关系是什么?
(1)NA是一个常数,所以物质的量n与微粒数目N之间可随意换算。(2)NA近似表示为6.02×1023 ml-1,在表达微粒数目时可用nNA表示。
3.国际单位制的7个基本物理量及其单位
题点一 基本概念的理解
1.(2021·河南郑州月考)下列关于物质的量的说法中正确的是( )A.摩尔是国际单位制中的一个物理量B.物质的量是指物质中所含微粒的个数C.物质的量就是物质的质量D.物质的量只能计量微观粒子
解析:摩尔是物质的量的单位,不是一个物理量,A错误;物质的量是用阿伏加德罗常数作为标准来衡量微粒集体所含微粒数多少的物理量,B错误;物质的量不是物质的质量,C错误;物质的量是国际单位制中的一个物理量,只能用于计量微观粒子,D正确。
2.(2021·北京海淀期中)下列关于“摩尔”的说法正确的是( )A.摩尔是一个物理量B.摩尔是表示物质的量C.摩尔是物质的量的单位D.摩尔是表示物质数量的单位
解析:摩尔不是物理量,它是物理量——物质的量的单位,故A错误;摩尔是物质的量的单位,故B错误;摩尔是物质的量的单位,故C正确;摩尔是物质的量的单位,不是表示物质的数量的单位,故D错误。
3.下列关于阿伏加德罗常数的说法错误的是( )×1023就是阿伏加德罗常数 kg 12C含有的碳原子数就是阿伏加德罗常数C.含有阿伏加德罗常数个粒子的物质的量是1 mlD.1 ml氨气所含的原子数约为2.408×1024
解析:阿伏加德罗常数是指0.012 kg 12C含有的碳原子数,单位是ml-1,其近似值为6.02×1023 ml-1,故A错误,根据阿伏加德罗常数的定义知,0.012 kg 12C含有的碳原子数就是阿伏加德罗常数,故B正确;阿伏加德罗常数的定义,含有阿伏加德罗常数个粒子的物质的量是1 ml,故C正确;1 ml氨气的原子个数约为1 ml×4×6.02×1023 ml-1=2.408×1024,故D正确。
4.(2022·河北廊坊月考)下列各物质所含原子个数按由大到小的顺序排列的是( )①0.5 ml NH3 ②1 ml He ③0.5 ml H2O ④0.2 ml H3PO4A.②③④① B.①④③② C.④③②① D.①④②③
解析:①1个氨气分子中含有四个原子,则0.5 ml NH3中含有原子的物质的量为0.5 ml×4=2 ml;②1个He分子中只有一个原子,则1 ml He中含有原子的物质的量为1 ml×1=1 ml;③一个水分子中含有三个原子,则0.5 ml H2O中含有原子的物质的量为0.5 ml×3=1.5 ml;④一个磷酸分子中含有8个原子,则0.2 ml H3PO4中含有原子的物质的量为0.2 ml×8=1.6 ml;原子物质的量越大,则原子数越多,因此所含原子个数按由大到小的顺序为①④③②。
5.(2021·黑龙江大庆期中)物质的量相等的一氧化碳和二氧化碳比较,下列有关叙述中正确的是( )①所含的分子数目之比为1∶1②所含的氧原子数目之比为1∶2③所含的原子总数目之比为2∶3④所含的质子数目之比为7∶11⑤所含的电子数目之比为7∶11A.①② B.②③C.④⑤ D.①②③④⑤
解析:根据N=n·NA可知,当气体的物质的量相等时,两者含有的分子数相等,故它们所含的分子数目之比为1∶1,①正确;由于1个CO分子中含有1个O原子,1个CO2分子中含有2个O原子,两者的物质的量相等,它们的分子数相等,则它们所含的氧原子数目之比为1∶2,②正确;两者分子数相等,则所含的原子总数目之比为2∶3,③正确;一个CO分子中含有6+8=14(个)质子,一个CO2分子中含有6+8×2=22(个)质子,所以两者所含质子数目之比为14∶22=7∶11,④正确;1个CO分子中含有14个电子,1个CO2分子中含有22个电子,两者分子数相同,因此它们所含的电子数目之比为14∶22=7∶11,⑤正确;所以①②③④⑤都正确,故D符合题意。
6.a ml H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为( )
1.摩尔质量(1)定义: 的物质所具有的质量。(2)符号为 。(3)常用单位为 或 。(4)数值:摩尔质量以g·ml-1为单位时,在数值上等于该粒子的 或 。2.物质的量、质量和摩尔质量之间的关系: 。
在生活、科研中经常要测量一些质量很小的颗粒的质量。在农业育种领域,千粒重就被作为衡量一个作物品种是否优良的重要指标,也常常用于农作物产量的一个预测指标。那么这个指标的意义是什么呢?其实还是为了表达作物一粒种子的质量。由于一粒种子质量太小,不易测定或者测定的结果误差较大,人们就测定1 000粒种子的质量,从而得出一粒种子的质量。你能从这里得到启发,测定常见的铁原子、水分子的质量吗?
问题1:如图,请你设计一种称量一个鸡蛋质量的简单方案。
提示:先称取一盘鸡蛋的质量,结合鸡蛋的数量就可以计算出一个鸡蛋的质量。
问题2:一种粒子的摩尔质量就是1 ml该粒子的质量,这种说法对吗?为什么?
提示:不对。摩尔质量的单位是g·ml-1或kg·ml-1,物质的质量的单位是g或kg。两者的意义不同,当摩尔质量以g·ml-1为单位,质量以g为单位时,两者仅仅在数值上相等。
探究1 摩尔质量的意义
问题3:H2O的相对分子质量、H2O的摩尔质量、1 ml H2O的质量三者之间有什么样的关系?
提示:对于水分子而言,三种物理量分别为18、18 g·ml-1、18 g。三者是三个不同的物理量,仅仅在数值上相等。
问题4:如果知道了一个水分子的质量为a g,能表示出水的摩尔质量吗?
提示:根据摩尔质量的定义,1 ml也就是NA个水分子的质量就是摩尔质量,所以是aNA g·ml-1。
问题5:16 g O2中含有的氧原子数是多少?
问题6:1个X原子的质量为a g,1个12C原子的质量为b g,NA为阿伏加德罗常数,如何用已知数据表示该原子的摩尔质量?
摩尔质量及其计算1.摩尔质量概念的认识(1)以g·ml-1为单位时,摩尔质量只是在数值上与相对分子质量或相对原子质量相等,但其内涵和单位是不同的。(2)对于指定的物质来说,其摩尔质量的值是一个定值,不随物质的物质的量的多少而改变。(3)对于混合物来说,该混合物的摩尔质量就是该混合物的平均摩尔质量。
(2)已知一个分子的质量时:M=m(分子)×NA。
1.(2021·河北石家庄期中)下列说法中正确的是( )A.1 ml O2质量为32 g·ml-1B.1 ml OH-的质量为17C.CO2的相对分子质量为44 gD.H2O的摩尔质量为18 g·ml-1
解析:1 ml氧气的质量为32 g,故A错误;1 ml氢氧根离子的质量为17 g,故B错误;二氧化碳的相对分子质量为44,故C错误;水的摩尔质量为18 g·ml-1,故D正确。
题点一 摩尔质量的意义
2.(2021·福建福州月考)下列有关青蒿素(化学式:C15H22O5)的叙述正确的是( )A.青蒿素的摩尔质量为×1023个青蒿素分子的质量约为282 gC.1 ml青蒿素的质量为282 g·ml-1D.282 g青蒿素中含有15个碳原子
题点二 摩尔质量的相关计算
3.(2021·宁夏银川月考)32.2 g的Na2SO4·10H2O物质的量为( ) ml mlC.1 ml D.0.1 ml
4.(2021·福建莆田检测)下列物质的物质的量最大的是( )A.1 g H2 B.11 g CO2C.8 g O2D.4.5 g H2O
1.误认为物质的量表示物质的数量,其实物质的量是一个专用于微观微粒数量计量的物理量。2.误认为摩尔是一个物理量,其实摩尔只是物理量——物质的量的单位。3.误认为阿伏加德罗常数只是一个数值,其实阿伏加德罗常数有自己的单位 ml-1。4.误认为物质的摩尔质量等于该物质的相对分子质量,其实两者仅仅在摩尔质量的单位为g·ml-1时在数值上相等。5.误认为1 ml H2O的摩尔质量是18 g,其实对于水而言,其摩尔质量在单位为g·ml-1时数值是一个定值(18)。
2015年,我国科学家因发现青蒿素而荣获诺贝尔奖。屠呦呦的团队从1969年开始,经历了青蒿素的提取、分离提纯、组成测定、结构测定、人工合成。在此基础上又陆续合成了双氢青蒿素、蒿甲醚,后者是抗氯喹恶性疟疾及凶险型疟疾的高效药物。
(1)0.5 ml青蒿素分子中,各组成原子的个数分别是多少?
答案:(1)N(C)=7.5NA,N(H)=11NA,N(O)=2.5NA
解析:(1)0.5 ml青蒿素分子中含有n(C)=7.5 ml,n(H)=11 ml,n(O)=2.5 ml。其原子个数分别为N(C)=7.5NA,N(H)=11NA,N(O)=2.5NA。
(2)80 g氧气与多少克的双氢青蒿素分子含有的氧原子数相等?
答案:(2)284 g
(3)等质量的三种药品,含有的分子个数之比是多少?
2021学年第3节 化学中常用的物理量——物质的量课文内容ppt课件: 这是一份2021学年第3节 化学中常用的物理量——物质的量课文内容ppt课件,共29页。PPT课件主要包含了分点突破1,分点突破2等内容,欢迎下载使用。
2021学年第3节 化学中常用的物理量——物质的量示范课课件ppt: 这是一份2021学年第3节 化学中常用的物理量——物质的量示范课课件ppt,共29页。PPT课件主要包含了分点突破1,分点突破2等内容,欢迎下载使用。
高中化学鲁科版必修1第1章 认识化学科学第3节 化学中常用的物理量-物质的量备课课件ppt: 这是一份高中化学鲁科版必修1第1章 认识化学科学第3节 化学中常用的物理量-物质的量备课课件ppt,共25页。PPT课件主要包含了自主阅读,自主检测,问题探究,知识点拨,典例引领,探究一,探究二,答案①⑤⑥,答案C等内容,欢迎下载使用。